免疫鸡群中分离的H9N2亚型禽流感病毒的分子特征研究
2012-08-07卞学兵曾嘉梅周继勇
卞学兵,曾嘉梅,颜 焰,廖 敏,周继勇
(浙江大学农业部动物病毒学重点实验室,浙江杭州310058)
自1994年陈伯伦等在我国广东某鸡场首次分离到 H9N2亚型禽流感病毒(Avian influenza virus,AIV)后,H9N2亚型AIV在我国的流行呈上升趋势,成为制约养禽业健康生产的重要病源[1-2]。由于在鸡群中流行的流感病毒的变异率大大高于水生鸟类,因此鸡是流感病毒的特殊宿主[3]。同时它也可以作为病毒的混合器和禽源、人源重组流感病毒的传播源,在流感病毒的进化中具有重要的作用[4]。本研究从疫苗免疫的发病蛋鸡体内分离一株H9N2亚型AIV,并对其进行遗传进化分析和致病性研究。
1 材料和方法
1.1 病料来源与病毒分离 采集浙江省建德市某鸡场出现产蛋下降和停止的送检发病鸡气管拭子和泄殖腔拭子。将拭子样品直接加入1 mL含有100 U/mL双抗的灭菌PBS中。4℃作用1 h,-70℃冻融一次后 12 000 r/min离心 10 min,取上清液以 0.22 μm滤膜过滤。处理后的上清即为病料研磨液,按0.2 mL/胚的剂量通过鸡胚尿囊腔接种10胚龄SPF鸡胚,37℃培养,收获死亡鸡胚的尿囊液。
1.2 SPF鸡胚、SPF鸡、血清、载体及感受态细胞 SPF蛋购自北京梅里亚维通实验动物技术有限公司;SPF鸡购自杭州荐量兽用生物制品有限公司,隔离器内饲养;H1~H13标准阳性鸡血清由中国农业大学刘金华教授惠赠;pMD18-T载体购自TaKaRa公司;Top10感受态细胞为本实验室保存。
1.3 血球凝集试验与血球凝集抑制试验 参照中华人民共和国AIV检测技术标准(GB/T 18936-2003)中血球凝集试验与血球凝集抑制试验的步骤进行。
1.4 分离物的鸡胚半数致死量(EID50)测定 按照文献[5]方法,将病毒尿囊液10倍倍比稀释(10-6~10-10),每稀释度病毒液接种6枚9日龄~11日龄SPF鸡胚0.1 mL/胚,定时观察并记录每枚鸡胚的死亡时间。采用Reed-Muench法计算EID50值。
1.5 静脉接种致病指数(IVPI) 按照OIE手册进行试验。将感染鸡胚尿囊液进行10倍倍比稀释,以0.1 mL/羽静脉接种10只6周龄SPF鸡。对照鸡接种等体积生理盐水。接种后每天观察鸡群情况,连续观察10 d并记录。鸡表现正常记为0,发病记为1,重病记为 2,死亡记为 3。最后计算 IVPI值(IVPI=攻毒组鸡10 d内评分总和/100)。
1.6 病毒基因组测序与序列分析 根据GenBank中流感病毒的基因组序列设计引物。TRIzol法常规抽提病毒RNA,使用Uni12通用引物(5'-AGCAAA AGCAGG-3'),按照 Fermentas Revertaid First Strand cDNA Synthesis Kit试剂盒说明书进行反转录。采用特异性引物进行PCR扩增。纯化目的片段并与pMD18-T载体连接,转化Top10感受态后取阳性克隆进行测序。将测定的基因序列与Genbank中登录的H9N2亚型AIV序列采用SEQMAN program 4.0(DNASTAR,Madison,WI)软件编辑,核苷酸序列比对及进化树绘制均采用MEGA 4.0软件。采用Influenza A Virus Genotype Tool进行基因型评测。
2 结 果
2.1 病毒的分离与鉴定 发病鸡主要表现为呼吸困难、精神萎靡、口中有黏液、排黄绿色稀粪,剖检可见病鸡气管内有大量黏液、肺部淤血。将泄殖腔拭子样本接种鸡胚,48 h出现鸡胚死亡,死亡鸡胚的尿囊液能够凝集鸡红细胞。分离病毒株的EID50值为108.0/0.1 mL,IVPI值为0.17。AIV血凝抑制试验结果显示,分离株的血球凝集特性能够被H9亚型AIV阳性血清抑制,而不被其他亚型AIV阳性血清抑制,采用AIV亚型引物进行鉴定,结果表明分离株为H9N2亚型AIV,命名为A/Chicken/Jiande/01/2009(H9N2)(A/CK/JD/1/09)。
2.2 全基因组克隆与序列分析 以分离株总RNA为模板,用特异性引物分别扩增A/CK/JD/1/09株的8个基因片段(图1)。序列分析结果显示:A/CK/JD/1/09的HA基因的裂解位点为PSRSSR/GL[6]、受体结合位点为183N、190A、226L和228G[7],其226位出现人源流感病毒结合位点。A/CK/JD/1/09的NA基因在茎部63位~65位缺失3个氨基酸,该特征性缺失只在Ck/BJ/1/94-Like谱系的病毒株中出现。A/CK/JD/1/09的M2蛋白出现了S31N突变,其被认为与流感病毒对金刚烷胺的抵抗能力有关[8]。目前的研究表明NS1序列P42S、D92E和V149A这3个突变与病毒毒力密切相关[9-11]。A/CK/JD/1/09的NS1在这3个位点的氨基酸均表现为42S、92D和149A。NS1蛋白羧基端的4个氨基酸残基为PDZ蛋白结合区域[11],而A/CK/JD/1/09由于第220位氨基酸突变为终止子,羧基端缺失了12个氨基酸,失去了PDZ蛋白结合能力。PB2蛋白中E627K和D701N突变影响流感病毒毒力和对哺乳动物的感染能力,A/CK/JD/1/09株在627位为E,701位为D,显示出弱毒株的特征[12]。
糖基化位点预测显示:A/CK/JD/1/09的HA蛋白存在8个潜在的糖基化位点,分别位于第11位、87位、123位、200位、280位、287位、295位和374位的天冬酰胺上,其中S297P的突变在第295位形成一个新的糖基化位点。A/CK/JD/1/09的NA蛋白存在5个潜在的糖基化位点,分别位于第67位、83位、143位、197位和231位的天冬酰胺上,S399N的取代丢失了399位(原402位)的糖基化位点。

2.3 基因型与进化分析 A/CK/JD/1/09与A/Chicken/Zhejiang/HJ/2007的8个基因型完全一致,与A/HongKong/1073/99和A/Quail/HongKong/G1/97存在HA和NA两个基因型不一致,与A/Chicken/Shanghai/F/98和A/Chicken/Beijing/1/94存在PB2基因型不一致,与A/duck/HongKong/Y439/97仅有PB1、NP、M和NS基因型一致(表1)。由进化树显示A/CK/JD/1/09的 HA基因(图 2)、NA基因、NS基因属于Ck/BJ/1/94-Like分支,M2基因、PB2基因属于G1-Like谱系(图2),NP基因、PA基因和PB1基因属于 Ck/SH/F/98-Like谱系(图 2),这些结果显示A/CK/JD/1/09为一株重排病毒。

表1 A/Chicken/Jiande/01/2009株基因型Table 1 The genotype of A/Chicken/Jiande/01/2009
3 讨 论
本次H9N2亚型AIV在浙江省建德市蛋鸡场爆发,鸡群疫苗免疫后血清H9N2抗体效价高于8 log2,发病的蛋鸡表现出典型的流感症状,并且出现采食量和产蛋量下降,严重影响了鸡群的健康,造成严重的经济损失。本研究从病鸡的泄殖腔拭子中分离到A/Chicken/Jiande/01/2009(H9N2)株,该分离株在48h内能够导致鸡胚死亡,并且表现出较高的血凝效价,表明该病毒株在消化道中均有大量分布。
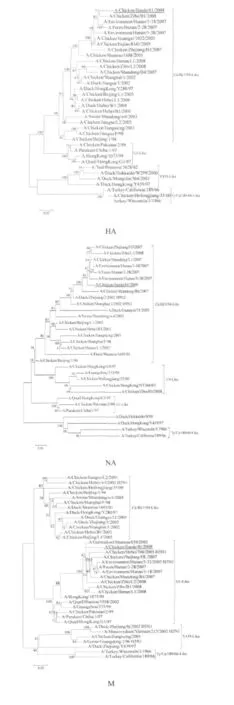
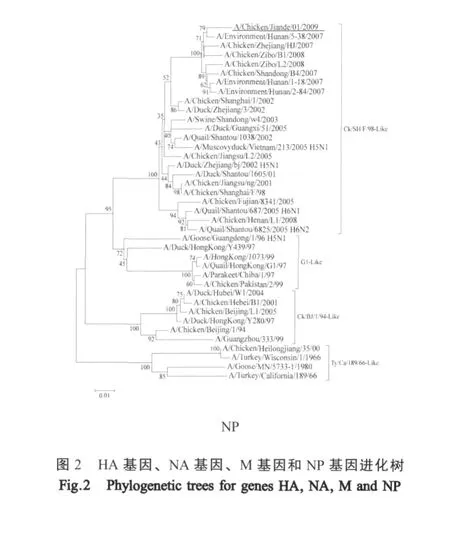
HA蛋白裂解位点是判定病毒致病力的首要因素,高致病性AIV一般在裂解位点附近存在几个连续的碱性氨基酸[6],PB2的627位氨基酸和701位氨基酸被认为与宿主特异性和病毒复制能力密切相关[12]。A/CK/JD/1/09在这些位点上均显示出保守的弱毒特征,而IVPI结果也表明A/CK/JD/1/09为弱毒株。另外,A/CK/JD/1/09的HA受体结合位点出现了人流感病毒结合位点226Leu,其NA基因在茎部存在3个氨基酸的缺失,M基因出现了金刚烷胺的耐药性突变,这些均表明H9N2亚型在鸡群中的变异速度较快,并且在环境压力下表现出了新的生物学特性。
本研究分离的H9N2亚型AIV A/CK/JD/1/09株与A/Chicken/Zhejiang/HJ/2007株的同源性最高(96%以上),表明A/CK/JD/1/09株可能直接由A/Chicken/Zhejiang/HJ/2007演化而来,但IVPI结果表明A/CK/JD/1/09株仍为一个低致病力病毒株。遗传进化分析显示,A/CK/JD/1/09株的8个基因片段分别属于 CK/BJ/1/94-Like、CKk/SH/F/98-Like和 G1-Like 3个不同谱系,表明A/CK/JD/1/09为发生基因重排的H9N2亚型AIV。而A/CK/JD/1/09是从疫苗免疫鸡群中分离获得的,其形成过程需要更深入研究。
[1]陈伯伦,张泽纪.禽流感研究1鸡A型禽流感病毒的分离和血清学初步鉴定[J].中国兽医杂志,1994,20(10):3-5.
[2]Li Cheng-jun,Yu Kang-zhen,Tian Guo-bin,et al.Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J].Virology,2005,340(1):70-83.
[3]Suarez D L.Evolution of avian influenza viruses[J].Vet Microbiol,2000,74(1-2):15-27.
[4]Zhang Ping-hu,Tang Ying-hua,Liu Xiao-wen,et al.A novel genotype H9N2 influenza virus possessing human H5N1 internal genomes has been circulating in poultry in eastern China since 1998[J].J Virol,2009,83(17):8428-8438.
[5]Reed L J,Muench H.A simple method of estimating fifty percent endpoints[J].Am J Hyg,1938,27(3):493-497.
[6]Rohm C,Suss J,Pohle V,et al.Different hemagglutinin cleavage site variants of H7N7 in an influenza outbreak in chickens in Leipzig,Germany[J].Virology,1996,218(1):253-257.
[7]Hensley S E,Das S R,Bailey A L,et al.Hemagglutinin receptor binding avidity drives influenza A virus antigenic drift[J].Science,2009,326(5953):734-736.
[8]Schnell J R.Structure and mechanism of the M2 proton channel of inluenza A virus[J].Nature,2008,451:591-595.
[9]Jiao Pei-rong,Tian Guo-bin.A single-amino-acid substitution in the NS1 protein changes the pathogenicity of H5N1 avian influenza viruses in mice[J].J Virol,2008,82(3):1146-1154.
[10]Li Ming-yong.Homology modeling and examination of the effect of the D92E mutation on the H5N1 nonstructural protein NS1 effector domain[J].J Mol Model,2007,13(12):1237-1244.
[11]Jackson D,Killip M J,Galloway C S,et al.Loss of function of the influenza A virus NS1 protein promotes apoptosis but this is not due to a failure to activate phosphatidylinositol 3-kinase(PI3K)[J].Virology,2009,396(1):94-105.
[12]Ping J,Dankar S K.PB2 and hemagglutinin mutations are major determinants of host range and virulence in mouse-adapted influenza A virus[J].J Virol,2010,84(20):10606-10618.
