阿莫西林脉冲释药微丸的研制
2012-08-07许志仁卞俊蒋雪涛原丽慧解放军第411医院药学科上海20044江西中医学院药学院南昌0004第二军医大学药学院上海2004
许志仁,卞俊,蒋雪涛,原丽慧(1.解放军第411医院药学科,上海20044;2.江西中医学院药学院,南昌 0004;.第二军医大学药学院,上海 2004)
近年来,随着时间生物学和时辰药理学的发展,释药方式符合人体昼夜节律变化的口服脉冲释药系统受到药学研究者的广泛关注[1]。目前,国内、外已设计和研究了多种不同释药机制的定时释药制剂,主要包括脉冲片剂和脉冲微丸[2,3]。阿莫西林(Amoxicillion,羟氨苄青霉素)是一种半合成青霉素药物,因其可口服给药而广泛用于临床[4]。青霉素类抗生素属时间依赖性抗菌药,当药物浓度在病原体最低抑菌浓度(MIC)以上时,发挥抗菌作用;当浓度为最低杀菌浓度(MBC)的4~5倍时,杀菌作用达到饱和,此时再提高药物浓度已不能提高杀菌作用[5]。因此临床应用阿莫西林时为少量多次给药,以使血药浓度超过MIC的时间维持到最长。为使患者睡眠时药物浓度能维持在MIC之上,又避免半夜服药带来的不便,本试验设计制备了阿莫西林脉冲释药微丸,其可在晚上临睡前(22:00)时服用,间隔4 h后于次日凌晨释放出治疗量的药物,以达到使血药浓度超过MIC的时间维持到最长的效果。
1 仪器与试药
Mini Glatt流化床(德国Glatt公司);85-2型恒温磁力搅拌器(上海司乐仪器厂);HL-2恒流泵(上海新波无线电厂);SE3001F电子天平(奥豪斯仪器上海有限公司);UV-2550紫外分光光度计(日本岛津公司);ZRS-8G智能溶出试验仪(天津天河医疗仪器有限公司);标准筛(浙江省上虞市纱筛厂)。
阿莫西林原料药及对照品(珠海联邦制药股份有限公司,批号:3081032009,纯度:99.6%);空白蔗糖丸芯(杭州高成生物营养技术有限公司,规格:直径0.4~0.6 mm);羟丙基甲基纤维素(HPMC,型号:E5)、乙基纤维素水分散体(Surelease,固含物:25%)均由上海卡乐康包衣技术有限公司提供;羧甲基淀粉钠(CMS-Na,上海晶纯实业有限公司);阿莫西林脉冲释药微丸(解放军第411医院药学科自制,含量:18.1%)。
2 阿莫西林含量及体外释放度测定方法的建立
2.1 吸收波长的选择
精密称取阿莫西林对照品适量,加蒸馏水溶解、稀释,制备成浓度为133 μg·mL-1的阿莫西林对照品溶液,按紫外分光光度法(《中国药典》2010年版二部附录ⅣA)[6]在200~700 nm波长范围内进行紫外扫描,同时将制剂所用辅料按处方比例用水制备成溶液,摇匀过滤后进行扫描。结果显示,阿莫西林在272 nm波长处有最大吸收,而辅料在此吸收可忽略。同法对阿莫西林在0.1 mol·L-1盐酸(以下简称盐酸)和pH6.8磷酸盐缓冲液(PBS)中进行紫外扫描,吸收峰位和强度与在水中的相似,所以选择272 nm作为测定波长。阿莫西林和辅料在水中的紫外扫描光谱见图1。

图1 紫外扫描光谱图A.阿莫西林;B.辅料Fig 1 UV spectrumA.amoxicillin;B.excipients
2.2 标准曲线的建立
精密称取阿莫西林对照品适量,置于量瓶中,分别以蒸馏水、盐酸、PBS为溶出介质,制备成1 mg·mL-1的对照品母液,再分别精密吸取0.5、1.0、1.5、2、2.5 mL置于10 mL量瓶中,分别加对应溶出介质稀释,得浓度分别为50、100、150、200、250 μg·mL-1的溶液,以各自的溶出介质为空白,于272 nm波长处测定吸光度(Y)。以Y对浓度(X)进行线性回归,得回归方程:水:Y=0.002 7X+0.005 4(r=0.999 9);盐酸:Y=0.002 6X+0.013 9(r=0.999 9);PBS:Y=0.002 7X+0.008(r=0.999 9)。
2.3 回收率试验
按处方量80%、100%、120%精密称取阿莫西林对照品各3份,按处方量比例加入100%标示量的辅料,加溶出介质摇匀,过滤,取续滤液于272 nm波长处分别测定吸光度,计算。结果,低、中、高浓度平均回收率分别为(99.75±0.63)%、(100.23±0.74)%、(99.94±1.22)%,总平均回收率为99.97%,RSD=0.86%。
2.4 精密度试验
按“2.2”项下方法操作,制备浓度分别为100、150、200 μg·mL-1的低、中、高3个样品溶液,每个浓度的溶液各于第1天重复测定5次,以后每天测定1次,连续测定5 d。根据标准曲线方程计算含量,得日内RSD=0.86%,日间RSD=0.96%。
2.5 体外释放度测定方法建立
按《中国药典》2010年版二部附录ⅩD释放度测定法第一法(篮法)装置[6],水为释放介质,转速100 r·min-1,介质温度(37±0.5)℃,在预定时间间隔内(每隔1 h取样1次,共取样12 h)取样10 mL,0.45 μm微孔滤膜过滤,并即时补加介质10 mL。为考察介质pH对释放度的影响,分别以水、盐酸、PBS为释放介质进行试验,用紫外分光分度计在波长272 nm处测定吸光度,计算药物累积释药百分率。
3 处方与制备
3.1 各层包衣液的处方与制备
3.1.1 含药层包衣液处方与制备。处方:5%的阿莫西林原料药+2%HPMC。制备:取黏合剂HPMC溶于适量热水中,磁力搅拌至完全溶解,再缓慢加入药物,搅拌均匀,制备成HPMC质量分数为2%、药物质量分数为5%的混悬液,将此混悬液过120目筛,以防止在包衣过程中小颗粒堵塞喷嘴。
3.1.2 溶胀层包衣液处方与制备。处方:3%的CMS-Na的乙醇-水混悬液。制备:将CMS-Na分散在乙醇-水(1∶1,V/V)混合液中,搅拌均匀。
3.1.3 控释层包衣液处方与制备。处方:乙基纤维素水分散体。制备:取乙基纤维素水分散体用水稀释成固含物为10%的溶液,搅拌均匀即得,备用。
3.2 包衣微丸的制备
将空白蔗糖丸芯置于流化床内,按含药层、溶胀层、控释层的顺序依次包衣,进风温度55℃,喷液速率1.5~1.8 mL·min-1,流化压力0.25~0.28 bar,雾化压力1.8 bar,以底喷方式进行包衣,每次包衣完成后流化干燥20 min。包衣增重计算公式:包衣增重(%)=(包衣后重-包衣前重)/包衣前重×100%。
3.3 含药丸芯释放度考察
按“2.5”项下方法考察含药丸芯(只有含药层,未包溶胀层及控释层的微丸)的释放度。结果表明,含药丸芯中药物在30 min内基本释放完全,因此,含药丸芯不会成为阻滞药物释放的因素。释放曲线见图2。

图2 含药丸芯体外释药曲线Fig 2 Dissolution profiles of core containing drug in vitro
3.4 微丸释药的影响因素考察
3.4.1 溶胀层(CMS-Na)包衣增重对药物释放的影响。保持控释层增重28%,以CMS-Na为溶胀层材料,改变溶胀层包衣增重分别为12%、16%、20%,制备包衣微丸,并分别进行累积释药百分率测定,释放曲线见图3。
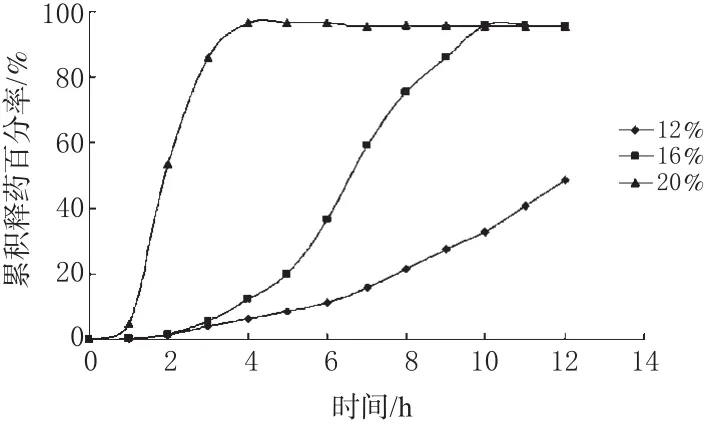
图3 溶胀层不同包衣增重时微丸体外释药曲线Fig 3 Dissolution profiles of pellets with different thickness of swelling layer in vitro
图3结果表明,溶胀层包衣增重达到一定的厚度时,才能获得较好的脉冲释放效果。保持控释层包衣增重28%、溶胀层增重12%时,释药曲线类似缓释曲线,这可能是由于溶胀层薄,所产生的膨胀力不足,无法撑破控释层衣膜形成裂口,导致药物层被溶解的药物只能通过已被胀大、但未破裂的控释层衣膜扩散所致[7],因此药物释放量少;当溶胀层包衣增重达16%时,溶胀层已经产生足够的膨胀力来撑破控释层衣膜,于4 h时滞后开始释药,随后的4 h累积释药百分率达80%以上;当溶胀层包衣膜增重到20%时,时滞为2 h,时滞已达不到要求。因此本试验选用溶胀层包衣增重16%。
3.4.2 控释层(乙基纤维素水分散体)包衣增重对药物释放的影响。保持溶胀层包衣增重为16%,改变控释层包衣增重分别为24%、28%、32%,制备包衣微丸,并分别进行累积释药百分率测定,释放曲线见图4。

图4 控释层不同包衣增重时微丸体外释药曲线Fig 4 Dissolution profiles of pellets with different thickness of controlled-release layer in vitro
图4结果表明,保持溶胀层包衣增重16%、控释层包衣增重24%,释药时滞为2 h,达不到理想要求;控释层包衣增重32%,释药曲线并没有呈现出期望的脉冲释放效果,而是呈现出一种缓释的状态;而控释层包衣增重28%时,药物释放可时滞4 h,并达到脉冲释放的效果。
3.4.3 介质pH对药物释放的影响。将溶胀层包衣增重16%、控释层包衣增重为28%的脉冲控释微丸分别置于水、盐酸、PBS释放介质中进行累积释药百分率测定。结果,药物在3种介质中的释放无显著性差异,即微丸中药物的释放不依赖于介质pH值。
3.5 优化条件验证试验
按照上述因素考察得出的优化条件,制备了3批微丸,以水为释放介质测定其累积释药百分率,考察其重现性。结果表明,优化的条件重现性良好。12 h内累积释药百分率(1、4、9、12 h)数据如表1,释药曲线见图5。

表1 3批样品累积释药百分率Tab 1 Accumulation drug release rate of 3 batches of samples

图5 3批样品体外释药曲线Fig 5 Drug release profiles of 3 batches of samples
4 讨论
本试验采用双层包衣模型制备脉冲释药微丸,该模型溶胀层为水溶胀型材料,控释层为惰性高分子材料,药物的释放通过外层膜的破裂而触发,与渗透压调节原理[8]和有机酸诱导原理[9]所制备的脉冲控释微丸相比,该模型时滞后的释药速率快,药物释放不受外界pH值的影响。
含药包衣液要过120目筛,防止药粉中的细小颗粒堵塞喷嘴。溶胀层材料CMS-Na分散在乙醇-水(1∶1)混合液中,以减小黏度,防止包衣过程中微丸之间的粘连。
对优化的条件进行了验证试验,结果表明,该优化条件下包衣得到的3批微丸的重现性良好,说明优化条件稳定可靠。制备的阿莫西林脉冲释药微丸具有体外脉冲释放作用。
阿莫西林口服后吸收迅速,约75%~90%可自胃肠道吸收,食物对药物的吸收影响不显著,阿莫西林在多数组织和体液中分布良好,口服阿莫西林0.25 g达峰时间为1~2 h。因此为了能维持普通制剂单日内6~8 h间隔给药的疗效,本试验设计了时滞为4 h左右的脉冲释药微丸,时滞后4 h释药达到80%左右,目的是在4 h脉冲释放的阿莫西林在有即刻吸收相之外还具有延迟吸收相,使得在给药间隔期内的大部分时间内,阿莫西林的血药浓度都能维持在MIC之上,达到高效的抑菌能力,同时能满足制剂的设计要求[10,11]。
张瑜[12]等制备了盐酸维拉帕米脉冲控释微丸,其内层溶胀层采用CMS-Na,中间阻滞层选用HPMC,外层衣膜采用含致孔剂的乙基纤维素,制得的脉冲微丸释药曲线与本试验的释药曲线类似。与其相比,本试验减少了包衣层数(无需包中间阻滞层),简化了包衣过程,并考察了溶出介质pH对微丸释药的影响。
[1]杨亚萍,王 柏.脉冲释药系统的新进展[J].药学进展,2009,33(6):260.
[2]何绍雄.时间药理学与时间治疗学[M].天津:天津科学技术出版社,1994:114-120.
[4]陈新谦,金有豫,汤 光.新编药物学[M].第17版.北京:人民卫生出版社,2011:44.
[5]William A,Craig MD.A review of newer antimicrobial formulations for overcoming pneumococcal resistance[J].The American Journal of Medicine,2004,117(3A):16.
[6]国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅣA、ⅩD.
[7]郑春丽,郭 涛,宋洪涛,等.双氯芬酸钠脉冲控释微丸的制备与体外释放影响因素的研究[J].中国药学杂志,2003,38(2):113.
[8]Schmltz P,Kleinebudde P.A new multi-particulate delayed release system.PartⅠ:Dissolution properties and release mechanism[J].J Controlled Release,1997,47(2):181.
[9]Shinji N,Minako N,Yoshiyuki H.An organic acid-induced sigmoid release system release system for oral controlled-release preparations.Ⅲ.Elucidation of the anomalous drug release behavior through osmotic pumping system mechanism[J].Int J Pharm,1997,148(1):85.
[10]孟 玲,王 永,张 静,等.阿莫西林颗粒剂人体生物利用度及生物等效性研究[J].药学与临床研究,2008,16(1):29.
[11]王 平,余 宁,冯林会.根据阿莫西林药代动力学参数制定临床用药方案与常规用药方案的疗效比较[J].西部医学,2010,22(8):1 525.
[12]张 瑜,魏变芬.盐酸维拉帕米脉冲控释微丸的研制[J].中国医药工业杂志,2003,34(5):236.
