酶法降解黑木耳多糖工艺研究
2012-08-07欧阳乐王振宇
欧阳乐,王振宇,2*
(1.东北林业大学 林学院,哈尔滨 150040;2.哈尔滨工业大学 食品科学与工程学院,哈尔滨 150090)
近年来,有越来越多的动植物及食药用真菌来源的活性寡糖及其衍生物被开发应用于医药、化妆品、保健品、饲料添加剂、农药、农业等领域,并不断发现一些寡糖成分的新功能[1-4]。目前我国“富贵病”人数量明显增多,心血管疾病在我国的发病率和死亡率明显提高。经研究表明,黑木耳多糖、寡糖作为重要的生物活性物质,具有多种生物功能。而黑木耳多糖经过降解后,形成数目巨大的木耳寡糖。而且黑木耳寡糖分子链短、水溶性极强,活性优于多糖。β-葡萄糖苷酶已经应用于多糖的降解中,本项研究为将来开发功能性食品以及药物提供了理论基础[9]。
1 材料与方法
1.1 实验材料
黑木耳、3,5-二硝基水杨酸(北京钨信精细制剂厂)、柠檬酸、磷酸氢二钠、β-葡萄糖苷酶(上海楷洋生物技术有限公司)。
DNS试剂的配制[15]:称取3.25g 3,5-二硝基水杨酸溶于少量水中,移入500mL容量瓶,加2mol/L氢氧化钠溶液162.5mL,再加入22.5g丙三醇,摇匀,定容至500mL,储存于棕色瓶放置在冰箱中待用。
β-葡萄糖苷酶:精确称取β-葡萄糖苷酶0.0050g溶于少量pH值为5的磷酸-柠檬酸缓冲溶液中,定容于25mL容量瓶中。4℃冷藏。
1.2 实验仪器
电热恒温鼓风干燥箱;粉碎机;电子分析天平;旋转蒸发仪;离心机;精密pH计;紫外分光光度计;真空冷冻干燥机。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制[13-14]

表1 葡萄糖标准溶液的配制 mL
准确称取干燥后的葡萄糖0.5000g,用蒸馏水溶解并定容至500mL容量瓶中。按表1进行配置,充分混匀后于沸水浴5min。冷却后加入蒸馏水2mL,混匀。以管1为空白对照,540nm波长下测吸光度。绘制吸光度-葡萄糖浓度曲线。
1.3.2 酶对黑木耳多糖的降解
1.3.2.1 β-葡萄糖苷酶用量对降解多糖释放还原糖量的影响。取7个具塞试管每管加入2.4mL多糖溶液,依次加入0、0.1、0.2、0.3、0.4、0.5、0.6mLβ-葡萄糖苷酶溶液,剩余用缓冲溶液补上,在保证多糖浓度为0.3%,pH值为5.0,反应温度为50℃,反应1h后立即加入1.5mL DNS试剂终止反应,沸水浴10min后,冷却,加入5mL缓冲溶液。以第一组未加酶的管为空白样在540nm条件下测定其吸光度值,平行3次。
1.3.2.2 温度对β-葡萄糖苷酶降解多糖释放还原糖量的影响。取7个具塞试管每管加入2.6mL多糖溶液以及0.4mL酶溶液,分别置于40、45、50、55、60、65、70℃的热水中,确保多糖浓度为0.3%,pH值为5.0,反应时间为1h。反应结束后立即加入1.5mL DNS试剂,沸水浴10min后冷却,每管加入2mL缓冲溶液。空白样为只加入缓冲溶液的多糖溶液,然后在540nm条件下测定其吸光度值,平行3次。
1.3.2.3 pH值对β-葡萄糖苷酶降解多糖释放还原糖量的影响。取7个具塞试管,每管加入pH值从4到7不同的多糖溶液2.6mL以及0.4mL酶溶液,确保多糖浓度为0.3%,温度为55℃,酶用量为0.4mL。反应1h后立即加入1.5mL DNS试剂终止反应,然后沸水浴加热10min,冷却后加入2mL缓冲溶液。空白样为只加入相应pH值的0.3%多糖缓冲溶液,每个pH值设置一个,在540nm条件下测定其吸光度值,平行3次。
1.3.2.4 时间对β-葡萄糖苷酶降解多糖还原糖释放量的影响。配制浓度为0.3% 、pH值为5.5、加酶量为0.4mL的多糖溶液3mL,在反应温度为55℃时。反应后在10、20、30、60、90、120min时取样立即加入DNS试剂终止反应,沸水浴10min后,冷却后加入2mL pH值为5.5的缓冲溶液。空白样为加入酶后立即加入1.5mL DNS试剂,沸水浴处理10min的样品。然后在540nm下测定其吸光度值,平行3次。
1.3.3 响应面法优化降解条件
根据单因素试验结果根据单因素试验结果,以降解温度、pH值、酶用量3个因素为自变量,还原糖的释放量为响应值,进行三因素三水平响应面试验,使用MINITABL16软件,根据Box-Benhnken的中心组合试验设计原理,采用响应面法对β-葡萄糖苷酶对黑木耳多糖的条件进行优化。试验因素与水平设计见表2。

表2 响应面分析因素水平编码表
2 结果与分析
2.1 葡萄糖标准曲线绘制图

图1 葡萄糖标准曲线图
从图1中可得葡萄糖的浓度与吸光度值之间的关系为:溶液中还原糖质量(x)=(吸光度(y)-0.002)/1.633,相关系数R2=0.999符合要求。表明葡萄糖在设定的浓度范围内与吸光值呈良好的线性关系,符合朗伯比尔定律,该方程可用于还原糖的定量测定。
2.2 酶用量对β-葡萄糖苷降解效果的影响

图2 酶用量对β-葡萄糖苷降解效果的影响
从图2可以看出当酶用量为0.4mL时,随着酶用量的增加而增加,到达0.4mL时还原糖的释放量达到了最大。此后随着酶用量的增加还原糖的释放量不再增多,从以上分析得出当0.3%的多糖与0.2g/mL的β-葡萄糖苷酶的体积比为15∶2时酶降解达到饱和值。
2.3 温度对β-葡萄糖苷酶降解效果的影响
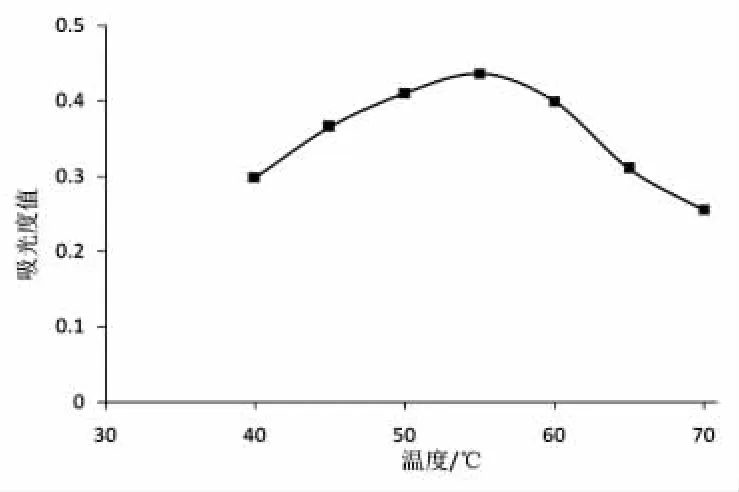
图3 温度酶降解效果的影响图
由图3可知,当多糖浓度为0.3%,pH值为5.0时,β-葡萄糖苷酶的降解黑木耳多糖的最适降解温度为55℃。在40~55℃之间随着温度的增高还原糖的释放量酶活性不断加大不断增大,在55℃时达到了最大值,在55~70℃之间随着温度的不断升高,酶不断失活,还原糖的释放量也不断减少。
2.4 pH值对β-葡萄糖苷酶降解效果的影响
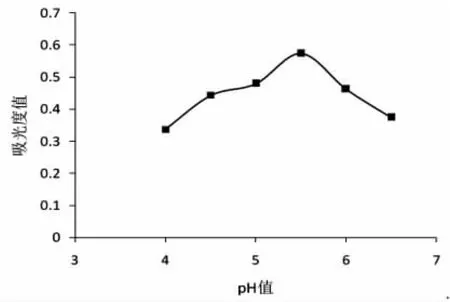
图4 pH值酶降解效果的影响图
由图4可知,当多糖浓度为0.3%,反应温度为55℃,酶用量为0.4mL时。当降解体系的pH值为5.5时β-葡萄糖苷酶对黑木耳多糖的降解达到了最大。在pH值在4~5.5之间时还原糖的释放量随pH值的增大而增大,在pH值5.5时达到最大值,在5.5~6.5时随pH值的增大还原糖的释放量降低。
2.5 反应时间对β-葡萄糖苷酶降解效果的影响

图5 反应时间对酶降解效果的影响图
由图5可知,β-葡萄糖苷酶对黑木耳多糖的降解时间非常的短,从反应开始到20min还原糖的释放量随时间的增加基本上呈直线增大。20min此后随着时间的增加降解趋于平缓还原糖的释放量也不再增加,因此选择20min比较的经济。
2.6 响应面法优化降解条件结果

表3 响应面分析方案及试验结果

表4 响应面回归模型方差分析
根据表1安排试验,对试验结果回归拟合所得回归模型如下:
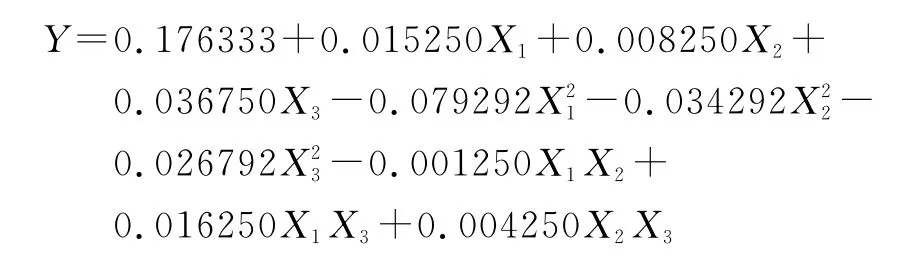
由表3、4可知,决定系数R2=98.96%,响应面回归模型高度显著(P=0.000),模型失拟项(P=0.063),不显著,说明该二次模型可以较好地描述各因素与响应值之间的真实关系。

图6 Y=f(X2,X3)的响应面与等高线

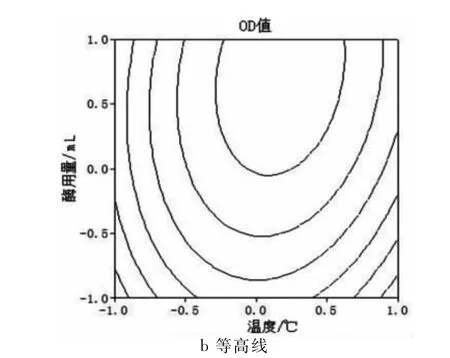
图7 Y=f(X1,X3)的响应面与等高线
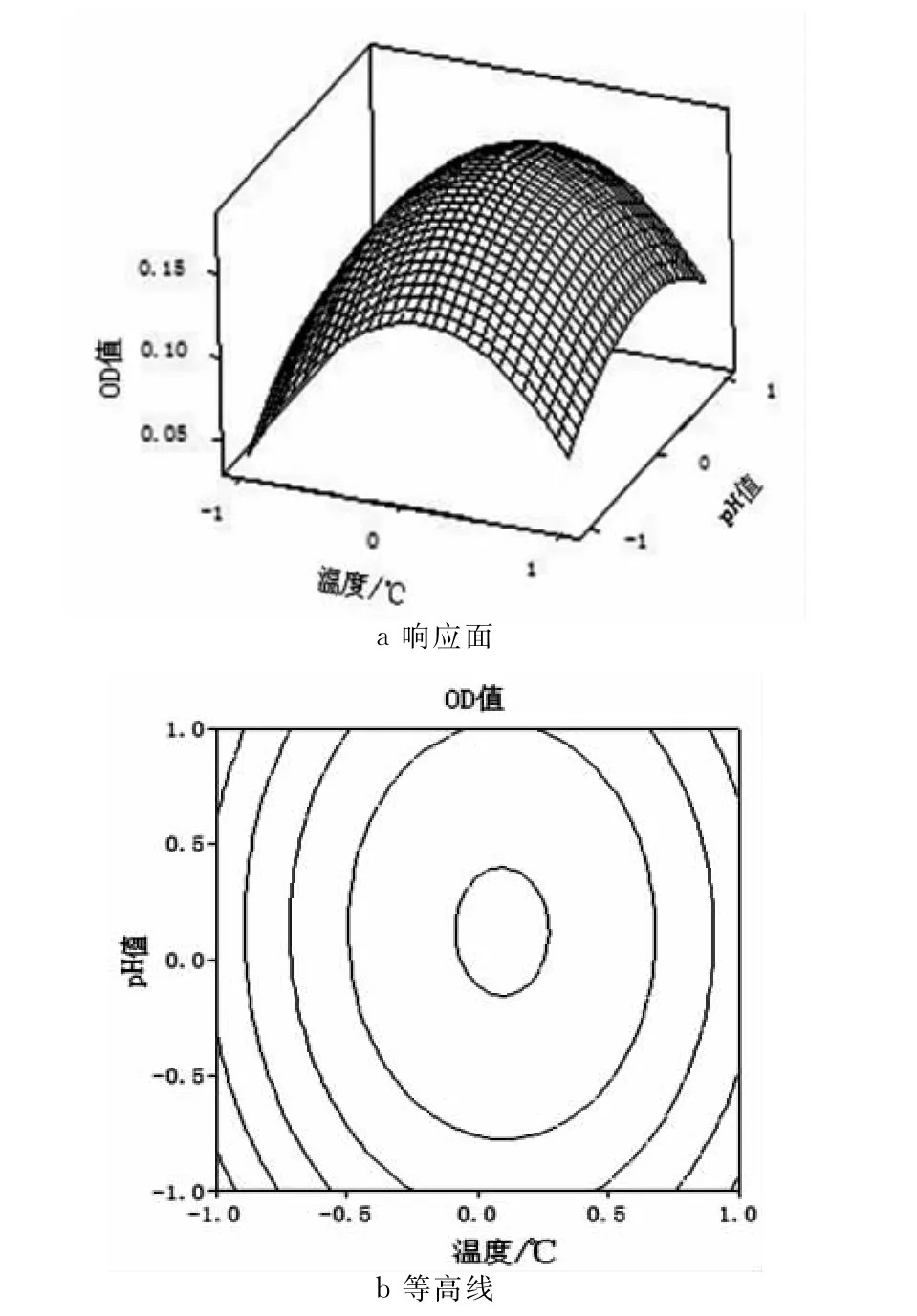
图8 Y=f(X1,X2)的响应面与等高线
由图6、7、8可知,酶的用量对β-葡萄糖苷酶降解黑木耳多糖的影响最大。温度和pH值影响较小。依据回归模型的数学分析并综合响应图确定降解的最佳工艺参数为:降解温度55.9℃,pH值为5.58,酶用量为0.475mL。回归模型预测的得率理论值为0.1948。取温度55.9℃,pH 值为5.58,酶用量为0.475mL,试验重复3次。3次平行试验的OD值分别为0.195,0.192和0.198,平均为0.195,与理论预测值相比相对误差为0.03%,可见该模型能较好地模拟和预测β-葡萄糖苷酶对于黑木耳多糖的降解效果。
3 结论
本试验研究酶法对黑木耳多糖进行降解,运用了DNS法测定还原糖的释放量作为研就究指标,并用响应面法进行了优化。得出了最佳的降解工艺。结论如下:最佳的降解工艺为多糖浓度为0.3%,温度55℃、pH值5.5、反应时间20min,每3mL多糖加入0.02%葡萄糖苷酶0.4mL时。响应面优化后,得出最佳工艺条件为:降解温度55.9℃、pH值5.58、酶用量0.475mL。通过本文研究分析得出,酶法降解反应后降解产物具有分子量分布窄、均一性好等优点。该研究结果为将来制备黑木耳多糖寡糖、小分子黑木耳多糖在医学、功能性食品开发等方面的应用打下了坚实的理论基础。
[1]曹雷,陈红君.黑木耳多糖的研究进展[J].长春师范学院学报(自然科学版),2009,28(2):57-60.
[2]吴瑞宪.黑木耳的质量标准及营养成分[J].中国林副特产,1996(1):21-22.
[3]张才擎.黑木耳药用研究的进展[J].中国中医药科技,2001,8(5):339-340.
[4]熊艳,车振明.黑木耳多糖的研究进展[J].中国食物与营养,2006(10):26-27.
[5]陈艳秋,周丽萍,尹英敏.黑木耳子实体水溶性多糖提取工艺的研究[J].吉林农业大学学报,2003,25(4):470-472.
[6]朱磊,王振宇,周芳,等.响应面法优化微波辅助提取黑木耳多糖工艺研究[J].中国食品学报,2009,9(2):53-58.
[7]Sone Y,Kakuta M,Misaki A.Isolation and characterization of polysaccharides of kikurgae fruit body of Auricularia auriculajudae[J].Agric Biol Chen,1978,42(2):417-422.
[8]韩春然,马永强,唐娟,等.黑木耳多糖的提取及降血糖作用[J].食品与生物技术学报,1998,25(5):111-114.
[9]李远华.β-葡萄糖苷酶的研究进展[J].安徽农业大学学报,2002,29(4):421-425.
[10]谢占玲,吴润.纤维素酶的研究进展[J].草业科学,2004,21(4):27-32.
[11]Willberg D M,Lang P S.Degradation of 4-chlorophenol,3.,4-dichloroaniline,and 2,4,6-trinitrotoluene in an electrohydraulic discharge reactor[J].Environ Sci Technol,1996,30:2526-2534.
[12]刘大同,许敏,余学海.异相法降解制备低分子量壳聚糖[J].高分子材料科学与工程,2002,18(6):51-54.
[13]钟建业,吴成业,陈丽娇.壳聚糖酶法降解研究[D].福建农林大学,2009.
[14]王在贵,黄世霞,张永跃等.酶法降解茯芩多糖技术初步研究[J].中国饲料,2008(8):41-43.
[15]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
