一株拮抗纹枯病菌放线菌的筛选及鉴定
2012-08-06崔宇辉王媛媛汪鹏荣高爱同曹丽凌蒋冬花
崔宇辉,王媛媛,汪鹏荣,高爱同,曹丽凌,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华 321004)
水稻纹枯病俗称“花脚病”,为水稻三大病害之一,尤以密植矮秆杂交稻的高产田发病最为普遍和严重,往往导致水稻叶片枯死、结实率降低、千粒质量减轻,一般发病田块能导致减产15% ~20%,严重时可达60% ~70%,甚至绝收[1-2].该病在早、中、晚稻上均有发生,危害性极大,在世界各稻作区普遍发生,且近年来有逐年加重的趋势[3].
水稻纹枯病是由立枯丝核菌侵染引起的一种真菌病害,又称云纹病,其典型症状是云纹状病斑和菌核[4].2010年,于艳敏等[5]筛选到一株芽孢杆菌属的生防菌R13对水稻纹枯病病原菌具有一定的抑制作用,抑菌率为67.8%,可以导致正常的纹枯病菌丝体发生扭曲、变形、原生质外溢,并且明显延迟了菌核的形成时间.2011年,农倩等[6]从水稻体内分离得到的细菌菌株B196对水稻纹枯病菌的生长有较强的抑制作用.在缺乏水稻抗纹枯病品种的情况下,生产中用的药剂有:井冈霉素、灭锈胺、苯甲丙环唑乳油等[7-8].其中,最常用的井冈霉素自1973年由上海农药研究所开发应用以来,一直是抗纹枯病的当家药品,但因长期连续使用,造成病菌抗药性增强,从而使防治效果不理想[9].所以,有必要探索利用拮抗微生物进行生物防治的新途径,筛选出更多的有应用价值的拮抗纹枯病的新菌种.
本研究对采自金华市各地的68份土壤中的放线菌株进行分离筛选,获得一株对纹枯病菌具有较强拮抗作用的放线菌Sh-43菌株,通过形态特征、培养特征、生理生化特征和16S rDNA序列及系统发育分析等方面的研究,鉴定Sh-43菌株为吸水链霉菌(Streptomyces hygroscopicus).
1 材料与方法
1.1 供试菌株
水稻纹枯病菌(Rhizoctonia solani)由浙江省农业科学院提供;苦瓜枯萎病菌(Fusarium oxysporum)、小麦赤霉病菌(Fusarium graminearum)和番茄叶霉病菌(Cladosporium fulvum)由浙江师范大学化学与生命科学学院微生物实验室保存.
1.2 培养基
放线菌的分离和保存采用高氏一号培养基;拮抗放线菌株的筛选及苦瓜枯萎病菌、小麦赤霉病菌和番茄叶霉病菌的培养均采用PDA培养基.
高氏一号培养基:可溶性淀粉 20 g,KNO31 g,NaCl 0.5 g,K2HPO40.5 g,MgSO40.5 g,FeSO40.5 g,琼脂 20 g,水 1 000 mL,pH 7.2 ~7.4.
1.3 土壤中放线菌的分离与纯化
将土壤自然风干,在28℃下放置5~7 d,用研钵磨细.采用稀释涂布法对土壤中的放线菌进行分离,纯化后的单菌落转接到高氏一号斜面培养基上编号培养,保存待用.
1.4 平皿对峙法筛选拮抗放线菌
将PDA培养基融化后,倒入灭菌的平板中冷却凝固,以平板原点为中心,中央接入直径为6 mm的放线菌菌饼,其周围等距离处接入3个直径为6 mm的纹枯病菌菌饼(见图1(b)),每处理3次重复,置于28℃恒温箱中培养,5 d后测量各筛选菌菌落边缘和纹枯病菌菌落边缘之间的抑菌带宽度.
1.5 抑菌谱的测定
以筛选到的抑菌作用最强的菌株作为目的菌株,与苦瓜枯萎病菌、小麦赤霉病菌、番茄叶霉病菌3种植物病原真菌进行对峙培养,测定抑菌谱.
1.6 菌株形态特征、生理生化特征及培养特征的测定
待鉴定的菌株进行插片培养,将所观察到的形态结果显微照相.培养特征及生理生化特征的测定参照文献[10],并记录各项指标.
1.7 菌体DNA的提取、16S rDNA序列PCR扩增及系统发育树的构建

图1 Sh-43菌株的菌落形态和对纹枯病菌的抑菌效果
按照上海生工生物工程技术服务有限公司SK1201-UNIQ-10柱式细菌基因组DNA抽提试剂盒说明书提取样品的基因组 DNA.通用引物7f的序列为5'-CAGAGTTTGATCCTGGCT-3',1540r的序列为5'-AGGAGGTGATCCAGCCGCA-3'.
聚合酶链式反应(PCR)扩增程序为:98℃预变性5 min,95℃变性35 s,55℃复性35 s,72℃延伸1 min 30 s,35个循环扩增;72℃延伸8 min.
PCR产物纯化后经上海生工生物工程技术有限公司完成测序.将测得的基因序列通过Blast程序与GenBank中核酸数据库(http://www.ncbi.nlm.nih.gov/blast)进行对比分析,并利用 MEGA4以 N-J法绘制系统发育树.
2 结果与分析
2.1 放线菌菌株的获得
在采集到的68份土样中,利用稀释涂布法,根据菌落形态、大小、色泽与生长速度等特征,分离纯化得到了406株放线菌.
2.2 平皿对峙法筛选拮抗放线菌
利用平皿对峙法测定放线菌株对纹枯病菌的拮抗作用.结果表明:分离到的406株放线菌中共有42株对纹枯病菌有不同程度的抑制作用(见表1),占分离菌株总数的10.3%,它们产生的生物活性物质可对纹枯病菌起到抑制作用,靠近活性菌株一侧的纹枯菌菌丝表现生长速度减弱;Sh-43菌株的抑菌效果最好,抑菌带宽度为28.3 mm(见图1).
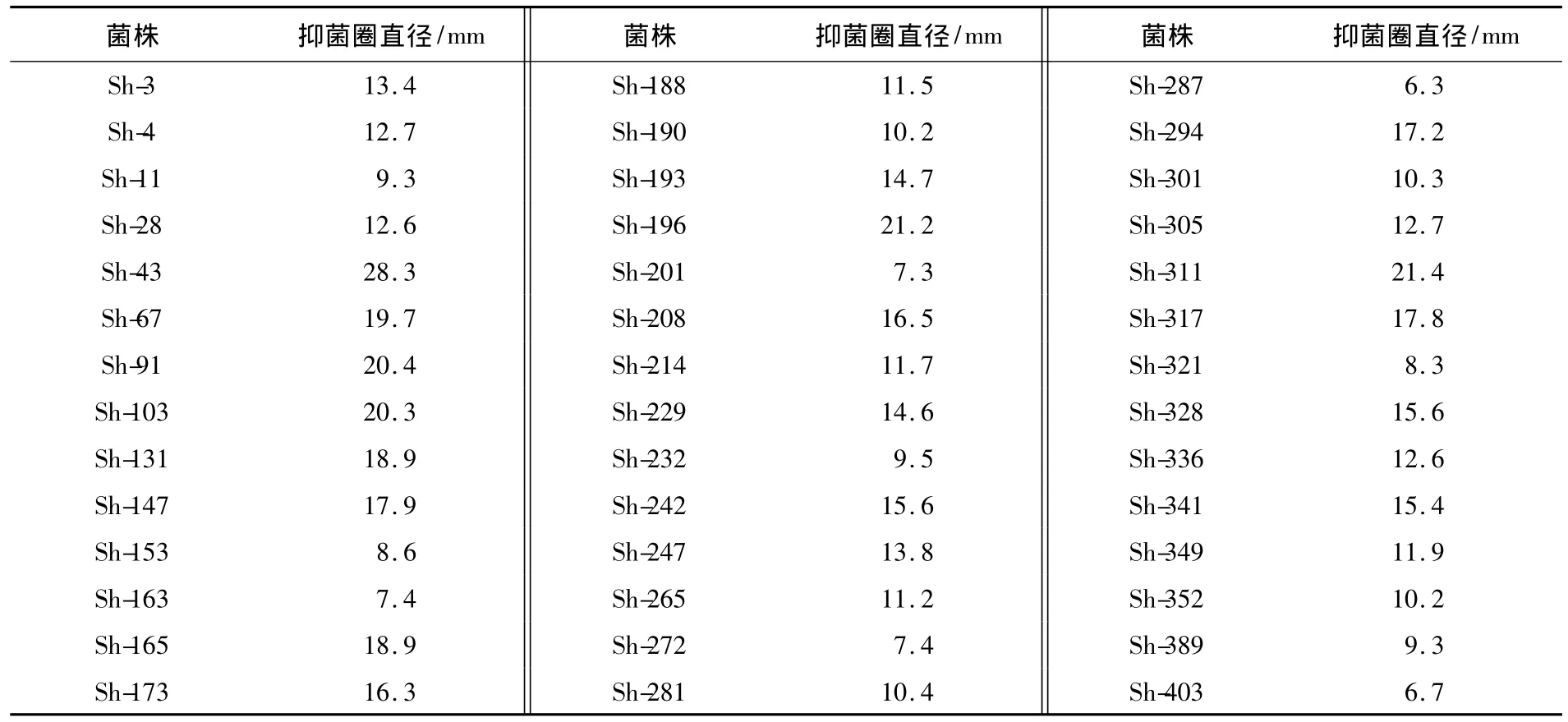
表1 42株对水稻纹枯病菌有抑制作用的放线菌株
2.3 抑菌谱的测定
供试菌株的筛选结果表明,Sh-43菌株对纹枯病菌有较强的拮抗作用.利用对峙培养法测定Sh-43菌株的抑菌谱,结果如表2所示.由此可知,Sh-43菌株对苦瓜枯萎病菌、小麦赤霉病菌和番茄叶霉病菌这3种植物病原真菌也具有较强的拮抗作用.
2.4 Sh-43菌株形态特征、生理生化特征及培养特征的测定
菌株形态观察结果表明,Sh-43菌株能够在高氏一号培养基上生长,可形成气生菌丝,气生菌丝成熟后发育成孢子丝,孢子丝呈波曲或螺旋状(见图2).

表2 Sh-43菌株抑菌谱的测定结果
生理生化实验结果(见表3)表明:Sh-43菌株可使明胶缓慢液化,可缓慢水解淀粉,牛奶不凝固,伏谱(V-P)实验呈阴性,可利用肌醇、麦芽糖、D-甘露醇、果糖、蔗糖、半乳糖、乳糖、可溶性淀粉等8种碳源.
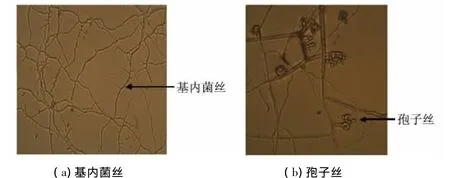
图2 Sh-43菌株的显微特征(×400)

表3 Sh-43菌株生理生化特征的测定结果
2.5 16S rDNA序列及系统发育分析
Sh-43菌株基因组 DNA的提取结果见图3.采用细菌的16S rDNA通用引物进行PCR扩增,获得一长度为1 388 bp的基因(见图3),序列测定由上海生工生物工程技术有限公司完成.
基于16S rDNA序列分析进行细菌鉴定是国际上通用的鉴定技术.一般认为:16S rDNA序列同源性小于98%,可以认为种不同;同源性小于93% ~95%,可以认为属不同[11].将Sh-43菌株16S rDNA基因序列通过Blast比对分析,Sh-43菌株与吸水链霉菌的遗传距离最小,同源性高达100%.基于16S rDNA基因序列建立的链霉菌属系统发育树见图4.故将Sh-43菌株鉴定为吸水链霉菌(Streptomyces hygroscopicus).
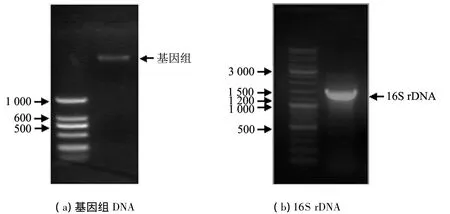
图3 Sh-43菌株的电泳分析图
3 结论与讨论
本研究通过对不同地区土样中放线菌的分离筛选,获得了一株拮抗纹枯病菌的Sh-43菌株.通过观察菌株的形态和培养特征,分析其生理生化特性,根据文献[12]确定Sh-43菌株为链霉菌属,再结合菌株的16S rDNA序列的聚类分析结果,最后将其鉴定为吸水链霉菌(Streptomyces hygroscopicus).
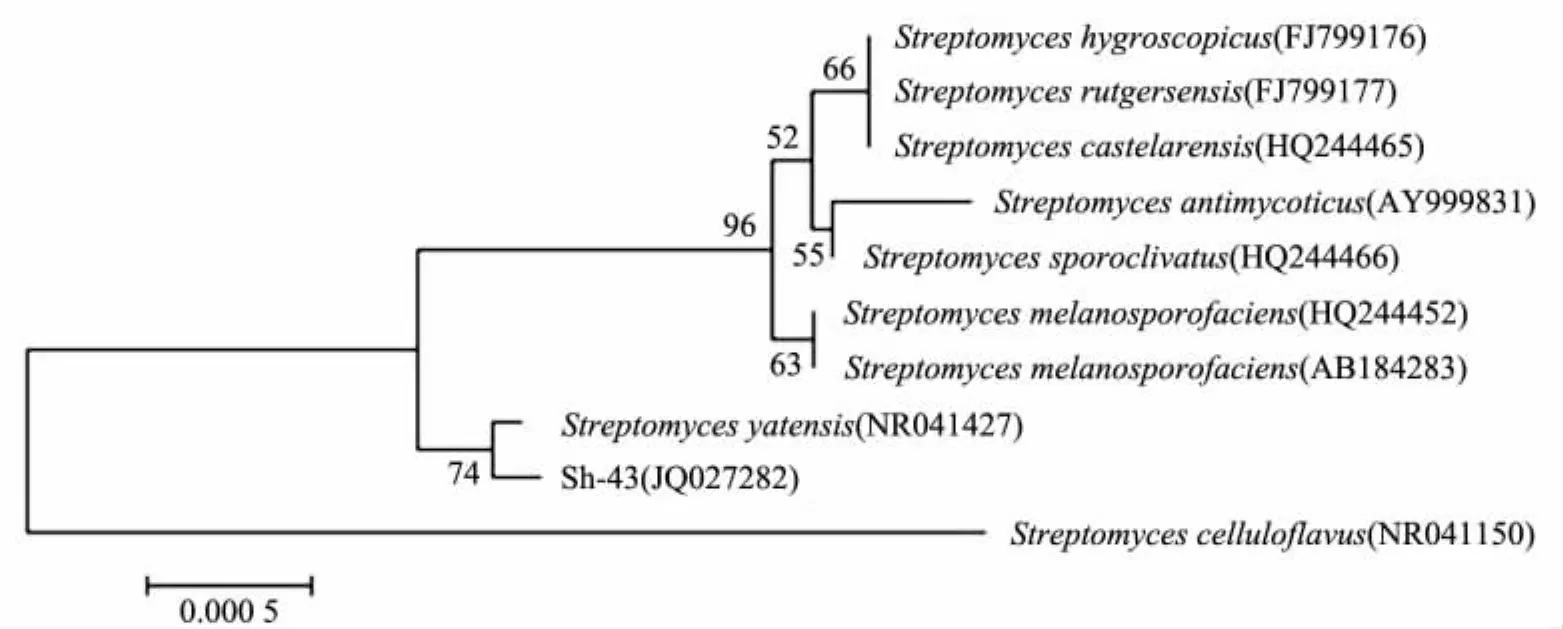
图4 基于16S rDNA基因序列建立的链霉菌属(Streptomyces)系统发育树
国内已有不少有关应用拮抗微生物防治纹枯病的研究报道.陈宏州等[13]从水稻根围土样中筛选得到对水稻纹枯病菌有显著拮抗活性的放线菌菌株,其发酵滤液在稀释10倍时对水稻纹枯病菌的抑菌活力达46.21%.郑爱萍等[14]从健康的水稻植株、感染纹枯病水稻植株及根际土壤、秧田水、菌核上分离出了能拮抗纹枯病的细菌,从中挑选在实验室中作用效果明显的菌株,对其分别进行了抑菌率、致畸性、对菌核的萌发和形成的影响度等抗生性检测,并在液培条件下检测了其对水稻的出苗率、叶片及根系干质量的促生性,结果表明在田间试验中混合3种菌处理有较好的防治效果.
生理生化实验显示,吸水链霉菌Sh-43菌株对环境具有较强的适应能力;抗菌谱测定结果表明,Sh-43菌株对真菌类病原菌表现出明显的拮抗能力.吸水链霉菌Sh-43菌株对纹枯病菌产生明显的抑菌圈,表明该菌可以合成某种抗菌物质并释放到周围环境,其对纹枯病菌的生长和繁殖具有较强的抑制作用.因此,Sh-43菌株有希望作为生防菌用于水稻纹枯病的防治.但是,这些具有生物活性的抗菌物质的结构和功能现在尚不清楚,正在进一步的研究中.
[1]任春梅,高必达,何迎春.水稻抗纹枯病的研究进展[J].植物保护,2001,27(4):32-36.
[2]李洪刚.水稻纹枯病的诊断与防治[J].农村经济与科技,2001(8):34.
[3]Zeng Yuxiang,Ji Zhijuan,Ma Liangyong,et al.Advances in mapping loci conferring resistance to rice sheath blight and mining Rhizoctonia solani resistant resources[J].Rice Science,2011,18(1):56-66.
[4]赖传雅.农业植物病理学[M].华南本.北京:科学出版社,2003:21-27.
[5]于艳敏,赵北平,高洪儒,等.生防菌R13对水稻纹枯病病原菌的抑制作用[J].黑龙江农业科学,2010(1):3-4.
[6]农倩,陈雪凤,黎起秦,等.水稻内生细菌B196的鉴定及其对水稻纹枯病的防治作用[J].中国生物防治学报,2011,27(1):99-103.
[7]Zhang Chuanqing,Liu Yinghui,Ma Xinying,et al.Characterization of sensitivity of Rhizoctonia solani,causing rice sheath blight,to mepronil and boscalid[J].Crop Protection,2009,28(5):381-386.
[8]但汉曙.赤壁市水稻纹枯病重发原因及防治对策[J].湖北植保,2010(6):15.
[9]朱卫刚,胡伟群,陈杰.噻呋酰胺与井冈霉素复配对防治水稻纹枯病的增效作用[J].中国稻米,2011,17(2):54-55.
[10]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975.
[11]Fry N K,Warwick S,Saunders N A,et al.The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family Legionellaceae[J].Journal of General Microbiology,1991,137(5):1215-1222.
[12]瓦克斯曼S A.放线菌:第二卷属和种的分类、鉴定和描述[M].阎逊初,译.北京:科学出版社,1974.
[13]陈宏州,杨敬辉,朱桂梅,等.水稻纹枯病菌拮抗放线菌的筛选与生防潜能评价[J].江苏农业科学,2009(5):141-143.
[14]郑爱萍,李平,王玲霞,等.水稻纹枯病拮抗细菌的筛选及抗生性研究[J].西南农业学报,2001(1):78-81.
