芍红消积颗粒的质量标准研究Δ
2012-08-06弓晓东谈瑄忠毛春芹陆兔林苏丹南京中医药大学药学院南京20046南京市中医院南京2000
弓晓东,谈瑄忠,毛春芹,陆兔林,苏丹(.南京中医药大学药学院,南京20046;2.南京市中医院,南京 2000)
芍红消积颗粒由赤芍、红花、黄芪等11味药组成,具有活血化瘀、清热利湿之功效,用于治疗湿热瘀阻型子宫内膜异位症引起的痛经,伴见月经过多或经期延长等。临床研究发现,该方能改善全身和局部血液循环、降低血浆前列腺素含量和抑制异位内膜生长,对子宫内膜异位症具有良好的疗效[1]。笔者对本品进行质量标准的制定,对赤芍等4味药材进行薄层色谱(TLC)鉴别;同时由于赤芍是本方主药,芍药苷是赤芍饮片中主要成分之一,因此采用高效液相色谱(HPLC)法测定方中芍药苷的含量,以便有效控制产品质量,提高临床疗效。
1 仪器与试药
1100 HPLC仪、VWD检测器(美国安捷伦公司);FA1104万分之一电子分析天平(上海天平仪器厂);硅胶G薄层板(青岛海洋化工厂);水浴锅(巩义市英峪予华仪器厂);WD-9403C紫外分析仪(北京市六一仪器厂);KQ-500B超声波清洗器(昆山市超声仪器有限公司)。
芍药苷对照品和赤芍、三棱、黄芪、黄芩对照药材(中国食品药品检定研究院,批号分别为110736-200427、121093-200405、121521-200602、120974-200407、120955-200305);芍红消积颗粒(批号:090916、090918、090920)和相应阴性样品均由南京中医药大学药学院自制;水为重蒸水,乙腈、甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 定性鉴别
2.1.1 赤芍的TLC鉴别 取本品1.3 g,加70%甲醇20 mL,超声(功率:500 W,频率:40 kHz)30 min,滤过,滤液蒸干,残渣加乙醇2 mL使溶解,作为供试品溶液;另取赤芍对照药材0.5 g,同法制成对照药材溶液;再取缺赤芍阴性样品1.3 g,同法制成阴性对照溶液。照TLC法[2]试验,吸取上述3种溶液各10 μL,分别点于同一硅胶G薄层板上,以二氯甲烷-甲醇-乙酸乙酯(8∶4∶1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,于105℃加热至斑点显色清晰[3]。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点;阴性对照无干扰。赤芍的TLC见图1。
2.1.2 三棱的TLC鉴别 取本品5 g,加乙醚30 mL,加热回流0.5 h,滤过,滤液蒸干,残渣加甲醇0.5 mL使溶解,作为供试品溶液;另取三棱对照药材1 g,同法制成对照药材溶液;再取缺三棱的阴性样品5 g,同法制成阴性对照溶液。照TLC法[2]试验,分别吸取上述溶液各10 μL,点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯(8∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视[4]。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性对照无干扰。三棱的TLC见图2。
2.1.3 黄芪的TLC鉴别 取本品 12 g,加水 40 mL,超声(功率:500 W,频率:40 kHz)30 min,过滤,滤液用水饱和正丁醇振摇提取2次,每次30 mL,合并正丁醇提取液,用氨试液洗涤2次,每次20 mL,弃去氨试液,分取正丁醇振摇提取液,水浴蒸干,残渣加蒸馏水3~5 mL使溶解,通过D101大孔树脂柱(内径1.5 cm,长12 cm),加水50 mL洗脱,弃去水液,再用40%乙醇30 mL洗脱,弃去乙醇洗脱液,再用70%乙醇50 mL洗脱,收集洗脱液,蒸干,用甲醇定容至2 mL,作为供试品溶液;取黄芪对照药材4 g,同法制成对照药材溶液;再取缺黄芪的阴性样品2 g,同法制成阴性对照溶液。照TLC法[2]试验,分别吸取上述溶液各10 μL,点于同一硅胶G薄层板上,以二氯甲烷-甲醇-水(30∶10∶1)为展开剂,展开,取出,晾干,喷以5%硫酸乙醇溶液,于105℃加热至斑点显色清晰[5]。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性对照无干扰。黄芪的TLC见图3。
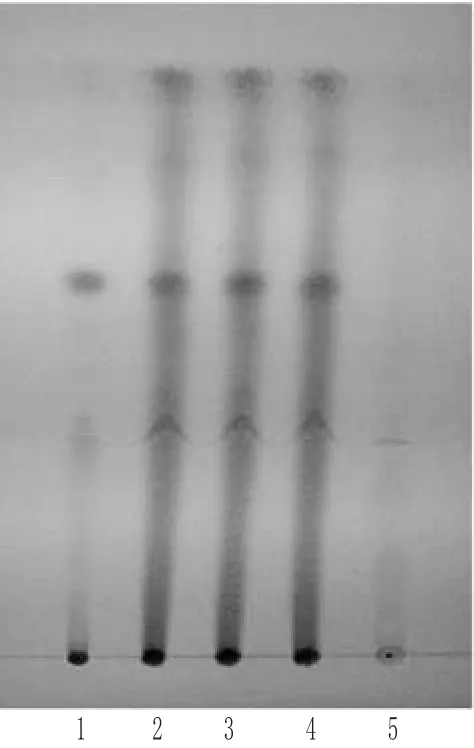
图1 赤芍的TLC1.赤芍对照药材;2~4.供试品;5.阴性对照Fig 1 TLC of Paeoniae Radix Rubra1.Paeoniae Radix Rubra reference substance;2~4.test samples;5.negative control
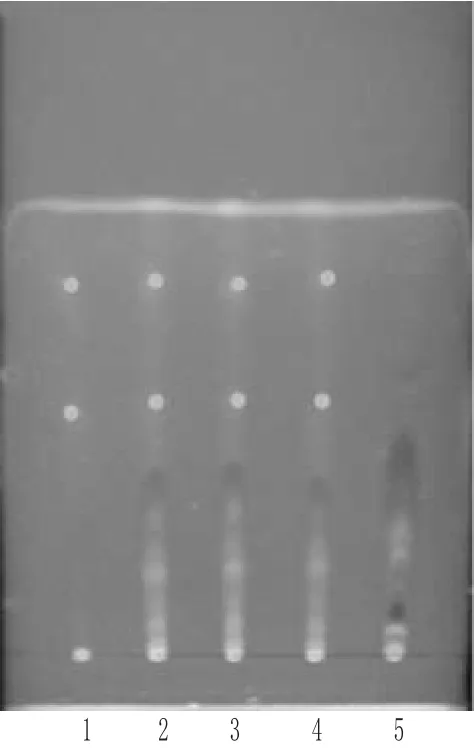
图2 三棱的TLC1.三棱对照药材;2~4.供试品;5.阴性对照Fig 2 TLC of Sparganium stoloniferum1.Sparganii Rhizoma reference substance;2~4.test samples;5.negative control
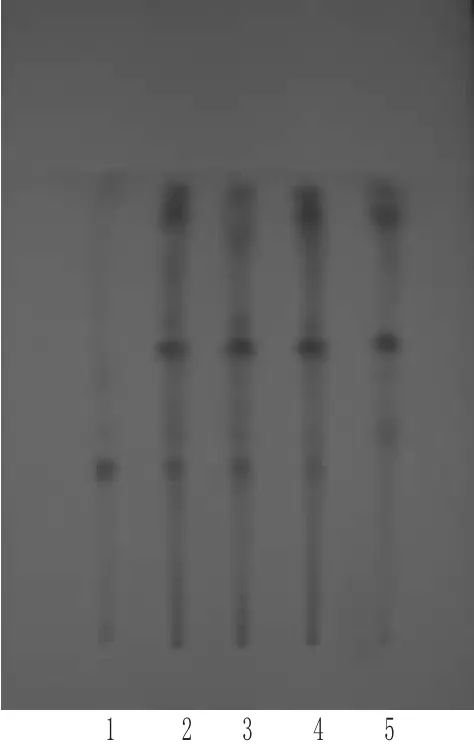
图3 黄芪的TLC1.黄芪对照药材;2~4.供试品;5.阴性对照Fig 3 TLC of Astragali Radix1.Astragali Radix reference substance;2~4.test samples;5.negative control
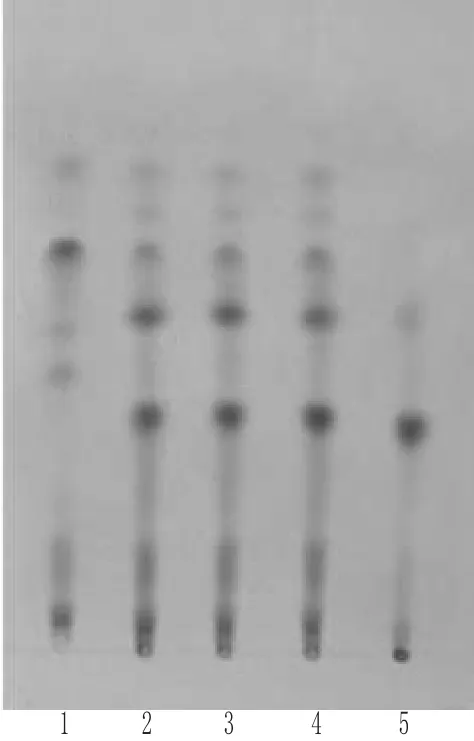
图4 黄芩的TLC1.黄芩对照药材;2~4.供试品;5.阴性对照Fig 4 TLC of Scutellaria baicalensis1.Scutellariae Radix reference substance;2~4.test samples;5.negative control
2.1.4 黄芩的TLC鉴别 取本品5 g,研细,加甲醇40 mL,超声(功率:500 W,频率:40 kHz)20 min,滤过,滤液挥干,残渣加水50 mL使溶解,离心(4 800 r·min-1,15 min),倾出上清液,盐酸调pH值为1~2,用乙酸乙酯振摇提取2次,每次30 mL,合并乙酸乙酯提取液,水浴蒸干,残渣用甲醇定容至1 mL,作为供试品溶液;另取黄芩对照药材1 g,同法制成对照药材溶液;再取缺黄芩的阴性样品5 g,同法制成阴性对照溶液。照TLC法[2]试验,分别吸取上述溶液各10 μL,点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-甲醇-甲酸(10∶3∶1∶2)为展开剂,展开,取出,晾干,喷以2%三氯化铁乙醇溶液,于105℃加热至斑点显色清晰。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性对照无干扰。黄芩的TLC见图4。
2.2 含量测定
2.2.1 色谱条件与系统适用性试验 色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(30∶70);流速:1.0 mL·min-1;检测波长:230 nm;柱温:30 ℃;进样量:10 μL。理论板数按芍药苷色谱峰计算应不低于3 000,分离度>1.5。在此条件下,芍药苷色谱峰与其他组分峰可达基线分离,供试品与芍药苷对照品在相同时间点出现同一色谱峰,而阴性对照未出现色谱峰[6]。色谱见图5。
2.2.2 对照品溶液的制备 精密称取经五氧化二磷减压干燥至恒重的芍药苷对照品5.21 mg,置10 mL容量瓶中,加流动相制成每1 mL含0.521 mg的溶液,摇匀,定容,作为对照品溶液。
2.2.3 供试品溶液的制备 取本品0.6 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称定重量,回流30 min,放冷,再称定重量,用70%甲醇补足失重,摇匀,滤过,弃去初滤液,取续滤液,即得。
2.2.4 标准曲线的制备 精密量取浓度为0.521 mg·mL-1的芍药苷对照品溶液,加甲醇依次稀释成浓度为0.052 1、0.104 2、0.208 4、0.312 6、0.416 8、0.521 0 mg·mL-1的系列溶液,各取10 μL进样,按上述色谱条件测定。以检测浓度(X)为横坐标,峰面积积分值(Y)为纵坐标,制备标准曲线,得回归方程为Y=13 541.05X-25.34(r=0.999 8,n=6)。结果表明,芍药苷检测浓度在0.052 1~0.521 0 mg·mL-1范围内与峰面积积分值呈良好的线性关系。
2.2.5 精密度试验 取芍药苷对照品溶液适量,按上述色谱条件重复进样6次,测定峰面积。结果,RSD=0.53%(n=6),表明仪器精密度良好。
2.2.6 稳定性试验 取同一供试品溶液适量,在室温下放置0、2、4、6、8、10 h,按上述色谱条件测定。结果,RSD=0.85%(n=6),表明供试品溶液在10 h内稳定。
2.2.7 重复性试验 精密称取同一批芍红消积颗粒样品适量,共6份,分别按“2.2.3”项下方法制成供试品溶液,按上述色谱条件测定。结果,芍药苷的平均含量为5.334 2 mg·g-1,RSD=1.25%(n=6),表明方法重复性良好。
2.2.8 加样回收率试验 精密称取已知含量(含量:5.334 2 mg·g-1)的样品共9份,每份0.3 g,分别置于具塞锥形瓶中,每3份一组,分别加入芍药苷对照品溶液0.8、1.0、1.2 mL(重新制备芍药苷对照品溶液,浓度为1.538 mg·mL-1),按“2.2.3”项下方法制备供试品溶液,按上述色谱条件测定,计算加样回收率。结果,平均回收率为97.49%,RSD=1.80%(n=9)。
2.2.9 样品含量测定 取3个批号的样品适量,每批平行取样3份,分别按“2.2.3”项下方法制备供试品溶液,按上述色谱条件测定,以外标两点法测定并计算芍药苷的含量,结果见表1。
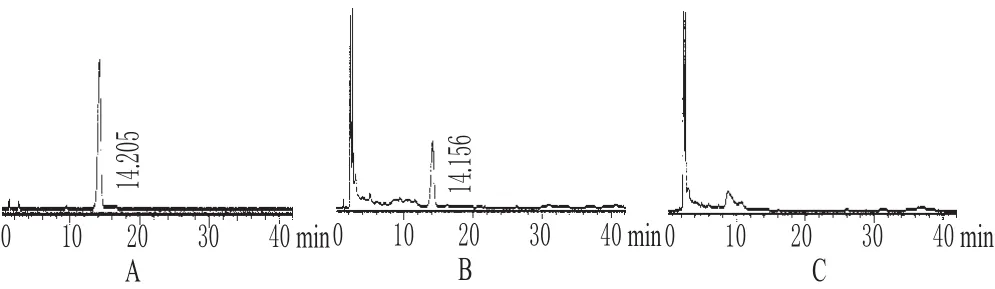
图5 高效液相色谱图A.芍药苷对照品;B.供试品;C.缺赤芍阴性对照Fig 5 HPLC chromatogramsA.paeoniflorin control;B.test sample;C.negative control without Paeoniae Radix Rubra
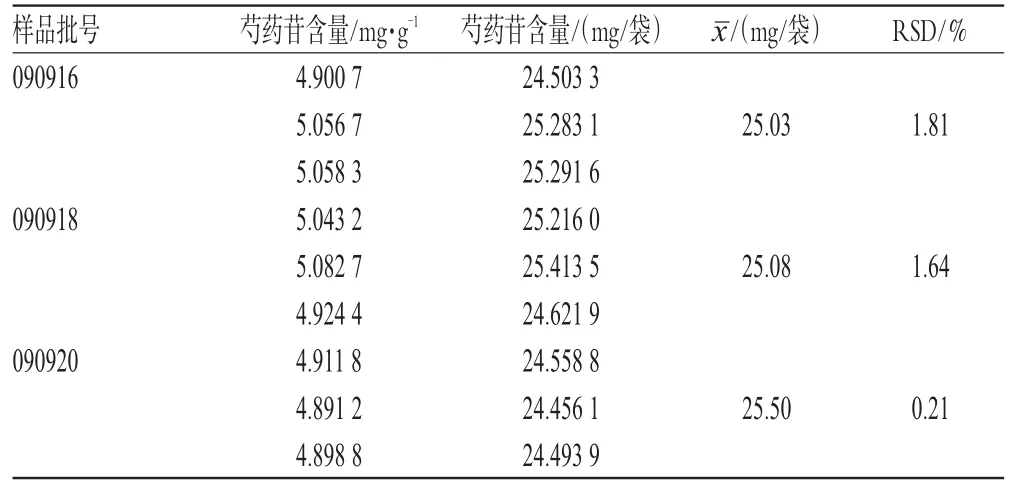
表1 样品含量测定结果(n=3)Tab 1Content determination of samples(n=3)
3 讨论
3.1 前期处理
药材来源及其品质的好坏直接影响成品制剂的质量,不同产地的药材含量均有差异,即使一地所产药材,也会因为采收时间、贮藏、运输等条件的不同而出现很大的差异。在整个项目研究中,一方面围绕着药材来源及含量测定,保证制剂原料符合药典规定;另一方面最大限度的保证指标性成分的转移率,最终得出最佳工艺。
3.2 TLC鉴别
芍红消积颗粒是一个复方制剂,成分较为复杂,影响鉴别的干扰因素较多。通过参考文献和预试验,对方中赤芍等进行TLC鉴别,得到理想的TLC条件。在对红花、昆布、蒲公英3味药材进行TLC鉴别时,供试品在与对照药材相同位置处可见明显同一斑点,但阴性对照有干扰,尤其是红花的鉴别,采用了3种试验方法都不能很好鉴别,推测该检测成分可能在制剂中其他药材中也存在,故鉴别较复杂,这一问题有待进一步研究[7]。本试验也探讨了制剂中土鳖虫的TLC鉴别[8],采用在展开前,展开箱先用展开剂预平衡和加大点样量等方法,均没有特征斑点出现,推测该检测成分可能在制剂工艺中损失严重。
3.3 含量测定
对赤芍中的芍药苷进行含量测定时,笔者比较了依利特Hypersil ODS2柱(250 mm×4.6 mm,5 μm)和Kromasil C18柱(250 mm×4.6 mm,5 μm),分别采用同一色谱条件进行分离。结果表明,Kromasil C18柱各峰间分离度、对称性好,分离效果为佳。在检测芍药苷成分时,考察了不同流动相对峰形的影响,当流动相用甲醇时,峰严重拖尾,分离度差;采用甲醇-水(45∶55)时,峰形对称,但保留时间过短,分离度不好;用甲醇-水(30∶70)为流动相,分离峰形对称,保留时间适中,分离效果为最佳。
本试验所建立的赤芍等药材的TLC鉴别方法,无干扰,具有专属性;HPLC定量芍药苷的方法简单、准确、专属性强、重复性好,均可用于芍红消积颗粒的质量分析与控制,但在芍药苷含量限度方面有待进一步深入研究。
[1]吴 婷.化瘀消痰法治疗子宫内膜异位症痛经临证研究[J].辽宁中医杂志,2003,30(10):807.
[2]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:附录34.
[3]杨婉花,郝晓静,李 娟,等.双白片质量标准研究[J].中国药房,2010,21(27):2 549.
[4]苗明三,李振国.现代实用中药质量控制技术[M].北京:人民卫生出版社,2000:47.
[5]申桂霞.玉液消渴冲剂中黄芪葛根的薄层鉴别[J].中医药导报,2007,13(7):92.
[6]杨 翰,王海宁,刘丰丰.HPLC法测定舒心宁片中芍药苷的含量[J].中国药房,2007,18(24):1 885.
[7]陈卫军,王新春,袁 勇,等.复方当归红花酊的薄层色谱鉴别[J].时珍国医国药,2004,15(6):343.
[8]张 颖,杨松松,桑育黎,等.红药片定性鉴别方法研究[J].中华中医药学刊,2007,25(5):986.
