猪血液的实验室检测及数据分析技术
2012-08-06刘建营曹长仁谢水华樊福好
刘建营,曹长仁,谢水华,樊福好
(农业部种猪质量监督检验测试中心(广州),广州 430070)
在现代养猪生产中,人们已经越来越不依赖于眼观和仅仅凭借经验来判断猪病了。那种认为“皮肤有出血点就是猪瘟”,“肝脏有坏死白点就是伪狂犬病”,“出现间质性肺炎就是弓形虫”,“出现腹泻不是PED就是TGE”等等观点早已被行业所抛弃。
血液学的检测技术在当前的养猪生产中已经显得越来越重要。为指导养猪生产提供更加科学的依据,为疫苗接种提供更加准确的评价标准,为饲养管理方式的采用和变更提供更加详实的数据,实验室检测结果的判定和数据分析技术越来越受到广大科技工作者和养猪生产者的关注,本文拟对此进行简述,以期抛砖引玉。
1 血液样本的采集
猪的血液采集部位一般选择在耳静脉、颈静脉和前腔静脉进行。耳静脉采血虽然方便,但采血量不足;颈静脉和前腔静脉对采血的技术要求较高,一般难以掌握,但一旦掌握技巧,采血的速度将非常迅速,常在几秒钟内即可完成。
过去采血一般使用注射器直接采集,但采集的血液容易受到污染,容易导致红细胞破裂和出现脂血的问题,大大地影响检测结果。
建议采用血液保护液(blood protesis®)进行采血,具体步骤是:用注射器采集血液保护液约2 mL,然后采集血液约2 mL,轻度混匀。此时采集的血液上清为无色状态而非淡黄色状态,这些血液样本大大利于进行ELISA、PCR和血液生理生化的检测。
在进行血液检测工作之前,首先要确定采集的样本量。按照生物统计学的原理,应该采用分层采样(stratified sampling,又称分类抽样或类型抽样,先将总体样本中全部个体按某种特征分成若干层,再从每一层内随机抽取一定数量的个体组成样本)的方法。即首先确定一个类别群体,比如公猪群、经产母猪群、哺乳仔猪群、保育猪群、生长猪群,等等。
通过抽样确定总体样本的属性,要考虑检测误差、检测结果的估计标准差和置信区间来确定样本量,如在猪瘟抗体检测中,容许误差为5,标准差为15,置信区间取95%,根据N=(1.96*标准差/误差)2,则样本量为35。即:容许误差越小,估计标准差越大,置信区间越大,所需样本量越大。
根据经验,按照现行市面上通用的检测试剂盒的特异性和敏感性以及检测结果的估计标准差计算,每个群体(即采样层)需要采集样本约30份左右为宜。采样时,必须遵循随机抽样(random sampling)的原则。
2 抗体检测及数据分析

在过去的曾经一段时间内,猪血液中的抗体(antibody)检测一直采用间接血凝试验(indirect hemagglutination assay,IHA),但该方法操作繁杂,误差较大,已经被大多数实验室所弃用(如猪瘟抗体的检测);而市面上的免疫金试验由于误差较大,不能量化,结果不可信,推广难度就显得较大。目前大多数实验室采用的检测抗体的方式是酶联免疫吸附试验(enzyme linked immunosorbent assay,简称ELISA),该方法操作规范,结果可靠,数据可通过计算机存储并便于分析。在进行ELISA检测时,要注意的几个事项是:孵育温度要准确、洗板力度要适宜、阴阳性对照均需要分别设立至少2份以上(很多实验室采用一孔进行阴性或阳性对照来节省检测成本的做法是不推荐的),采用保护液采集的血液样本要换算稀释倍数。
1)通过ELISA方法检测获得的抗体结果分为3种:阳性(positive)、阴性(negative)和可疑(suspect)(某些试剂盒未设置可疑结果)。由于这3种结果在本质上是完全不同的,在分析结果时要分类计算(classified counting),不可混合分析。比如:
阳性率=阳性结果数/检测样本总数。
平均值=阳性结果总和/阳性结果样本总数(而非总样本数)。
阴性结果无论数值大小,均应归至某一定值:如在猪瘟的抗体检测中,阻断率大于40为阳性,30~40之间为可疑,30以下为阴性。假定3个样本的检测结果分别为20、20、5,则这3个结果均应归为0,因为20、20和5的意义和0是相同的,他们之间并不存在抗体含量在数值上的差异。即这3个样本的抗体平均值为0,而不是15[原计算方法是:(20+20+5)/5=15]。
2)另外,为了实现不同实验室和不同检测方法之间的比较,建议尽量采用相对抗体法(relative antibody titer)而不是绝对抗体法来标示抗体的高低。表1中笔者采用了相对抗体法和归零法标示了20份样本的猪瘟抗体水平。

表1 猪瘟抗体水平标示
3)相对抗体的采用还具有另外一个优点,就是可以用来评价疫苗的免疫效力。疫苗的免疫效力(immune efficacy index)的计算公式为:
免疫效力=抗体阳性率与相对抗体平均值乘积的平方根
表2是笔者所在实验室计算所得2006-2012年各个年度的猪瘟抗体阳性率,相对抗体平均值以及免疫效力(年检测样本量均在5万份以上,2012年仅取上半年数据)。

表2 2006-2012年的猪瘟抗体阳性率、相对抗体平均值及免疫效力 /%

表3 某商品猪瘟疫苗的临床应用结果及效果评价
经过计算得知(见表3),该疫苗接种猪群后,阳性率为100%,相对抗体的平均值为94.4%,疫苗的免疫效力为97.2%,该疫苗是猪用疫苗市场中比较理想的猪瘟疫苗之一。
3 抗原检测
抗原(antigen)的检测方法与抗体检测有所相似,但目前抗原检测试剂盒大多数存在一定的不足之处,如可重复性差、存在较多的假阳性(false positive rate)或假阴性(false negative rate)结果、样品处理难度高,等等。
不过,用于检测药物残留的试剂盒在质量上已经获得了不小的进展。
通过ELISA的方法甚至可以测试疫苗中的抗原含量,从而评定疫苗效果的优劣。表4是笔者所在的实验室所进行的一项检测。疫苗均来自于疫苗销售的门店。
从表4中可以看出,品牌1的效果明显优于其他几个品牌,品牌5虽然抗原量尚可,但其中的杂质较多,低稀释倍数影响了抗原的检测;而品牌3、品牌6和品牌7则仅仅检测出猪瘟疫苗抗原的可疑结果,未出现阳性结果。
当然,评价活疫苗抗原含量的方式还可以通过定量基因检测来确定。
4 基因检测
很多人把基因检测(gene detection)混同于抗原检测,这是一种理解上的误差。基因检测主要用于活的病原体的检测,即检测病原体的核酸(DNA和RNA)。核酸检测的制约性因素主要是核酸的提取以及纯化,若核酸降解或核酸被多糖以及蛋白质污染,则很容易出现阴性结果。因此,各实验室必须在核酸的纯化上多下功夫,不能单纯依赖试剂盒。

表4 疫苗中的抗原含量检测
核酸检测的基本步骤包括:核酸释放,核酸纯化,核酸扩增。核酸扩增的方法通常采用聚合酶链式反应(简称PCR),根据核酸的性质分为RT-PCR(用于检测RNA)和PCR(用于检测DNA)2种。
由于PCR反应同时具备很高的敏感性,也极易出现假阳性的结果。因此,必须防止提纯的核酸被实验室内其他核酸的污染,尽量采用高度洁净实验室进行核酸的扩增试验。
5 健康评价及数据分析
1)健康评价(health evaluation)是一项针对机体健康状态的量化评价技术,现已在中国各地陆续开展,包括猪、牛、兔子、狗、猫、猴子等。健康评价的原理是通过检测血液中的生理、生化指标,并通过数学模型分析生理、生化指标的相关性,导出机体的健康指数等一系列指标来量化机体的健康状态。健康评价是对抗原、抗体检测以及基因检测的一个良好补充,前者针对机体,后者针对病原体,体现了事物的2个方面。
营养不良:机体营养物质吸收障碍或营养物质供应不足或供应不平衡,均会导致营养不良或营养失调(malnutrition)状态。正常机体的营养不良指数为0,否则,营养不良指数越高,机体的营养不良状态越严重。营养不良的典型临床症状是机体皮肤苍白、毛长、消瘦。
中毒:中毒(toxic)是机体的一种状态,可以通过中毒指数来衡量,正常机体为0。导致中毒的因素包括药物中毒,金属物中毒,霉菌毒素中毒和代谢性中毒。如机体肝脏和肾脏受损时,代谢物不易排出体外,则出现中毒状态。中毒与临床表现不具备相关性,甚至有些中毒的机体可以表现良好的生产性能。另外,机体发生中毒时,建议适当补充维生素B12和叶酸,增强机体的排毒能力。
免疫抑制(immunosuppresion):当机体长期处在中毒状态或受到病毒感染时,则出现免疫抑制。出现免疫抑制的机体对于疫苗接种反应不良。
炎症(inflammation):正常机体的炎症指数为0。炎症的出现与机体的临床表现有一定的相关性。机体长期处于炎症状态时,还会导致血液分布指数下降,影响猪群的生长发育。严重的炎症反应使猪体重不增反降,此所谓“炎多必失”。
血液分布(blood distribution):血液分布与机体的抵抗力传输和营养物质分配具有直接的关系。正常机体的血液分布指数在80~100之间。血液分布指数过低,营养物质分配不足,严重时甚至出现高度发育不良(即僵猪)。血液分布指数过高,则机体的抵抗力传输失衡,往往导致猪只死亡。
健康指数:健康指数(health index)是机体健康状态的综合指标。100以上为健康状态,70以下为病理状态;70~100之间为亚健康状态。
表5中的3头猪均出现营养不良状态,原因是使用了质量低下的豆粕造成,此时出现炎症反应亦当容易理解。
表6中,母猪出现中毒状态,从而导致哺乳仔猪也出现中毒状态;到了断奶后,保育猪出现营养不良状态。所以,饲料的质量事关养猪生产的成败得失。

表5 3头猪的健康评价
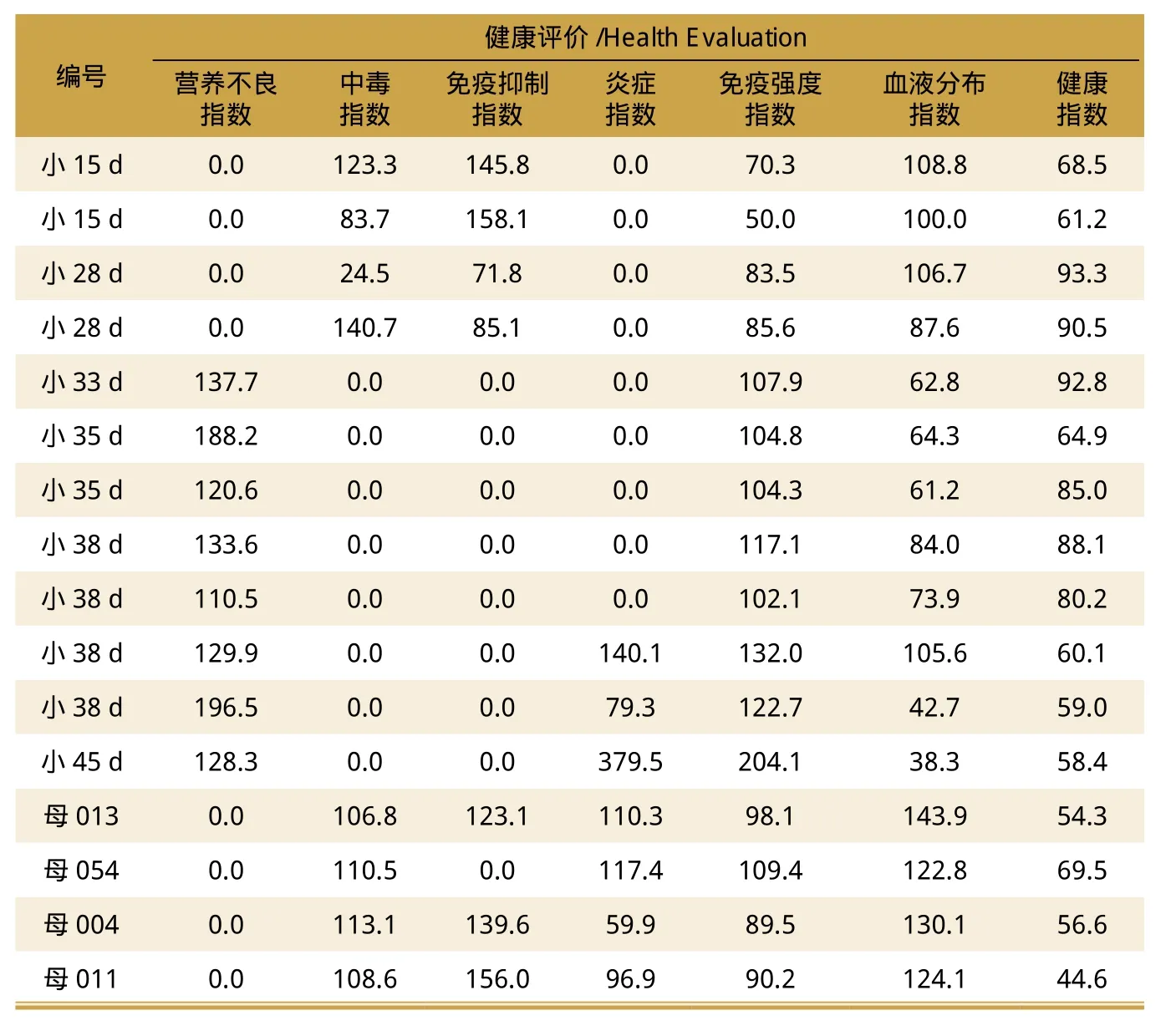
表6 健康评价案例

必须强调的是:怀孕母猪的中毒状态对仔猪的影响很大,会导致仔猪的健康状态不佳。若母猪奶水有毒素排出,则仔猪吮乳后会出现腹泻。若仔猪在怀孕期间肝、肾受到损伤,则这些仔猪出生后会出现生长发育不良状态,呼吸道问题也会接二连三地发生。尤其强调的是,不仅仅是母猪奶水的数量,母猪奶水的质量对仔猪影响更大,这一点必须重视。
2)猪群本身的健康问题主要来源于2个方面:猪采食量不足或过多。采食量不足或采食量过度,机体均会出现一系列的临床问题,如皮肤苍白或皮肤潮红、毛孔出血、眼角下出现“泪斑”。对于发生的营养不良问题,可以通过增加采食量或平衡日粮来解决。采食和饮水功能的恰如其分(即不偏不倚)对于维持猪群的健康至关重要,此所谓“舌尖上的幸福”(happiness from a bite),猪群的“舌尖上的幸福”是饲料营养行业必须给予足够研究和关注的内容,也将成为涉及人类食品安全的重要内容。
在生产过程中,保持采食和排泄的平衡状态,动物可以维持健康状态。
在日常的生产情况下,体内产生的毒素和代谢产物主要通过机体增强血液分布能力,经过尿液或粪便等途径排出;而在病理的情况下,毒素则通过呕吐、腹泻、流产和乳汁等途径排泄。
尿液和粪便对于机体的健康维持有着举足轻重的作用,保持尿液和粪便排泄的畅通对于健康管理的顺利实施有重要的理论意义和实践意义。在营养并不缺乏的环境条件下,尿道和肛门这两个通道对于机体的“幸福生活”的作用非同凡响,此所谓“裆下的幸福”(happiness between legs)。
晋朝学者傅玄在他的一篇名为《口铭》的文中指出:“病从口入,祸从口出。”
何谓“口”,口即机体通向体外的孔窍。包括毛孔、口腔,鼻腔,眼睛,耳朵,尿道和肛门,尤其尿道和肛门在机体毒物排泄中起着重要的作用。尿液通过尿道,粪便通过肛门排泄机体的代谢产物,若此功能受到影响,将最终影响机体的正常生理机能。
所以,若尿液和粪便排泄正常,则机体机能才能维持一种理想的状态,此即“裆下的幸福”。那么,如何才能维持这种 “裆下的幸福”呢?参见①、②、③叙述。
①维持正常的肾脏功能。在当前的养猪生产管理过程中,由于大量使用金属类添加剂和磺胺类等药物,肝脏的功能严重受损,加之环状病毒等病毒的感染,后果更加严重,机体通过尿液排泄毒物的功能大打折扣,甚至完全失去毒物的排泄能力,尿毒症随即发生。
降低饲料中的金属类、磺胺类添加物对于维持肾脏功能有较大的作用。
另外,一些中草药对肾脏功能同样有影响,不能“迷信”中草药的功效。如雷公藤、草乌、益母草、蓖麻子、麻黄、北豆根、巴豆、荆芥、牛膝、芦荟和苍耳子等会引起肾衰。近年报道,茴香桔梗丸、云南白药、葛根素注射液、复方丹参注射液等中成药也可引起急性肾衰。
②维持正常的肝脏功能。肝脏可以通过一系列的生化反应来代谢进入机体的物质,但是,肝脏功能同样会受到霉菌毒素等物质的抑制,若肝脏受到病原体感染,则肝脏的解毒功能同样也会下降。
另外,除了用于完成解毒功能以外,肝脏产生的一系列因子(血浆蛋白、凝血因子)可以用于维持机体的正常血液分布。若血液分布的平衡状态改变,则容易出现胸水、腹水和心包积液等病症,类似于所谓“猪副嗜血杆菌感染”(Glasser’s diseases)的那种状态。即:肝脏功能受损,血浆蛋白合成障碍,血液通透性增加,心包和胸腔积液增加,腹腔积液增加,白细胞渗出增加,自身免疫反应增强,进而发生心包炎、胸膜炎和腹膜炎,即所谓的“包心”、“包肺”和“包肠”。
③维持正常的肺脏功能。肺脏在机体的水分代谢中也起着非常重要的作用。若肺部感染严重,则机体通过肺部散发的水分过多,则肠道干燥,发生便秘,机体毒物蓄积严重。所以,保持肺部的清洁空气流通,防止肺部感染同样非常重要。因此,建造猪舍时,必须充分考虑通风措施的落实,降低饲养密度,实施“适度分散、农牧结合”(agriculture & scattering pig-raising)的饲养管理模式。所以,肺部的正常功能维持也与“裆下的幸福”息息相关。
6 总结
总之,猪血液的实验室检测是一项大的系统工程,不能追求那种一蹴而就的效果。实验室检测的对象包括病因和机体2个方面,二者缺一不可。实验室检测要遵循连续性原则,“平时不烧香,临时抱佛脚”的思想是要不得的,不能等农场(猪场)出了问题才进行检测,此时则为时晚矣。
另外,中国的养猪企业要避免“大而全”的思想,一个存栏1000~2000头左右母猪的农场没有必要建立一个“五脏俱全”的实验室,可以委托相关的科研机构和院校,实现资源共享。而大型或超大型的养猪企业可考虑独立建立实验室或联合建立区域性实验室,方便采样、检测以及便于进行商业性知识产权保护工作。
(略)
