来源于植物的天然二苯甲酮类化合物的研究现状
2012-08-06李赛谋寇俊萍
李赛谋, 戚 进, 寇俊萍*
(1.中国药科大学中药复方研究室,江苏 南京 211198;2.中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 211198)
具有独特生物活性的天然产物是新药创制及先导化合物发现的重要来源[1]。天然二苯甲酮是存在于鸢尾科、藤黄科、樟科、桑科、蔷薇科、瑞香科、桃金娘科等植物中具特殊结构的一类化合物,分布于植物的叶、根、果、茎、花等各个部位中,一般认为其是生物体内合成酮(xanthone)的中间体,由2个苯环通过一个羰基相连而构成含有13个碳原子的骨架母核(1),并连接有羟基、甲氧基、糖基、异戊烯基等主要取代基。该类天然化合物具有抗过敏、抗炎及心血管保护等多种生物活性,已逐渐为国内外学者所关注,相关研究报道也与日俱增。
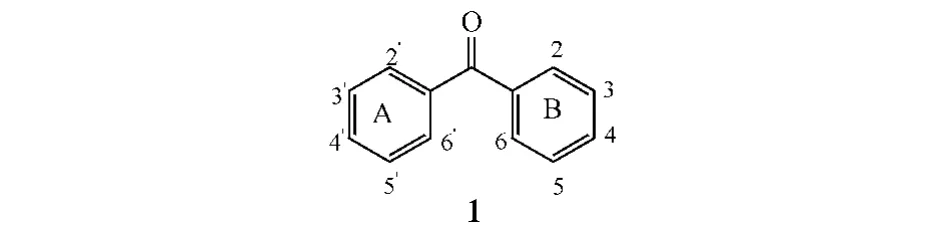
1 来源于植物的天然二苯甲酮类化合物的主要结构及分布特点
天然二苯甲酮在植物中可以多种结构形式存在,其中以苷元、氧苷、碳苷等结构较为常见。
1.1 天然二苯甲酮苷元类
天然二苯甲酮苷元在结构上具有高度相似性(见表1),通常 B环在2、4、6位有取代,呈间苯结构,而A环在2'、5'位少有取代,2'位羟基只是在来源于藤黄属福木的化合物2结构中被发现,5'位羟基也仅出现在来源于金丝桃的化合物4中。但也有些苷元的B环在2、3、4位有取代,而A环均少见取代,如化合物11~14,其中个别化合物在A或B环上有亚甲基连接,如化合物11和14。此外,天然二苯甲酮苷元类化合物上的取代基也较为单一,主要为酚羟基或甲氧基。
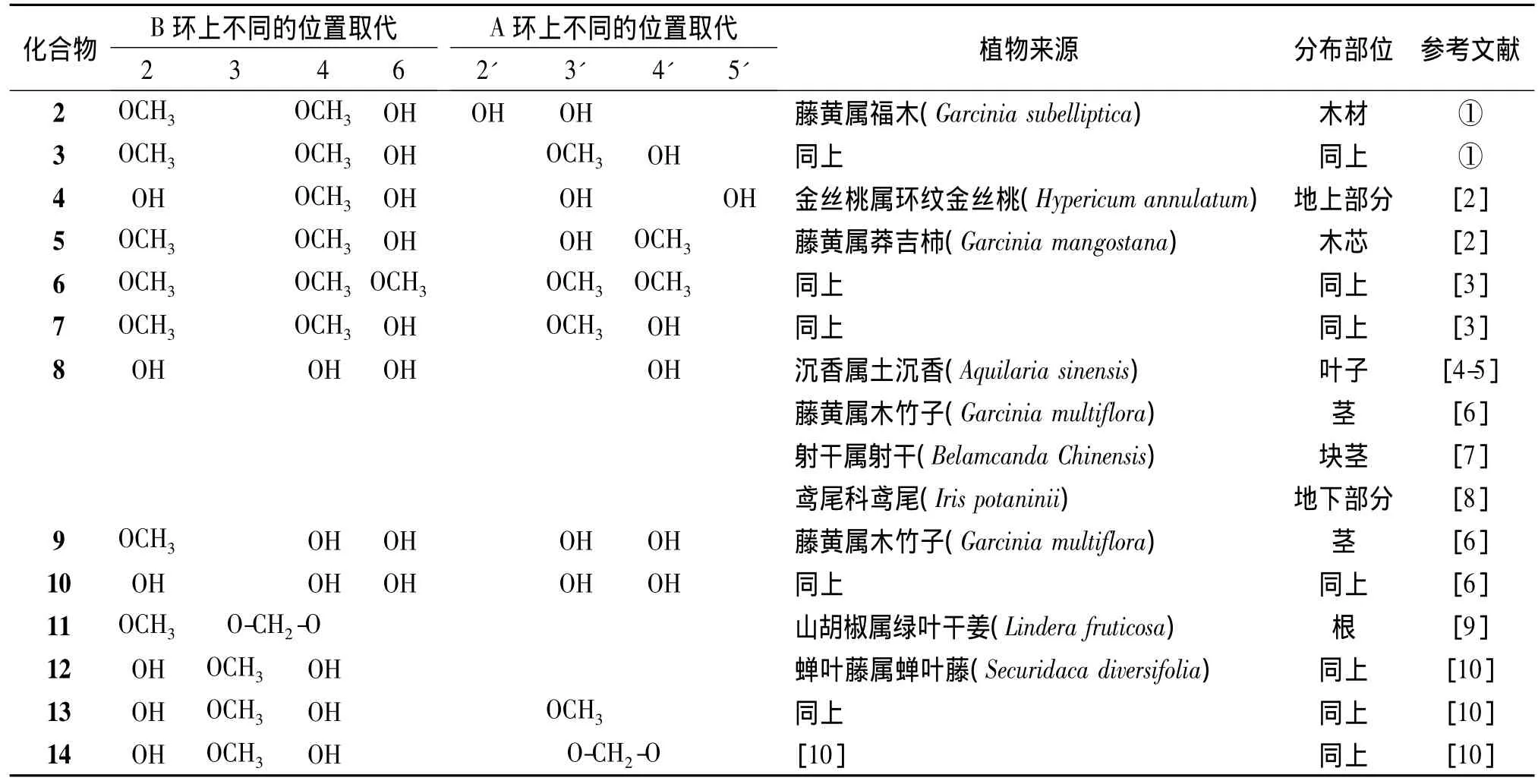
表1 天然二苯甲酮苷元类化合物的常见结构及其在植物中的分布Table 1 Common structures and distributions of natural benzophenone aglycones in plants
由表1可见,天然二苯甲酮苷元主要存在于藤黄属、金丝桃属等植物中,其中鸢尾酚酮(iriflophenone,8)分布较广,主要分布于瑞香科沉香属土沉香的叶子和鸢尾科植物的地下部分。
1.2 天然二苯甲酮氧苷类
目前已发现的天然二苯甲酮氧苷类化合物主要存在于金丝桃属、南香属、番石榴属、沉香属等植物中,且大多来源于植物的叶子或地上部分,其糖基主要有葡萄糖、鼠李糖和木糖,如化合物15~43。其中,具有相同母核结构的化合物15~23分别来源于骨碎补属阔叶骨碎补(Davallia solida)根茎[11]、山榄属山榄(Planchonella obovata)和沉香属土沉香叶子[5,12-13]以及南香属珙桐(Gnidia involucrata)、藤黄属黑柴(Coleogyne ramosissim)和环纹金丝桃地上部分[12,14-16],化合物 24 ~33 分别来源于金丝桃属环纹金丝桃、短柄金丝桃(Hypericum pseudopetiolatum var.kiusianum)和金丝桃(Hypericum thasium)地上部分[17-19],化合物 34 ~36 分别来源于黄牛木属黄牛木(Cratoxylum cochinchinense)和越南黄牛木(Cratoxylum formosum)茎部[20-21],化合物37~39分别来源于番石榴属番石榴(Psidium guajava)叶子、金丝桃属植物(Hypericum thasium)地上部分、藤黄属莽吉柿果实和远志属远志(Polygala tenuifolia)植物皮[19,22-24],化合物 40 ~43 分别来源于番石榴属番石榴果实和叶子[25-26]。此外,该类化合物中二糖苷(如化合物39和20)少见报道,而有些化合物的糖基上羟基被乙酰基化或没食子酰化(如化合物16、18、41~43)。由于二苯甲酮氧苷结构上具有较多酚羟基,故大部分二苯甲酮氧苷的水溶性都较好。

1.3 天然二苯甲酮碳苷类
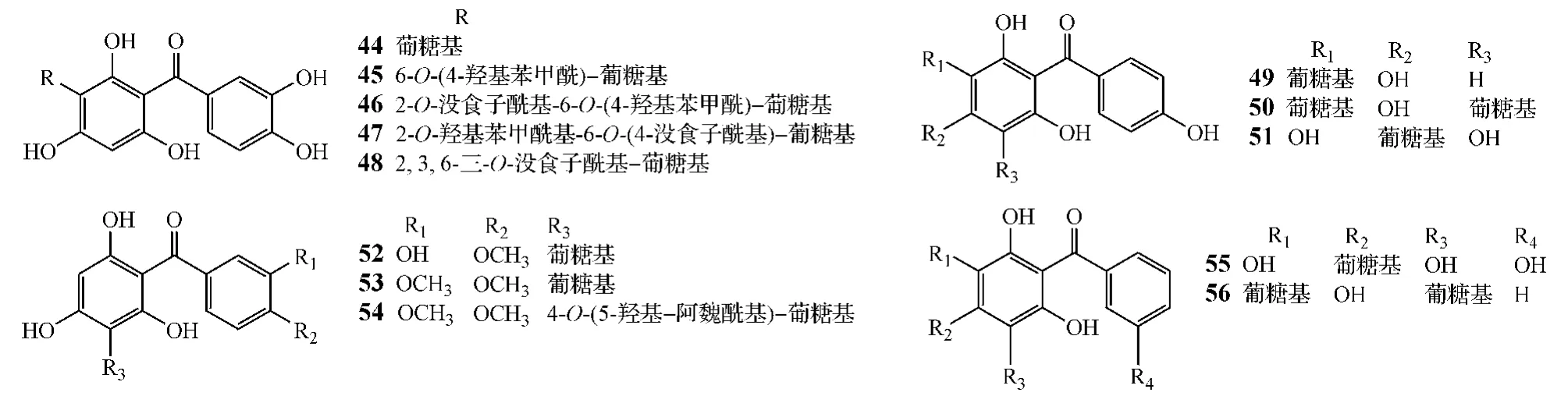
碳苷是一类结构较为特殊的苷类化合物,其糖基是以碳-碳键直接连接在苷元上。天然二苯甲酮碳苷的形成与黄酮碳苷极为相似,即由苷元酚羟基所活化的邻位或对位上的氢与糖的端基羟基脱水缩合而成。故该类化合物的糖基总是连接在具间二酚或间三酚结构的苯环上,但由于天然二苯甲酮的A环上少见间二酚或间三酚,所以二苯甲酮碳苷的糖基常连接在二苯甲酮的B环上。天然二苯甲酮碳苷主要存在于芒果属、沉香属、远志属等植物中,如化合物44~56。其中,具有相同母核结构的化合物44~48分别来源于芒果属芒果(Mangifera indica)叶子(Tanaka 等,Chem Pharm Bull,1984 年),化合物49~51则分别来源于芒果属芒果和沉香属土沉香叶子以及南香属珙桐地上部分[5,13,27-28],化合物52~54来源于远志属小花远志(Polygala telephioides)全草[29-31],化合物55和56分别来源于远志属小花远志根部和远志植物皮[24,30]。目前的研究结果显示,这类化合物上取代的糖基一般只有葡萄糖,少见其他类型糖基取代,而且有些化合物的糖基上羟基被没食子酰基取代(如化合物46~48),但鲜见阿魏酰基及其衍生物取代(如化合物54,其糖基的C-4位被5-羟基阿魏酰基取代)。二苯甲酮类碳苷的理化性质与其他类型的碳苷相似,具有溶解度小、尤其难溶于酸性水溶液等特点。
1.4 其他类
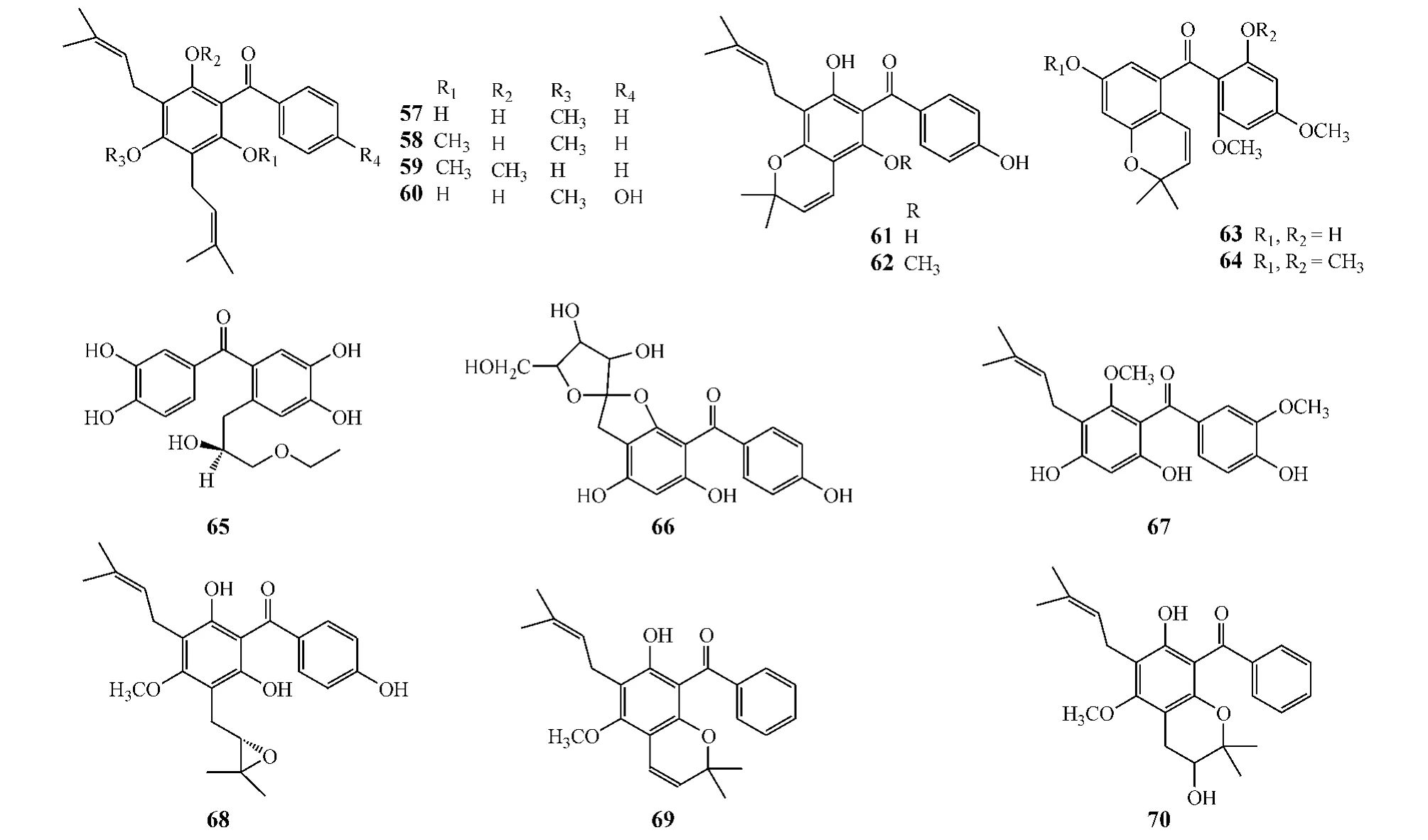
在植物中,天然二苯甲酮还可代谢衍生出其他多种取代的化合物,如化合物57~70。其中,具有相同母核结构的化合物57~60分别来源于藤黄科植物(Garcinia pseudoguttifera、Garcinia myrtifolia 和Vismia cayennensis)皮、木芯和叶(Spino等,Phytochemistry,1995 年;Fuller等,J Nat Prod,1999 年;Alia等,Phytochemistry,2000年),化合物61和62也来源于藤黄科植物(Vismia cayennensis)叶(Fuller等,J Nat Prod,1999年),化合物63和64则来源于藤黄属植物(Garcinia benthami)皮和叶[32],而具有不同或相似结构的化合物65~70分别来源于毛茛属猫爪草(Ranunculus ternatus)根部[33]、沉香属土沉香叶[4]、藤黄属木竹子茎部[6]、藤黄科植物(Vismia cayennensis)叶(Fuller等,J Nat Prod,1999 年)和藤黄属斐济藤黄(Garcinia pseudoguttifera)木芯(Alia等,Phytochemistry,2000年)。这些化合物中以异戊烯基的单取代或多取代较为常见,而异戊烯基的双键活化后还可与酚羟基形成环状结构(如化合物61~64、69、70等),且该类化合物大多还能进一步衍生化而形成更为复杂的结构(如藤黄酸)。此外,天然二苯甲酮还有一些罕见的结构类型,如在沉香属土沉香叶中发现的化合物66,其碳苷糖基上的羟基与酚羟基缩合而形成五元环结构。
2 来源于植物的天然二苯甲酮类化合物的生物活性
2.1 抗过敏及抗炎活性
目前,过敏性鼻炎、哮喘、特发性皮炎、结肠炎、食物过敏、药物过敏等过敏性疾病的发病率在世界范围内呈逐年上升趋势,这已成为各国政府卫生和健康部门高度关注的问题,世界卫生组织也已把过敏性疾病列为21世纪需重点研究和防治的三大疾病之一。笔者所在课题组通过实验考察了化合物19(即 2-O-α-L-鼠李糖-4,6,4'-三羟基二苯甲酮)的抗过敏活性,结果发现:该化合物以20 mg·kg-1剂量灌胃给予雄性ICR小鼠,可明显抑制由抗二硝基苯基化免疫球蛋白E单克隆抗体(anti-DNP IgE MAb)所致的皮肤水肿、瘙痒和自发活动增加,抑制率分别为64.93%、68.91%和91.11%;并对由组胺和P物质诱发的小鼠皮肤过敏反应也有显著抑制作用;而在通过尾静脉注射IgE MAb和在两耳内外侧涂以0.15%2,4-二硝基氟苯(DNFB)丙酮溶液制备雌性BALB/C小鼠过敏模型前给小鼠单剂量灌胃本品20 mg·kg-1,可明显抑制模型小鼠急性相、迟发相和极迟发相过敏反应;此外,给通过腹腔注射二硝基苯酚-猪蛔虫提取物和铝凝胶以及在两耳内外侧涂以0.15%DNFB丙酮溶液建立的雄性BALB/C小鼠慢性皮肤过敏模型连续10 d腹腔注射本品5或20 mg·kg-1,均可明显抑制模型小鼠的二相耳廓肿胀,抑制率明显高于阳性对照药FK506,且无FK506的抑制胸腺指数和升高血清IgE水平的副作用;其中5 mg·kg-1剂量组小鼠的瘙痒次数也显著减少。本课题组的实验研究还发现,该化合物在5~20 mg·kg-1剂量范围内,可剂量依赖性地减少醋酸导致的小鼠扭体反应次数,延长扭体潜伏期。上述研究表明,化合物19具有较好的抗过敏活性[34-35]。
Fu等[22]在实验研究中发现,化合物 37在10 mmol·L-1浓度下可显著抑制大鼠腹膜巨噬细胞中一氧化氮(NO)的分泌,抑制率为38.60%。提示,该化合物有一定的抗炎活性。
2.2 α-葡萄糖苷酶抑制活性
Feng 等[5]用对硝基苯-α-葡萄糖苷(PNPG)作为酶底物,考察了从白木香叶中分离得到的二苯甲酮类化合物8、19、49和50对α-葡萄糖苷酶的抑制活性,结果发现,其 IC50分别为(138.3±7.3)、(143.7±10.6)、(165.1±11.3)和(273.6±14.5)mg·L-1,活性明显高于阳性对照药阿卡波糖(IC50为372.0 ±37.8 mg·L-1)。王涛等[36]也采用类似的试验方法研究了化合物49的生物活性,结果显示,该化合物在400 mol·L-1浓度下作用15 min,对 α-葡萄糖苷酶的抑制率达63.7%;而在大鼠糖耐量试验中,将禁食20~24 h的Wistar雄性大鼠随机分为3组,给药组大鼠经口给予该化合物15 mg·kg-1,正常对照组及未给药组大鼠则给予对照溶剂,0.5 h后,给药组和未给药组大鼠经口给予20%蔗糖溶液(5 mL·kg-1)造模,正常对照组大鼠给予双蒸水,造模0.5 h后,测定各组大鼠血清中葡萄糖含量,结果,正常对照组大鼠血糖值为(756 ±37)mg·L-1,未给药组大鼠血糖值为(1617±71)mg·L-1,表明造模成功,而给药组大鼠血糖值为(1254±58)mg·L-1,较未给药组大鼠显著降低(P<0.01),提示该化合物能有效提高大鼠的糖耐量。另有研究显示,化合物23在100 mg·L-1浓度下对 α-葡萄糖苷酶抑制率可达(91.4±6.3)%[12]。上述研究结果提示,天然二苯甲酮类成分具有防治糖尿病的潜在应用前景。
2.3 心血管保护活性
酰基辅酶A:胆固醇酰基转移酶(acyl-coenzyme A:cholesterol acyltransferase,ACAT)是细胞内唯一的胆固醇酯合成酶(Chang等,Ann Rev Biochem,1996年),在动脉粥样硬化病理过程中发挥重要作用(Accad等,J Clin Invest,2000年)。化合物 11在0.40 mmol·L-1浓度下对ACAT的抑制率达(54.0±0.7)%,表明其具有一定的调节血脂、阻止动脉硬化等心血管保护作用[9]。
2.4 其他活性
有研究表明,化合物49具有抗幽门螺杆菌活性,对胃黏膜溃疡有一定的保护作用[27];化合物60则显示出较强的抗 HIV活性,EC50为11 mg·L-1(Fuller等,J Nat Prod,1999年);而化合物 19具有泻下作用[13]。
3 结语
近年来,随着天然药物研究的迅猛发展,自然界中多种特异性母核结构成分被发现具有独特的药理活性,其中二苯甲酮即是一类具有特殊骨架类型的天然产物,其结构较为简单,取代基及取代位置均有高度相似性,其无论是苷元、氧苷、碳苷或其它结构类型,均以B环的2、4、6位取代居多,占95%以上。此外,目前的研究显示,该类成分在植物中的分布也较为集中,尤在藤黄属、瑞香属、芒果属、金丝桃属等植物中较为多见,且大多存在于植物的叶中,但在常用中药中,除射干和远志外,少有二苯甲酮类成分的报道。
目前有关天然二苯甲酮类化合物生物活性的报道主要集中在其抗过敏、抑制α-糖苷酶以及心血管保护作用等方面,并显示其具有效剂量低、副作用小等优势,而从藤黄属植物分离得到的某些二苯甲酮类衍生物则具有抗HIV和抗真菌活性以及细胞毒性[37],临床应用前景广阔。还有研究表明,经过修饰的天然二苯甲酮具有更为显著的抗炎、抗肿瘤、抗菌等活性。如,基于天然二苯甲酮类化合物藤黄酸而研制的抗肿瘤注射剂已申报用于临床研究。可以相信,随着人们对天然二苯甲酮类化合物的生物活性及其构效关系研究的深入,必将促进新药的发现和开发。
[1]Newman D J,Cragg G M.Natural products as sources of new drugs over the last 25 years[J].J Nat Prod,2007,70(3):261-477.
[2]Kitanov G M,Nedialkov P T.Benzophenone O-glucoside,a biogenic precursor of 1,3,7-trioxygenated xanthones in Hypericum annulatum[J].Phytochemistry,2001,57(8):1237-1243.
[3]Nilar D,Nguyen L H,Venkatraman G,et al.Xanthones and benzophenones from Garcinia griffithii and Garcinia mangostana [J].Phytochemistry,2005,66 (14):1718-1723.
[4]Qi J,Lu J J,Liu J H,et al.Flavonoid and a rare benzophenone glycoside from the leaves of Aquilaria sinensis[J].Chem Pharm Bull,2009,57(2):134-137.
[5]Feng J,Yang X W,Wang R F.Bio-assay guided isolation and identification of α-glucosidase inhibitors from the leaves of Aquilaria sinensis[J].Phytochemistry,2011,72(2/3):242-247.
[6]Chiang Y M ,Kuo Y H,Oota S,et al.Xanthones and benzophenones from the stems of Garcinia multiflora[J]J Nat Prod,2003,66(8):1070-1073.
[7]Orawan M,Wanchai D E,Kaoru U,et al.Phenolic constituents of the rhizomes of the thai medicinal plant Belamcanda chinensis with proliferative activity for two breast cancer cell lines[J].J Nat Prod,2005,68(3):361-364.
[8]Ondognii P,Cserendash,Samdan N,et al.New isoflavones and flavanol from Iris potaninii[J].Chem Pharm Bull,2002,50(10):1367-1369.
[9]Song M C,Nigussie F,Jeong T S,et al.Phenolic compounds from the roots of Lindera fruticosa[J].J Nat Prod,2006,69(5):853-855.
[10]Laura C,Maria N S,Anna R S,et al.Benzophenones from the roots of the popoluca amerindian medicinal plant Securidaca diversifolia(L.)S.F.Blake[J].Phytochem Lett,2010,3(4):226-229.
[11]Rancona S,Chabouda A,Darboura N,et al.Natural and synthetic benzophenone s:interaction with the cytosolic binding domain of P-glycoprotein[J].Phytoche mistry,2001,57(4):553-557.
[12]Lee S S,Tseng C C,Chen C K.Three new benzophenone glucosides from the leaves of Planchonella obovata[J].Helvetica Chimica Acta,2010,93(3):522-529.
[13]Hara H,Ise Y,Morimoto N,et al.Laxative effect of agarwood leaves and its mechanism[J].Biosci Biotechnol Biochem,2008,72(2):335-345.
[14]Ferraria J,Terreauxa C,Sahpaza S,et al.Benzophenone glycosides from Gnidia involucrate[J].Phytochemistry,2000,54(8):883-889.
[15]Ito H,Nishitani E,Konoshima T,et al.Flavonoid and benzophenone glycosides from Coleogyne ramosissima[J].Phytochemistry,2000,54(7):695-700.
[16]Kitanov G M,Nedialkov P T.Benzophenone O-glucoside,a biogenic precursor of 1,3,7-trioxygenated xanthones in Hypericum annulatum[J].Phytochemistry,2001 ,57(8):1237-1243.
[17]Nedialkov P T,Kitanov G M.Two benzophenone O-arabinosides and a chromone from Hypericum annulatum[J].Phytochemistry,2002,59(8):867-871.
[18]Tanaka N,Kubota T,Kashiwada,et al.Petiolins F-I,benzophenone rhamn-osides from Hypericum pseudopetiolatum var.kiusianum[J].Chem Pharm Bull,2009,57(10):1171-1173
[19]Demirkiran O,Mesaik M A,Beynek H,et al.Cellular reactive oxygen species inhibitory constituents of Hypericum thasium Griseb[J].Phytochemistry,2009,70(2):244-249.
[20]Yu HY,Jin S L,Zhang X,et al.Two new benzophenone glucosides from Cratoxylon cochinchinensis[J].Chin Chem Lett,2009,20(4):459-461.
[21]Duan Y H,Dai Y,Wang G H,et al.Xanthone and benzophenone glycosides from the stems of Cratoxylum formosumssp.Pruniflorum[J].Chem Pharm Bull,2011,59(2):231-234.
[22]Fu H Z,Yang J Z,Li C J,et al.A new benzophenone glycoside from the leaves of Psidium guajava L[J].Chin Chem Lett,2011,22(2):178-180.
[23]Huang Y L,Chen C C,Chen Y J,et al.Three xanthones and a benzophenone from Garcinia mangostana[J].J Nat Prod,2001,64(7),903-906.
[24]Jiang Y,Tu P F.Four New phenones from the cortexes of Polygala tenuifolia[J].Chem Pharm Bull,2005,53(9):1164-1166.
[25]Shu J C,Chou G X,Wang Z T.Two new benzophenone glycosides from the fruit of Psidium guajava L[J].Fitoterapia,2010,81(6):532-535.
[26]Matsuzaki K,Ishii R,Kobiyama K,et al.New benzophe-none and quercetin galloyl glycosides from Psidium guajava L[J].J Nat Med,2010,64(3):252-256.
[27]Juliana A S,Zeila P L,Hélio K.Polyphenols with antiulcerogenic action from aqueous decoction of Mango leaves(Mangifera indica L.)[J].Molecules,2009,14(3):1098-1110.
[28]Ferraria J,Terreauxa C,Sahpaza S,et al.Benzophenone glycosides from Gnidia involucrate[J].Phytochemistry,2000,54(8):883-889.
[29]Ma T J,Shi X C ,Jia C X.Telephenone D,A new benzophenone C-glycoside from Poly-gala telephioides[J].Chin J Nat Med,2010,8(1):9-11.
[30]Li J C,Nohara T.Benzophenone C-glucosides from Polygala telephioides[J].Chem Pharm Bull,2000,48(9):1354-1355.
[31]Ma T J,Shi X C,Jia C X.A new benzophenone C-glycoside from Polygala telephioides Willd[J].Chin Chem Lett,2010,21(5):584-586.
[32]Nguyen H D,Trinh B T,Tran Q N,et al.Friedolanostane,friedocycloartane and benzophenone constituents of the bark and leaves of Garcinia benthami.[J]P hytochemistry,2011,72(2/3):290-295.
[33]Y ing X,Ke Z D,Wen Y G,et al.A novel alkenoic acid ester and a new benzo-phenone from Ranunculus ternatus[J].Chin Chem Lett,2007,18(11):1364-1366.
[34]寇 俊萍,余伯阳,戚进,等.2-O-α-L-鼠李糖-4,6,4'-三羟基二苯甲酮的医药用途:中国,200810244795.5[P].2011-01-12.
[35]寇 俊萍,余伯阳,戚进,等.2-O-α-L-鼠李糖-4,6,4'-三羟基二苯甲酮的医药用途:中国,201010143336.5[P].2011-07-20.
[36]王涛,张祎,高秀梅,等.芒果叶中裂环芒果苷及含有裂环芒果苷的芒果叶提取物的新用途:中国,200910070846.1[P].2010-04-14.
[37]R ubio O,Piccinell N,Rastrelliluca L.Chemistry and biologicalactivity ofpolyi-sop renylated benzophenone derivatives[J].Stud Nat Prod Chem,2005,32(12):671-720.
