体外冲击波诱导骨髓间充质干细胞向成骨细胞分化
2012-08-04郑学清于铁成吉林大学第一医院碎石中心吉林长春300
崔 博 郑学清 舒 畅 于铁成 徐 鹏 (吉林大学第一医院碎石中心,吉林 长春 300)
长期以来,体外冲击波(ESW)一直被用于治疗泌尿系统结石,在骨科主要用来治疗骨折不愈合、运动系统慢性劳损性疾病,取得了良好效果,具有创伤小、风险低、费用少、周期短等优点〔1,2〕,但其机制尚不完全清楚。Wang 等〔3〕发现低能冲击波可促使骨髓间充质干细胞(MSCs)细胞膜的电势发生超极化,激活细胞内网状激活系统,诱导转化生长因子(TGF)-β1的产生、最终诱导骨小结形成,提示ESW诱导MSCs向成骨细胞分化可能是其治疗骨折不愈合等疾病的作用机制之一。本实验观察ESW对人骨髓间充质干细胞(hMSCs)增殖活性的影响,为ESW和hMSCs的临床应用提供理论依据。
1 材料与方法
1.1 标本来源和主要试剂 骨髓来源于正常成人献髓者,体外液电冲击波碎石机MODEL KDE-2001,标准胎牛血清(Gibco公司),RNeasy mini column 试剂盒(QIAGEN 公司),RT-PCR 试剂盒、Trizol试剂、DNA Marker(Takara公司),X-光衍射仪(日本电机株式会社)。
1.2 hMSCs培养 以健康自愿者为对象,局麻下用含肝素的注射器从髂后上棘抽取5~10 ml骨髓。将骨髓标本移入离心管中,加入等体积的无血清的 L-DMEM,1000 r/min,5 min,洗涤多余的脂肪细胞。将Percoll液和 PBS配制成密度为1.073 g/cm3的细胞分离液;15 ml离心管内加入与血清等体积的分离液后,将收集的骨髓缓慢加在分离液上部,2500 r/min离心30 min,用吸管吸取单个核细胞层,分散在含10%胎牛血清的L-DMEM培养液中,接种于塑料6孔培养板,在37℃含5%CO2的饱和湿度空气中培养;接种72 h换液,以后每3~4 d换液,7~10 d首次传代;当细胞长满培养孔80%左右时,用0.25%胰蛋白酶将细胞消化,接种于培养瓶内,每3~4 d换液1次,7~10 d传代。培养至第4代。受试对象的分组及干预:原代 hMSCs长满至80%时,加入0.25%胰蛋白酶-0.01%EDTA消化制成细胞悬液,即P1代;调整细胞密度,然后各取5 ml细胞悬液,等量接种于25 cm2细胞培养瓶中,分别标记为对照组(C)和干预组(E)。干预组hMSCs使用ESWO-AJ治疗仪施加最佳能流密度0.16 mJ/mm2,即5 kV、100频次的体外冲击波干预,置入体外液电冲击波碎石机中,调整焦点,通过C型臂X光透视装置,使细胞悬液中点刚好位于焦点处并固定。对照组样本不施加干预。两组受试对象均置于37℃、5%CO2及饱和湿度条件的孵育箱培养。
1.3 碱性磷酸酶(ALP)活性测定 取冲击波干预组和对照组细胞,调整细胞悬液浓度至110 ×105~115 ×105/ml,加入Triton-X100,4℃过夜,将细胞裂解液按每孔50 μl加入96孔培养板,干预组和对照组各10孔,每组设0.1 mg/ml标准阳性对照和双蒸水空白对照各1孔(50 μl/孔)。按试剂盒操作说明依次加入缓冲液、基质液各0.5 ml,充分混匀,37℃水浴15 min,再加显色剂各0.5 ml,用酶标仪在520 nm波长处检测其光吸收值(A),计算ALP含量。以同样的方法测定第2~9代干预组和对照组细胞内ALP含量。
1.4 X-光衍射分析 分析干预组和对照组细胞矿物质沉积情况,hMSCs在前述的条件下培养16 d,用PBS洗2遍,从培养瓶表面刮下细胞及细胞基质,离心1500 r/min 5 min,10%中性甲醛固定,干燥。X-光衍射仪(D-Max/3c)检测干细胞和基质粉末,测定的图像用粉末衍射卡片(Powder Diffraction File)JCPD9-432对照鉴定。
2 结果
2.1 hMSCs培养后的形态特点 原代细胞培养10 d后进行传代,对照组与干预组共传代16代,每4天传代1次。细胞接种于培养板后,第2天可见细胞贴壁,细胞形态多样,分布不均,部分呈巢式生长。同时可见悬浮的造血细胞。随换液次数增多,悬浮细胞逐渐减少,直至消失。18 d左右出现贴壁层,贴壁细胞呈长梭形,突起不明显,呈鱼群状密集排列。
2.2 冲击波作用后hMSCs的变化 冲击波作用后,干预组第1代即可见细胞集落形成,每孔8~15个不等,排列密集;对照组集落形成较少,每孔2~3个。持续培养20 d后,干预组可见钙结节形成,并逐渐增多,而对照组未见钙结节形成。见图1。
2.3 细胞内ALP形成情况 以出现棕黑色沉淀为阳性。染色后可见,干预组细胞均为阳性,对照组细胞为弱阳性。见图2。

图1 MSCs成骨诱导分化后的形态变化(×100)
2.4 MSCs经成骨诱导后细胞外基质的矿化 培养的MSCs在体外冲击波的作用下,有大量的矿物沉积形成。X-光衍射测定,在细胞基质中形成的矿物质在30°~35°之间形成的波峰与羟基磷灰石的参考标准(JCPDS9-432)一致,证明细胞基质中的矿物质沉积为羟基磷灰石。
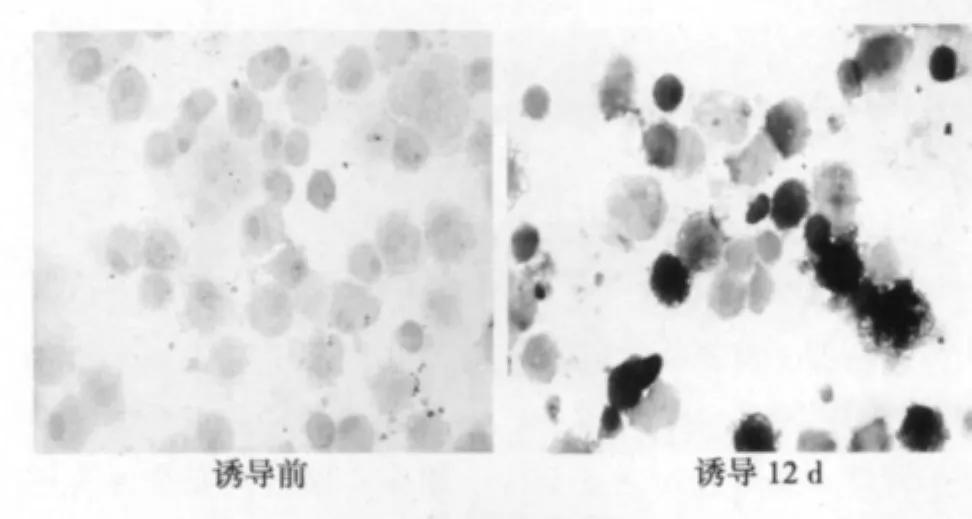
图2 MSC向成骨细胞分化期间ALP染色变化
3 讨论
种子细胞选择及其规模化扩增一直是组织工程面临的重要课题。BMSCs是目前备受关注的一类具有多向分化潜能的组织干细胞,在体内外适当的诱导环境下可以分化为骨、软骨、脂肪、肌肉、神经、肌腱、韧带等多种组织细胞。该细胞群来源充足,取材方便,增殖能力强,可在体外大规模扩增而不丢失多向分化潜能,并且异体移植免疫排斥反应小。对BMSCs研究的不断深入为解决组织工程细胞来源难题带来了前所未有的希望〔4〕。近年来,国内外科研人员针对有关BMSCs的分离、纯化、体外扩增和分化潜能等,进行了广泛而深入的研究〔5〕。
目前用于体外诱导MSCs向成骨细胞分化的诱导剂多数是由地塞米松联合β-甘油磷酸钠及维生素C组成的化学诱导剂〔6〕,而应用物理方法诱导MSCs成骨的研究少见。冲击波作为一种机械物理刺激,利用液电能量转换及传递原理,造成不同密度组织之间产生能量梯度差及扭拉力,达到治疗目的。它用于治疗泌尿系统结石已成为十分成熟的技术。而将其作用于骨组织,并治疗骨科系统疾病,是近年来的新进展〔7,8〕。从实用性方面看,ESWT作为新的非入侵性骨科治疗方法,相对于传统外科治疗有许多优势,与传统治疗方法比较效果更佳,已受到人们广泛的接受和认同。研究表明ESWT治疗骨不连、骨折延迟愈合及成人股骨头缺血性坏死等具有非入侵性、组织损伤小、疗效满意、不会导致基因突变及染色体畸变等优点,是一种安全、简便、有效的治疗手段。国内外骨科学者对冲击波治疗骨折不愈合的作用机制进行了大量研究。
ESW干预MSCs成骨作用存在剂量效应依赖关系。Martini〔9〕研究不同剂量冲击波对羊初级骨母细胞的作用效应,结果发现在冲击波作用近期内,能量小于0.31 mJ/mm2时对骨细胞的生长有明显的促进作用,大于此值时可引起骨细胞的损伤,认为ESW存在剂量效应关系,影响ESW效果的主要因素是能量密度,而与冲击波作用次数无关。Kusnierczak〔10〕研究显示,冲击波作用后骨细胞的生存率依脉冲数和强度而降低(即剂量依赖生存);当冲击次数达到 2000,且能量密度达到0.51 mJ/mm2时,细胞生存率明显降低;但在冲击波作用后的第3~8天,中或高能量率2000次脉冲冲击波作用后的培养细胞发生明显增殖,以至于细胞的数量明显多于低剂量组。这说明,对于骨细胞来说,中、高剂量的刺激在远期效应上可促进细胞增殖。另外,Takahashi〔11〕发现冲击波作用可促使成骨细胞表达细胞外基质蛋白的相关基因,而这种蛋白是促进成骨的重要物质。
1 Qin L,Wang L,Wong MW,Osteogenesis induced by extracorporeal shockwave in treatment of delayed osteotendinous junction healing〔J〕.J Orthop Res,2010;28(1):70-6.
2 徐 鹏,陈小英,王伟琪.体外冲击波治疗老年性肩周炎和跟痛症〔J〕. 中国老年学杂志,2008;28(16):1625-7.
3 Wang CJ,Wang FS,Yang KD,et al.Shock wave therapy induces neovascularization at the tendon-bone junction.A study in rabbits〔J〕.J Orthop Res,2003;21(6):984-9.
4 Bodo M,Baroni T,Bellucci C,et al.Unique human CD133+leukemia cell line and its modulation towards a mesenchymal phenotype by FGF2and TGFbeta1〔J〕.J Cell Physiol,2006;206(3):682-92.
5 Kogler G,Radke TF,Lefort A,et al.Cytokine production and hematopoiesis supporting activity of cord blood-derived unrestricted somatic stem cells〔J〕.Exp Hematol,2005;33(5):573-83.
6 Kaji H,Canaff L,Hendy GN.Role of menin in bone development〔J〕.Adv Exp Med Biol,2009;668:59-67.
7 邢更彦,白晓东,杜明奎,等.体外冲击波治疗成人股骨头缺血性坏死的疗效观察〔J〕.中华物理医学与康复杂志,2003;25:472-4.
8 Tamma R,dell′Endice S,Notarnicola A,Extracorporeal shock waves stimulate osteoblast activities〔J〕.Ultrasound Med Biol,2009;35(12):2093-100.
9 Martini L,Giavaresi G,Fini M,et al.Effect of extracorporeal shock wave therapy on osteoblastlike cells〔J〕.Clin Orthop,2003;(413):269-80.
10 Kusnierczak D,Brocai DRC,Vettel U,et al.The influence of extracorporeal shock-wave application(ESWA)on the biological behaviour of bone cells in vitro〔M〕.Berlin:Congress of the International society for Musculoskeletal Shockwave Therapy,2001:15-70.
11 Takahashi K,Yamazaki M,Saisu T,et al.Gene expression for extracellular matrix proteins in shockwave-induced osteogenesis in rats〔J〕.Calcif Tissue Int,2004;74(2):187-93.
