α7尼古丁受体mRNA表达抑制对SH-SY5Y细胞氧化应激水平的影响
2012-08-02欧阳凯齐晓岚官志忠贵阳医学院分子生物学重点实验室贵州贵阳550004
欧阳凯 齐晓岚 官志忠 (贵阳医学院分子生物学重点实验室,贵州 贵阳 550004)
在阿尔茨海默病(AD)患者大脑皮层脑组织中神经型尼古丁受体的表达水平降低,胆碱能神经的功能缺陷在AD发病机制中具有重要的作用。氧化应激是指自由基产生过多或抗氧化物质水平减少而使两者之间的平衡失调所造成的损伤,在多种中枢神经系统疾病的发生过程中起着重要作用。大量研究表明,AD是由多种因素共同作用引起的,自由基诱导的细胞损伤是AD的主要发病机制之一〔1〕。RNA干扰 (RNAi)是通过具有一定结构特点的,长约19~25 bp的小干扰 RNA(siRNA),导人哺乳动物细胞后,能高效、特异的阻断体内特定基因的表达,诱使细胞表现出特定基因缺失的表型的过程〔2〕。本研究用体外合成的 siRNA抑制SH-SY5Y细胞 α7 nAChR的表达,研究其受抑制后对细胞氧化应激水平的影响,从而探讨α7 nAChR对AD的神经保护作用。
1 材料与方法
1.1 材料 源于人脑的 SH-SY5Y细胞由本课题组保存;DMEM培养基、胎牛血清、0.25%胰酶购于HyClone公司;鼠抗α7多克隆抗体及辣根过氧化物酶(HRP)标记的抗鼠抗兔二抗、α7 nAChR siRNA、siRNA荧光质控、siRNA 转染试剂、siRNA转染培养基均购于Santa Cruz公司;Oligo dT、dNTP购于上海生工公司;Trizol试剂购于Invitrogen公司;M-MLV逆转录酶购于Promega公司;RNA酶抑制剂购于Toyobo公司;TaqMan Universal 2 ×PCR Mix、α7 nAChR 和内对照 β-actin Taq-man 探针均购于 Applied Biosystems公司;鼠抗 β-肌动蛋白(β-actin)、Aβ1~42购于Sigma公司;聚乙烯二氟 (PVDF)膜、ECL-Plus发光试剂、高效显影胶片购于Amersham公司;显影液、定影液购于柯达公司;脂质过氧化产物、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒购于南京建成公司;细胞裂解液购于碧云天公司;普通化学试剂均购于Sigma公司。
1.2 方法
1.2.1 细胞培养 SH-SY5Y细胞常规培养,培养基为DMEM,加入15%胎牛血清、1%双抗(青霉素 100 U/ml,链霉素100 U/ml)。培养箱中含5%CO2,温度为37℃。
1.2.2 siRNA的转染 生长良好的细胞用0.25%胰蛋白酶消化传入六孔细胞培养板中,待其汇合度达80%时按siRNA转染说明书按不同比例进行转染siRNA荧光质控,根据荧光值摸索和优化siRNA的转染条件。分别转染阴性对照 siRNA、α7 nAChR siRNA,转染后6 h换正常培养基继续培养48 h后收集培养基和细胞,设空白对照,每一转染设3复孔,重复3次。
1.2.3 α7 nAChR沉默效率检测 采用 Trizol一步法提取细胞总RNA。将mRNA逆转录反应成cDNA。以逆转录产物为模板进行 Real-time PCR。所用试剂为 TaqMan Universal 2×PCR Mix,α7 nAChR(Hs01063372_m1) 和 内 对 照 β-actin(Hs01060665_g1)Taqman探针购自Applied Biosystems公司,ABI Step One plus型荧光定量PCR仪采集待测基因及内参照β-actin扩增各循环荧光信号,以Applied Biosystems SDS1.4软件进行荧光采集和数据分析。SDS1.4软件分析其△△Ct值及RQ 值,RQ=2-△△Ct。分析实验结果时以 β-actin为内对照,计算α7 nAChR mRNA和对照组的相对水平。
收集细胞,提取细胞蛋白并定量,用 Western印迹方法检测α7 nAChR的蛋白表达水平。以 β-actin作为内对照。以Labworks软件分析结果时以β-actin蛋白条带作为内参照,计算α7 nAChR蛋白条带与 β-actin蛋白条带像素灰度的百分比值。
1.2.4 细胞分组及Aβ1~42处理 细胞转染48 h后换无血清无双抗的DMEM培养基1 ml 12 h,加入Aβ1~42使其终浓度为1 μmol/L,按以下分组:空白对照组、阴性对照组、转染 α7 nAChR siRNA 组、空白对照 +Aβ1~42组、阴性对照 +Aβ1~42组、转染 α7 nAChR siRNA+Aβ1~42组。
1.2.5 脂质过氧化水平测定 收集培养基,按测试盒说明书操作。采用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量,氧自由基能攻击生物膜中的多不饱和脂肪酸引发脂质过氧化作用,并因此产生MDA,MDA可与TBA缩合,形成红色产物,在532 nm处有最大吸收峰。
1.2.6 SOD和GSH-PX活性测定 收集细胞,超声裂解提取蛋白并定量,按测试盒说明书操作。SOD活性采用黄嘌呤氧化酶法测定,GSH-PX活性采用比色定量法。
2 结果
2.1 转染α7 nAChR siRNA后 α7 nAChR mRNA水平和蛋白表达水平 转染针对α7 nAChR基因的siRNA后SH-SY5Y细胞α7 nAChR mRNA水平和蛋白表达水平分别下降了81.7%和76.9%(表1),转染阴性对照与对照组相比无差异。说明已将 α7 nAChR siRNA转入人 SH-SY5Y细胞,且抑制了 α7 nAChR mRNA和蛋白水平的表达,瞬时转染α7 nAChR基因沉默细胞构建成功。
2.2 脂质过氧化水平 转染针对α7 nAChR基因的siRNA及用1 μmol/L Aβ1~42处理 SH-SY5Y 细胞均能使细胞脂质过氧化水平升高,且α7 nAChR基因沉默后能增强Aβ神经毒性作用。见表2。
2.3 SOD活性和GSH-PX活性 转染针对α7 nAChR基因的siRNA 及用 1 μmol/L Aβ1-42处理 SH-SY5Y 细胞均能使细胞SOD活性和GSH-PX活性降低,且α7 nAChR基因沉默后能增强Aβ的神经毒性作用。见表2。
表1 转染α7 nAChR siRNA后α7 nAChR mRNA及蛋白表达水平(±s,n=3)
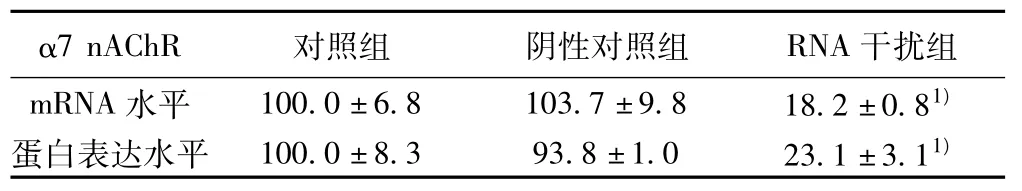
表1 转染α7 nAChR siRNA后α7 nAChR mRNA及蛋白表达水平(±s,n=3)
与对照组比较:1)P<0.01
?
表2 转染α7 nAChR siRNA后细胞MDA水平及SOD,GSH-PX活性(±s,n=3)
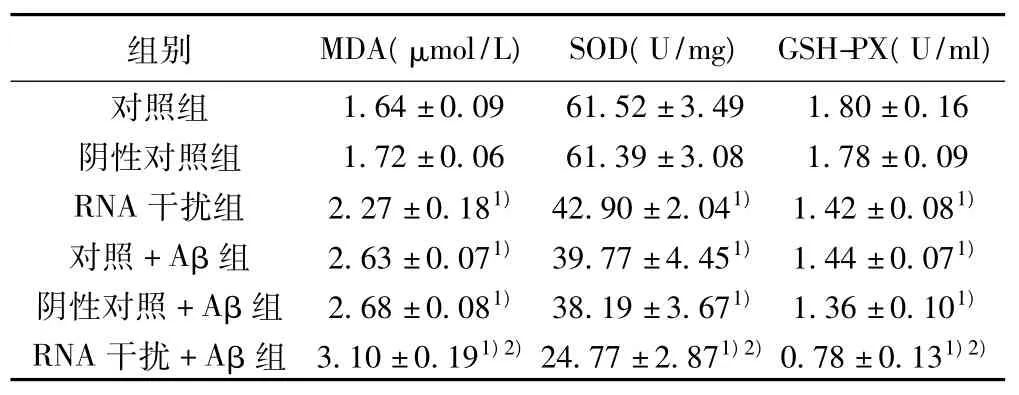
表2 转染α7 nAChR siRNA后细胞MDA水平及SOD,GSH-PX活性(±s,n=3)
与对照组比较:1)P<0.01,与对照+Aβ组比较:2)P<0.01
?
3 讨论
RNA干扰(RNAi)能特异性抑制基因表达,是一种转录后基因沉默机制(PTGS)。RNAi通过小的dsRNA高效、特异的阻断体内特定基因的表达,促使其mRNA特异性降解,诱使细胞表现出特定基因缺失的表型的过程,具有高特异性、高稳定性、高效率性、高穿透性等特性〔2〕。目前RNAi技术已广泛用于功能基因组学、基因治疗学、新的药物开发等众多领域。
尼古丁乙酰胆碱受体是一类明确的具有神经保护功能的受体,其减少与AD的发生有关。AD患者脑中胆碱能系统严重受损,脑组织中多个区域中尼古丁受体水平降低,AD患者大脑尼古丁受体密度降低。在活体组织和尸检组织中也发现尼古丁受体水平的下降。在 APPSWE大鼠标本中可见 α7 nAChR的选择性升高,提示α7 nAChR的升高是对Aβ毒性作用的一种保护机制。但α7 nAChR保护作用的机制并不清楚,因此本研究用体外合成的 siRNA抑制 SH-SY5Y细胞 α7 nAChR的表达,并研究其表达受抑制后细胞脂质过氧化产物、SOD和GSH-PX活性的变化,以进一步研究 α7 nAChR神经保护作用机制。
AD的主要病理变化有SPs、NFT及神经元死亡等。氧化应激与AD的这三个主要病理变化都相关〔3〕。氧化应激在多种中枢神经系统疾病的发生过程中起着重要作用。在自由基产生过多或抗氧化平衡被破坏时可通过攻击细胞膜性脂质、蛋白质及DNA而造成细胞损伤。大脑细胞由于其细胞膜含有大量的对自由基的攻击较敏感的多不饱和脂肪酸,因而容易受到自由基的损伤,产生大量的脂质过氧化产物。已发现AD病人脑组织中神经元胞浆、胞核及神经胶质细胞中蛋白氧化产物-蛋白羰基水平升高〔4〕。另外,在AD病人的尸检报告中指出:在NFT形成部位存在蛋白羰基和脂质过氧化物水平升高〔5〕。在Aβ过度表达的转基因动物中发现了与AD病人类同的氧化损伤表现,并且损伤程度与Aβ的沉积呈明显正相关〔6〕。在对临床AD病人的诊断研究中也发现,AD病人脑脊液中氧化应激标志物,如8-羟基-2-脱氧鸟苷酸等含量均升高〔7〕。有研究表明,氧化应激是AD发生的早期表现,是发生于SPs和NFT的上游病理事件〔8〕,与其他AD发生的可能机制相比,氧化应激在AD的发病机制中可能更为重要。
SOD可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,复原因自由基造成的对细胞的伤害。GSH-PX是机体内广泛存在的一种重要的催化H2O2分解的酶,它特异地催化GSH对H2O2的还原反应,从而保护细胞膜结构和功能不受过氧化物的干扰及损害。测定这些指标可反映机体内源性抗氧化能力。本研究表明siRNA有效地抑制了α7 nAChR的表达,转染后细胞脂质过氧化产物 (MDA)水平升高、SOD和GSH-PX活性降低明显,氧化应激增强。用Aβ1~42处理细胞后发现氧化应激水平升高,说明Aβ可通过诱导氧化应激引起细胞损伤;且转染针对α7 nAChR基因的siRNA后能够增强Aβ的神经毒性作用。说明α7 nAChR能对抗细胞氧化应激从而发挥神经保护作用。
1 Qi XL,Xiu J,Shan KR,et al.Oxidative stress induced by beta-amyloid peptide is involved in the altered composition of cellular membrane lipids and the decreased expression of nicotinic receptors in human SH-SY5Y neuroblastoma cells〔J〕.Neurochem Int,2005;46(8):613-21.
2 Aigner A.Gene silencing through RNA interference(RNAi)in vivo:Strategies based on the direct application of siRNAs〔J〕.J Biotechno,2006;124(1):12-25.
3 Resende R,Moreira PI,Proenca T,et al.Brain oxidative stress in a triple transgemic mouse model of Alzheimer′s disease〔J〕.Free Radic Biol Med,2008;44(12):2051-7.
4 Moreira PI,Santos MS,Oliveira CR,et al.Alzheimer disease and the role of free radicals in the pathogenesis of the disease〔J〕.CNS Neurol Disord Drug Targets,2008;7(1):3-10.
5 Polidori MC.Oxidative stress and risk factors for Alzheimer′s disease:clues to prevention and therapy〔J〕.J Alzheimer Dis,2004;6(2):185-91.
6 Mao P,Reddy PH.Aging and amyloid beta-induced oxidative DNA damage and mitochondrial dysfunction in Alzheimer′s disease:implications for early intervention and therapeutics〔J〕.Biochim Biophys Acta,2011;1812(11):1359-70.
7 Ghidoni R,Benussi L,Paterlini A,et al.Cerebrospinal fluid biomarkers for Alzheimer′s disease:the present and the future〔J〕.Neurodegener Dis,2011;8(6):413-20.
8 Maruszak A,Zekanowski C.Mitochondrial dysfunction and Alzheimer′s disease〔J〕.Prog Neuropsychopharmacol Biol Psychiatry,2011;35(2):320-30.
