胃癌外科治疗术后影响预后因素COX分析
2012-08-02邵新宏新疆医科大学第五附属医院普通外科新疆乌鲁木齐830000
邵新宏 韩 渊 (新疆医科大学第五附属医院普通外科,新疆 乌鲁木齐 830000)
胃癌是我国常见的消化道肿瘤,其发病率有上升的趋势,且死亡率位居全部恶性肿瘤前列。本文拟探讨影响胃癌患者术后生存预后的因素,为胃癌预后的判断、临床治疗决策的选择及肿瘤生物学特征的了解提供依据。
1 资料与方法
1.1 一般资料 2001~2009年我院治疗的165例资料完整的胃癌外科手术患者,平均年龄52.6岁。转移情况:肝转移15例,侵犯周围脏器56例,腹腔广泛转移8例。一般临床特征见表1。
1.2 随访和统计方法 随访至手术后第10年。随访率为86.7%。
1.3 统计学方法 应用统计学软件SPSS17.0进行统计学分析处理。生存率采用寿命表法计算;生存率的比较采用Logrank检验法。通过单因素分析,将有统计学意义的变量,应用向前逐步选择自变量的方法引入COX比例风险模型进行多因素分析。
2 结果
2.1 生存率 1年生存率为81.4%,5年生存率为48.3%。平均生存(34.8±2.1)个月。随访期间死亡89例(53.9%)。
2.2 单因素分析结果 影响预后的指标有围术期输血、肿瘤的部位、肿瘤浸润深度、组织学类型、腹膜转移、TNM分期(表1)、淋巴结转移及淋巴结廓清术式均为影响预后的因素。输血量越大,预后越差;一旦发生淋巴结转移,1年生存率由70.7%降42.3%,5年生存率由52.4%降至30.7%。
2.3 多因素分析结果 通过单因素分析,将围术期输血、肿瘤的部位、肿瘤浸润深度、组织学类型、腹膜转移、TNM分期、淋巴结转移及淋巴结廓清术式等影响预后的因素应用向前逐步选择自变量的方法引入COX比例风险模型进行多因素分析,肿瘤浸润深度、组织学类型、腹膜种植、TNM分期、淋巴结转移及淋巴结廓清术式是影响患者术后生存的独立因素(表1)。
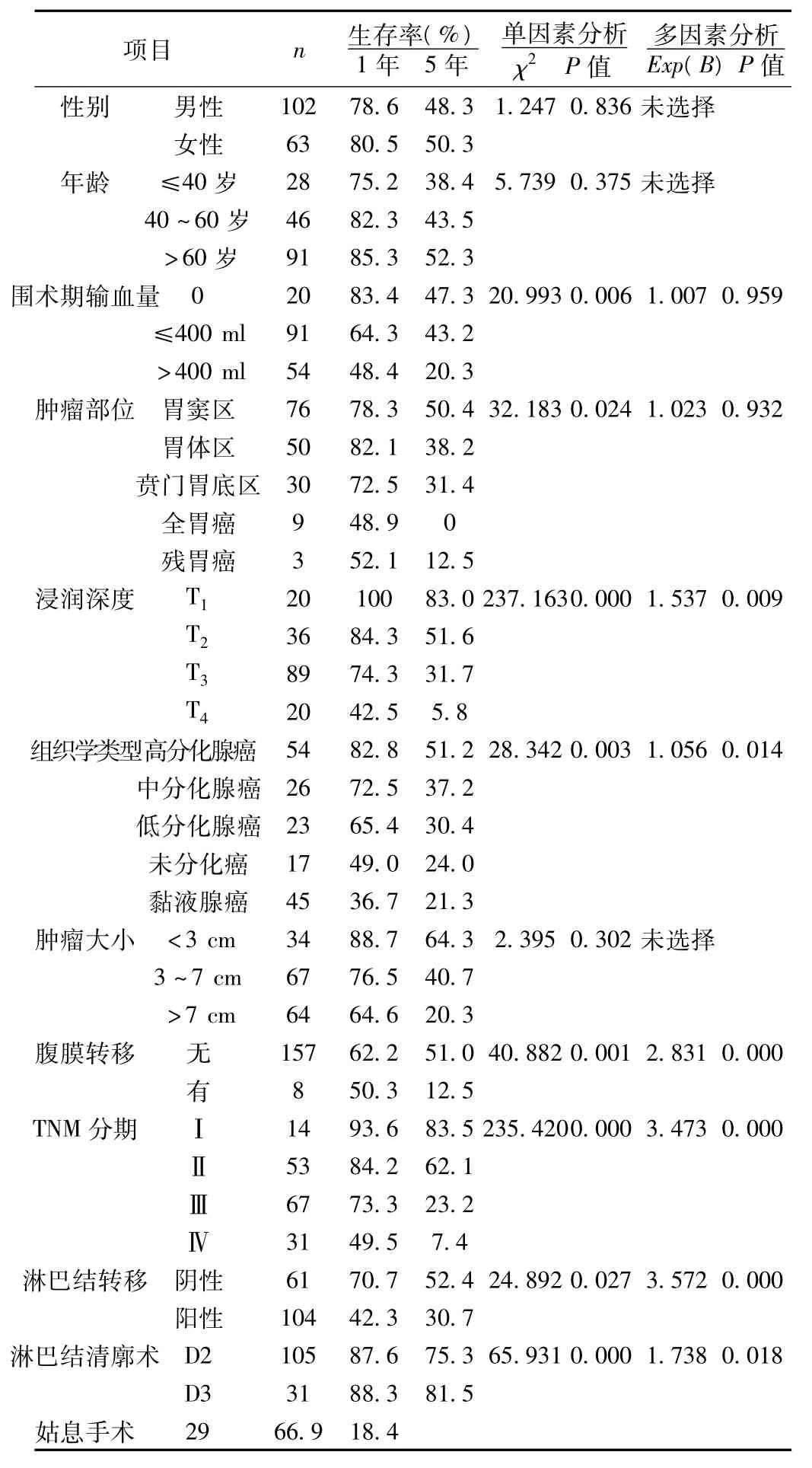
表1 165例胃癌患者的临床资料及预后的因素
3 讨论
目前已公认胃癌生物特性、TNM分期、浸润深度、淋巴结转移情况等因素与预后密切相关,而如性别、年龄、肿瘤部位、肿瘤大小等因素预后的关系仍有分歧〔1〕。
本组研究资料单因素分析显示性别与年龄对胃癌的预后没有影响。多因素分析提示年龄是保护因素(偏回归系数=-0.032),年龄越小,预后越差。本研究显示的年龄与预后关系与许多研究结果并不一致,多数研究表明60岁以上的胃癌患者预后较好,本组分析病人40岁以下发病者有28例,而40岁以上占可见40岁以上是胃癌好发的高峰,此结果与Wang〔2〕和 Pourhoseingholi等〔3〕的报道基本相符。陈光群等〔4〕586 例胃癌的临床分析结果显示男女之比为2.96∶1,男性总体发病率明显高于女性,中老年组尤其显著(3.68∶1),以上参考文献数据均与本组分析结果相符。大多数文献报道输血量越大,预后越差,与本组研究结果一致〔5〕。输血会降低围术期患者的免疫力,而且一般输血越多,意味着手术难度可能越大。输血多的患者的身体一般状态多数也较差,肿瘤容易复发转移。
本组单因素分析显示肿瘤直径对胃癌的预后没有影响,而肿瘤部位及浸润深度,病理类型与生存率本组单因素分析胃窦区胃癌5年生存率要明显高于全胃癌,文献报道肿瘤位置可以是胃癌的独立预后因素,Huang等〔6〕和 Msika等〔7〕等研究将胃底、贲门部的肿瘤归为近端胃癌,胃体部的归为中段胃癌,胃窦、幽门部归为远端胃癌,发现远端胃癌预后较近端胃癌好。本研究单因素分析结果显示,胃窦幽门部的生存率最高,其次为胃体部,贲门胃底部肿瘤生存率较前两者明显下降,多部位病灶者预后最差,提示不同部位肿瘤与生存之间有统计学差异,而多因素分析结果则提示肿瘤的部位在胃癌的预后因素没有统计学意义,原因可能与近端胃癌的TNM分期较晚,肿瘤侵犯深度有关。本组研究资料单因素分析提示,肿瘤直径与预后无关,但有文献报道肿瘤直径是影响预后的因素〔8〕。并且认为肿瘤越大,越容易产生较大的局部浸润,生长时间长容易产生远处转移。本组资料提示肿瘤的浸润深度与患者的生存率有明显的影响。T1期的5年生存率是83%,而T4期仅为8.3%。且多因素分析肿瘤的浸润深度是影响预后的独立因素。Kawada等〔9〕研究提示即使是局限在黏膜下层的肿瘤,其淋巴结转移率也有14.3%。存活率基本与报道相似〔10〕。单因素分析结果中黏液腺癌预后最差,高分化腺癌预后最好,不同组之间有显著的统计学差异,多因素分析结果示胃癌的组织学类型仍是影响预后的独立因素。
本组提示淋巴结的转移是影响胃癌预后重要的独立因素,淋巴结转移的患者的死亡风险是无淋巴结转移的患者3.572倍。Alakus等〔11〕和 Lee 等〔12〕和庞涛等〔13〕研究提示即使在有远处转移或者腹膜种植的患者中,淋巴结转移率也是影响其预后的独立因素。王昭等〔14〕认为至少要检出18个淋巴结,才能对患者的N分期提供较为准确的依据。单因素和多因素分析结果均显示,淋巴结阴性者术后预后较淋巴结阳性者好,两者之间差异有统计学意义,因此淋巴结转移可作为胃癌预后的独立因素。本组资料中腹膜转移患者为4.54%。与Ogata等〔15〕报道相符。本组资料提示腹膜转移也是影响预后的独立因素。本组腹膜转移患者的术后生存率较高,这可能与术中采取积极的手术方式处理腹膜转移及术后又采取了积极的治疗有关。腹膜转移患者的死亡风险是无腹膜种植的患者的2.831倍。
本组资料采用AJCC分期第6版pTNM分期,发现各期之间有明显的统计学差异,5年生存率随着病期的进展而递减。这与Yamamura等〔16〕研究所的结论相似。本组按淋巴结廓清范围不同分为D2,D3及姑息术。D3式5年生存率高于其他两种,且有显著性差异这与大量文献所报道的有所不一致〔17,18〕,可能与本组资料行D3术式的病例均为TNM早期的病例。多因素分析也显示淋巴结清扫方式是影响生存预后的独立因素。目前仍然推荐D2式是比较合理的廓清术式,既能保证廓清一定数量的淋巴结,又避免了由于手术范围过大,导致术后的并发症发生率及死亡率升高的不利〔19〕。
1 Chau I,Norman AR,Cunningham D.Multivariate prognostic factor analysis in locally advanced and metastatic esophago-gastric cancer-pooled analysis from three multicenter,randomized,controlled trials using individual patient data〔J〕.J Clin Oncol,2004;22(12):2395-403.
2 Wang BB,Liu CG,Lu P.Log-normal censored regression model detecting prognostic factors in gastric cancer:a study of 3018 cases〔J〕.World J Gastroenterol,2011;17(23):2867-72.
3 Pourhoseingholi MA,Hajizadeh E,Moghimi Dehkordi B,et al Comparing Cox regression and parametric models for survival of patients with gastric carcinoma〔J〕.Asian Pac J Cancer Prev,2007;8(3):412-6.
4 陈光群,黄志有.胃癌根治术后影响预后因素Cox分析〔J〕.癌症进展,2009;7(2):221-3.
5 吴亮亮,梁 寒,王晓娜,等.胃癌根治术后早期复发转移的相关因素分析〔J〕.中华外科杂志,2010;48(20):1542-5.
6 Huang CM,Lin JX,Zheng CH,et al.Prognostic impact of metastatic lymph node ratio on gastric cancer after curative distal gastrectomy〔J〕.World J Gastroenterol,2010;16(16):2055-60.
7 Mslika S,Benhamiche AM,Jouve JL,et al.Prognostic factors after curative resection for gastric cancer.A population-based study〔J〕.Eur J Cancer,2000;36:390-6.
8 Rausei S,Persiani R,Biondi A,et al.D Clinical significance and prognostic value of tumor maximum diameter in gastric carcinoma〔J〕.Suppl Tumori,2005;4(3):72-6.
9 Kawada K,Taketo MM.Significance and mechanism of lymph node metastasis in cancer progression〔J〕.Cancer Res,2011;71(4):1214-8.
10 Kim JG,Ryoo BY,Park YH,et al.Prognostic factors for survival of patients with advanced gastric cancer treated with cisplatin-based chemotherapy〔J〕.Cancer Chemother Pharmacol,2008;61(2):301-7.
11 Alakus H,Holscher AH,Grass G.Extracapsular lymph node spread:a new prognostic factor in gastric cancer Cancer〔J〕.2010;116(2):309-15.
12 Lee SY,Hwang I,Park YSet al.Metastatic lymph node ratio in advanced gastric carcinoma:a better prognostic factor than number of metastatic lymph nodes〔J〕?Int J Oncol,2010;36(6):1461-7.
13 庞 涛,方国恩,罗天航,等.早期胃癌淋巴结转移相关因素分析〔J〕.中国实用外科杂志,2010;2(30):111-3.
14 王 昭,詹文华,何裕隆.胃癌患者肝转移和腹膜扩散的相关因素及其预后分析〔J〕.中华胃肠外科杂志,2006;12(4):287-90.
15 Ogata K;Mochiki E;Yanai M.Factors correlated with early and late recurrence after curative gastrectomy for gastric cancer〔J〕.Hepatogastroenterology,2009;56(20):1760-4.
16 Yamamura Y,Nakajima T,Ohta K.Determining prognostic factors for gastric cancer〔J〕.using the regression tree method〔J〕.Gastric Cancer,2002;5(4):201-7.
17 Bilici A,Seker M,Ustaalioglu BB.Determining of metastatic lymph node ratio in patients who underwent D2 dissection for gastric cancer Med Oncol,2010;27(3):975-84.
18 Muratore A,Zimmitti G,Lo TR.Low rates of loco-regional recurrence following extended lymph node dissection for gastric cancer〔J〕.Eur J Surg Oncol,2009;35(4):588-92.
19 林建申,黄昌明,郑朝辉,等.孤立性淋巴结转移对胃癌预后的影响〔J〕.中华胃肠外科杂志,2010;13(3):185-8.
