非酒精性脂肪肝与冠心病发病的关系及可能机制
2012-08-02岳冬梅王凌燕上海交通大学附属新华医院崇明分院心内科上海20250
岳冬梅 刘 龙 王凌燕 (上海交通大学附属新华医院崇明分院心内科,上海 20250)
有学者发现非酒精性脂肪肝病人合并冠状动脉性心脏病(CHD)比例高于其他人群,其中丙氨酸氨基转移酶(ALT)升高的患者冠状动脉硬化程度重于ALT正常者。非酒精性脂肪肝及ALT与CHD发生、发展的关系得到了国内外心血管医生的关注,部分研究结果提示非酒精性脂肪肝患者CHD的发病率、死亡率升高;ALT升高和CHD相对危险度呈正相关;但研究结果不尽相同。因此,本文旨在进一步探讨非酒精性脂肪肝和CHD的关系、发病机制及血清ALT对CHD发生、发展的影响。
1 资料与方法
1.1 研究对象与分组 观察组:选择2009年2月至2011年2月我院和吉林大学中日联谊医院住院诊断为非酒精性脂肪肝的患者105例,其中男55例,女 50例,年龄 35~65〔平均(51.3±10.3)〕岁;对照组:选自我院和吉林大学中日联谊医院体检中心的健康人群95例,其中男49例,女46例,年龄在35~65〔平均(50.4±10.4)〕岁。根据血清ALT水平将观察组分为二个亚组,ALT>40 IU/L组50例;ALT<40 IU/L组55例。有下列情况之一者排除本试验:(1)应用糖皮质激素者;(2)既往有病毒性肝炎、药物性肝炎、血吸虫性肝病等肝脏病史;(3)其他可导致脂肪肝的特定疾病(如肝豆状核变性等);(4)饮酒折乙醇量>140 g/w(女性>70 g/w);(5)严重的肝、肾衰竭及肺、脑器质性疾病;(6)近期有创伤、手术、感染史者;(7)患有恶性肿瘤、血液系统疾病者。观察组与对照组年龄、性别、吸烟史、高血压患病率比较无显著性差异(P>0.05);但观察组CHD患病率高于对照组(P<0.05),ALT>40 IU组CHD患病率高于ALT<40 IU组(P<0.05)。见表1。
1.2 观察指标与研究方法
1.2.1 一般资料 通过询问病史及体格检查采集一般资料。①吸烟史:吸烟阳性定义为吸烟指数(支/d×吸烟年数)≥100。②酗酒史:酗酒阳性定义为饮酒指数(g/d×饮酒年数)≥150。③血压:使用标准台式汞柱血压计,以患者休息15 min后取坐位测量3次的平均收缩压与舒张压为准,以Korotkoff第一期为收缩压,第五期为舒张压。按1999年WHO/ISH高血压诊断标准:高血压为收缩压≥140 mmHg和(或)舒张压≥90 mmHg。
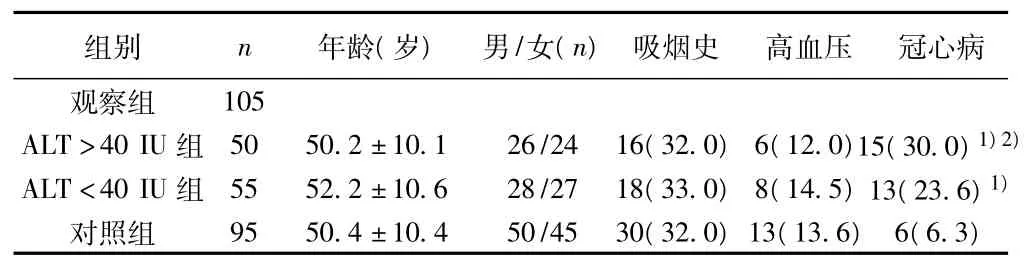
表1 研究对象的一般资料〔n(%)〕
1.2.2 生化指标检测 血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)、血清载脂蛋白A1(Apo A1)、血清载脂蛋白B(Apo B)、血清ALT、血清草氨酸转氨酶(AST)、血尿酸(UA)、空腹血糖(Glu):应用美国BECKMAN SYNCHRON LX20全自动生化分析仪,采用免疫比浊法测定,所用试剂盒均购自美国BECKMAN公司。所用血清标本采自入选人员空腹12 h清晨肘静脉血5 ml,即刻于4℃、3 000 r/min离心15 min,分离血清置 Eppendorf管,-20℃冰箱中冰冻保存待用,全部标本于试验时一批测定,以减少批间差异。
1.2.3 应用彩色多普勒超声仪检测患者颈动脉内膜中层厚度(IMT) 采用美国GE公司vivid7型彩色多普勒超声诊断仪。受试者仰卧,扫查左、右颈总、颈内、颈外动脉,取舒张末期测量管腔内膜界面的前缘到中层-外膜界面前缘的垂直距离作为IMT。分别测量左、右颈总动脉远端分叉1 cm处、颈内动脉起始端、颈动脉窦部IMT值3次,取其平均值。动脉粥样硬化斑块诊断标准:局限向管腔内突出IMT>1.2 mm的突起。
1.2.4 应用彩色多普勒超声仪诊断非酒精性脂肪肝 采用美国GE公司vivid7型彩色多普勒超声诊断仪。非酒精性脂肪肝诊断标准采用中华医学会肝脏病学分会脂肪肝学组制定的“非酒精性脂肪肝临床诊断标准”。诊断标准:(1)无饮酒史或饮酒折合乙醇量<140 g/w(女性<70 g/w);(2)除外病毒性肝炎、
药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;(3)腹部超声有以下表现中的两项:①肝脏近场回声弥漫性增强(“明亮肝”),回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。
1.3 统计学方法 应用SPSS14.0统计软件进行分析,计量资料以±s表示,组间比较采用独立样本t检验,计数资料采用χ2检验,相关性分析采用Pearson相关分析。
2 结果
2.1 观察组与对照组血脂、Glu水平比较 观察组TC、TG、LDL-C、空腹 Glu、血尿酸水平明显高于对照组(P<0.05);HDL-C明显低于对照组(P<0.05)。ALT>40 IU/L组血尿酸水平明显高于 ALT<40 IU/L组(P<0.01);血清 TC、TG、LDL-C、Apo B、空腹Glu水平有增高趋势,HDL-C、Apo A1水平低于ALT<40 IU/L组,但无差别(P>0.05)。见表2。
表2 各组血脂、血糖水平比较(±s)
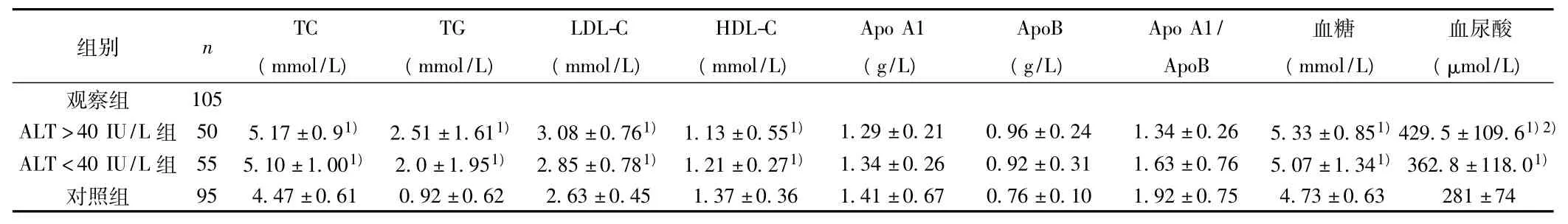
表2 各组血脂、血糖水平比较(±s)
与对照组比较:1)P<0.01;与ALT<40 IU/L组比较:2)P<0.05;下表同
?
2.2 血清ALT水平与TG的相关性 ALT水平与TG水平呈正相关(r=0.166,P <0.05)。
2.3 观察组与对照组IMT、颈动脉斑块数目及颈动脉斑块检出率比较 观察组与对照组以及ALT>40 IU/L组与ALT<40 IU/L组相比,IMT、颈动脉斑块数目、颈动脉斑块检出率、均有显著性差异(P<0.05)。见表3。
表3 IMT、颈动脉斑块数目及颈动脉斑块检出率比较(±s)
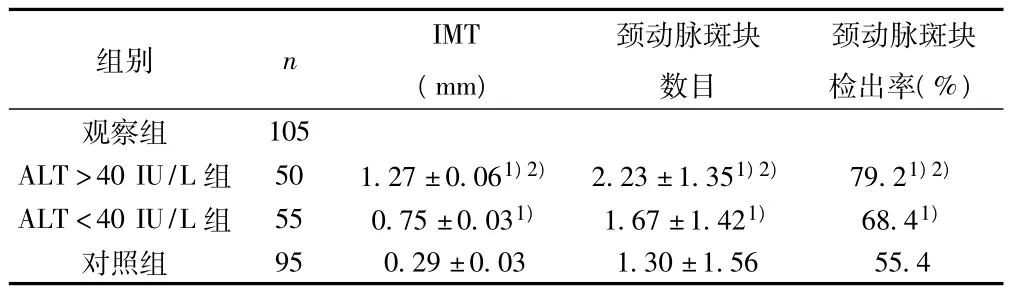
表3 IMT、颈动脉斑块数目及颈动脉斑块检出率比较(±s)
组别 n IMT(mm)颈动脉斑块数目颈动脉斑块检出率(%)观察组105 ALT>40 IU/L组 50 1.27±0.061)2) 2.23±1.351)2) 79.21)2)ALT<40 IU/L组 55 0.75±0.031) 1.67±1.421) 68.41)对照组95 0.29±0.03 1.30±1.56 55.4
3 讨论
随着CHD病因学研究的深入,除了传统的CHD危险因素如年龄、性别、高血压、糖尿病、血脂异常等因素外,炎症反应、呼吸道感染、摄入咖啡、空气污染、高尿酸血症、高同型半胱氨酸血症等也是CHD新近认同的危险因素。Jepsen等〔1〕认为非酒精性脂肪肝是不依赖于CHD传统危险因素的独立预测因素。Ekstedt等〔2〕指出非酒精性脂肪肝患者生存时间缩短,其CHD死亡率增高。Targher等〔3〕也指出ALT水平不依赖于非酒精性脂肪肝及代谢综合征,与CHD独立相关,可以作为预测CHD的危险因子。
本实验结果提示非酒精性脂肪肝与AS发生有关,而ALT升高可以评价AS的严重程度。非酒精性脂肪肝患者中存在多种AS发病的危险因素,而其中ALT升高患者严重程度更加明显:(1)血脂异常。本实验结果可以看出非酒精性脂肪肝组患者TC、TG、LDL-C、Apo B这些促AS的血脂水平均高于对照组,而保护性血脂HDL-C、Apo A1、Apo A1/Apo B值则低于对照组,并且ALT升高组有更严重的血脂紊乱。与Musso等〔4〕研究类似,提示非酒精性脂肪肝通过异常脂蛋白代谢而加重AS。(2)高尿酸血症。本实验结果显示非酒精性脂肪肝组与对照组相比血尿酸水平升高,ALT升高组血尿酸水平高于ALT正常组。有试验证实人类AS斑块中有较高的UA,说明UA在AS形成过程中有直接作用〔5〕。高UA血症通过以下机制对AS产生影响:①血UA水平达到一定浓度时可析出结晶,于血管壁上沉积而损伤动脉内膜、刺激血管内皮细胞增生及脂类在内壁沉积,进一步诱发和加重动脉硬化。②高UA血症可以增加血小板的聚集,促进血管内血栓形成。③UA升高参与炎症反应。已证实血UA水平增高与内皮细胞功能、炎症因子、NO合酶(NOS)通路及氧化应激状态有相关性,UA结晶可诱发炎症反应,导致心血管事件发生率明显升高〔6,7〕。(3)高血糖。本实验结果可以看出非酒精性脂肪肝组血糖水平高于对照组,ALT升高组血糖水平高于ALT正常组。Selvin等〔8〕的研究结果认为血糖和糖化血红蛋白水平的高低与主要的心血管事件密切相关。高血糖状态可引起血管内皮细胞损伤,使血小板活性增强,并加重蛋白质及脂质代谢异常,使血液呈高凝、高黏度状态,氧自由基增多,促进AS形成。另外,高血糖影响心脏自主神经功能,使大血管血供下降;还可使血管外周间质中胶原蛋白堆积,血管壁纤维化、血流弥散受阻,影响微循环状态,使心肌细胞长期处于缺血缺氧状态。与血糖正常的人群相比,2型糖尿病患者是心血管事件及死亡的高危患者。
非酒精性脂肪肝与AS之间可能的发病机制分析如下:(1)炎症反应及氧化应激。非酒精性脂肪肝患者体内反应性氧簇(ROS)产生过多,ROS通过以下途径促进AS的发生、发展:①内皮细胞功能失调。ROS产生增加可使动脉血管内皮细胞膜稳定性及通透性平衡失调、炎症因子表达增加,并影响内分泌及旁分泌功能、血管舒缩功能及抗血栓形成功能,产生血管重构等反应〔9〕。ROS还破坏内皮细胞的增殖与凋亡平衡,引起血管内皮细胞凋亡。ROS导致内皮细胞增殖与凋亡的失衡,导致血管内皮细胞生成障碍。② 影响血管平滑肌细胞(VSMC)增殖〔10〕。③对TC、LDL、VLDL等脂质成分的过氧化作用。氧化后的脂质成分包括胆固醇、ox-LDL、ox-VLDL,进一步损伤血管内皮,通过产生趋化因子、刺激血管平滑肌细胞增殖、炎症因子表达增加等影响AS的形成和进展。(2)免疫反应。血管粥样硬化斑块内存在包括支原体、巨细胞病毒及肝炎病毒等感染,感染的病原体通过直接对血管内皮损伤和释放毒素及热休克蛋白诱发及加剧血管原位免疫反应,导致粥样斑块形成。而AS斑块的形成中有巨噬细胞及T淋巴细胞浸润,且有抗原抗体表达,它们协调细胞间的相互作用并调节血管功能。另外,各种免疫因素,可通过表达多种黏附分子而诱导和调节细胞免疫功能促使病变进展。(3)胰岛素抵抗、脂肪源性激素、肝细胞功能改变等也可能是非酒精性脂肪肝促进AS的机制之一。
1 Jepsen P,Vilstrup H,Mellemkjaer L,et al.Prognosis of patients with a diagnosis of fatty liver-a registry-based cohort study〔J〕.Hepatogastroenterology,2003;50(54):2101-4.
2 Ekstedt M,Franzen LE,Mathiesen UL,et al.Long-term follow-up of patients with NAFLD and elevated liver enzymes〔J〕.Hepatology,2006;44(4):865-73.
3 Targher G,Bertolini L,Poli F,et al.Nonalcoholic fatty liver disease and risk of future cardiovascular events among type 2 diabetic patients〔J〕.Diabetes,2005;54:3541-6.
4 Musso G,Gambino R,Michieli F,et al.Dietaryhabits and their relations to insulin resistance and postprandial lipemia in nonalcoholic steatohepatitis〔J〕.Hepatology,2003;37(4):909-16.
5 Sakai H,Shichiri M,Hirata Y.Hypouricemia in diabetes mellitus〔J〕.Nippon Rinsho,2003;61(1):390-2.
6 Anker SD,Doehner W,Rauchhaus M,et al.Uric acid and survival in chronic heart failure:validation and application in metabolic,functional,and hemodynamic staging〔J〕.Circulation,2003;107(15):1991-7.
7 Tatsuno I,Saito Y.Hyperuricemia in hypertension〔J〕.Nippon Rinsho,2001;59(5):967-72.
8 Selvin E,Steffes MW,Zhu H,et al.Glycated hemoglobin,Diabetes,and cardiovascular risk in nondiabetic adults〔J〕.N Engl J Med,2010;362(9):800-11.
9 Xi H,Akishita M,Nagai K,et al.Potent free radical scavenger,edaravone,suppresses oxidative stress-induced endothelial damage and early atherosclerosis〔J〕.Atherosclerosis,2007;191(2):281-9.
10 Schroder K,Helmcke I,Palfi K,et al.Nox 1 mediates basic fibroblast growth factor-induced migration of vascular smooth muscle cells〔J〕.Arterioscler Thromb Vasc Biol,2007;27(8):1736-43.
