石家庄地区老年人APOE、LDLR和ER-α基因多态性与血清胆固醇水平的相关性
2012-08-02宋志勇胡进中申军华李芳芳
贾 川 宋志勇 胡进中 申军华 程 念 李芳芳
(河北医科大学生物化学和分子生物学教研室,河北 石家庄 050017)
阿尔茨海默病(AD)的发生发展受遗传因素和环境因素等多种因素影响。流行病学、生物医学、遗传学的各项研究已经证实了有三个基因(APP、PSEN1、PSEN2)的致病性突变是引起早发性AD的原因。有一个基因(APOE)与迟发性AD有关。目前,在AD的遗传学研究中发现约350个基因与AD有相关性,它们分散存在于23对染色体。在这之中包括雌激素受体α基因(ER-α)和低密度脂蛋白受体基因(LDLR)〔1〕。利用PET技术检测大脑不同区域的葡萄糖代谢,发现高胆固醇血症的老年人群脑的某些区域葡萄糖的利用率降低,更为重要的是葡萄糖利用率降低的区域特征与AD患者类似,而与正常衰老个体不同〔2~4〕。本研究观察正常中老年人群 APOE、LDLR、ER-α 多态性与血清胆固醇水平的关系。
1 材料与方法
1.1 研究对象 河北省石家庄市社区内居住的45岁以上普通健康中老年人群,随机抽样201名志愿者。均在石家庄居住20年以上,男52名,女149名,年龄45~85岁。
1.2 主要仪器与材料 PCR PX2 Thermal Cycler美国Thermo公司,捷达801系列凝胶成像分析系统江苏捷达,Taq DNA聚合酶Promega生物技术有限公司,10 mmol/L dNTP,PCR扩增上下游引物,限制性内切酶HhaⅠ,限制性核酸内切酶XbaⅠ,限制性内切酶PvuⅡ,限制性内切酶AvaⅡ,甘油三酯、总胆固醇和血糖试剂盒。
1.3 方法
1.3.1 一般情况 排除自述患有糖尿病病史及正在服用降脂类药物的志愿者。
1.3.2 采用葡聚糖沉淀法从全血白细胞中提取模板DNA
向抗凝处理外周静脉血3 ml中加入1.5 ml葡聚糖溶液(4%),静置45~60 min后,吸取淡黄色上清液,离心2 000 r/min 10 min。弃上清,向沉淀的细胞加入1 ml三蒸水,吹打开细胞团后离心2 000 r/min 10 min。弃上清,向沉淀细胞加入1 ml生理盐水,吹打开细胞团后离心2 000 r/min 10 min。弃上清,向沉淀的细胞加入0.5 ml TES溶液(15 mmol/L)悬浮细胞,加入100 μl蛋白酶 K(2 g/L)和 160 μl SDS 溶液(10%),置于 37℃水浴箱中消化过夜。向消化过夜的裂解液中加入等体积的Tris-饱和酚,颠倒混匀10 min,离心 4 000 r/min 10 min。上层水相转入新管中,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀10 min,离心4 000 r/min 10 min。上层水相转入新管中,加入等体积的氯仿∶异戊醇(24∶1),颠倒混匀10 min,离心4 000 r/min 10 min。待离心结束后,上层水相转入新管中,加入1/10体积的NaAc(3 mol/L)和2.5倍体积的冷无水乙醇,轻轻混匀后可见白色絮状DNA沉淀析出。离心12 000 r/min 15 min。弃上清,用乙醇(75%)漂洗 DNA,离心12 000 r/min 3 min,弃上清,置于室温晾干,加入 100 μl TE缓冲液溶解DNA,置4℃保存,待用。
1.3.3 DNA浓度及纯度鉴定 取适量DNA,稀释100倍,测定OD260nm与OD280nm的数值。计算DNA浓度和纯度(OD260nm/OD280nm的比值在1.6~1.8之间可以用于PCR扩增)。
1.3.4 PCR引物 APOE引物:上游引物:5′ACA GAA TTC GCC CCG GCC TGG TAC AC 3′,下游引物:5′TAA GCT TGG CAC GGC TGT CCA AGG A 3′;ER-α 引物:上游引物:5′CTG CCA CCC TAT CTG TAT CTT TTC CTA TTC TTC 3′,下游引物:5′TCT TTC TCT GCC ACC CTG GCG TCG ATT ATC TGA 3′;LDLR引物:上游引物:5′GTC ATC TTC CTT GCT GCC TGT TTA 3′,下游引物:5′GGT TCC ACA AGG AGG TTT CAA GGT T 3′。由上海生物工程技术服务有限公司合成。
1.3.5 PCR-RFLP分析基因多态性
1.3.5.1 APOE基因多态性 PCR扩增:PCR反应体系为:模板 DNA(200 ng 左右)4μl,10 × PCR 缓冲液 3 μl,MgCl2溶液2.5 μl,上游引物(20 pmol/μl)2 μl,下游引物(20 pmol/μl)2 μl,10 mmol/L dNTP(200 μmol/L)0.5 μl,Taq DNA 聚合酶(5 U/μl)0.5 μl,三蒸水 10.5 μl,总体积 25 μl。PCR 循环条件:95℃预变性5 min,95℃变性 30 s,69.2℃退火1 min,72℃延伸50 s,变性、退火、延伸共进行33个循环,最后72℃延伸7 min。2%琼脂糖凝胶电泳鉴定,扩增产物片段长度应为246 bp。HhaⅠ酶切:反应体系为:扩增产物10 μl,限制性内切酶 HhaⅠ(5 U/μl)1 μl,10 × 酶切缓冲液 2 μl,三蒸水补至总体积20 μl。37℃水浴消化过夜。4%琼脂糖凝胶电泳鉴定酶切后产物,凝胶分析成像系统下记录各样本酶切后产物的条带和APOE基因分型。
1.3.5.2 LDLR基因多态性 PCR扩增:PCR反应体系为:模板 DNA(200 ng左右)5 μl,10 × PCR 缓冲液 3 μl,MgCl2溶液2.5 μl,上游引物(20 pmol/μl)2 μl,下游引物(20 pmol/μl)2 μl,10 mmol/L dNTP(200 μmol/L)0.5 μl,Taq DNA 聚合酶(5 U/μl)0.5 μl,三蒸水 9.5 μl,总体积 25 μl。PCR 循环条件:95℃预变性5 min,95℃ 变性 30 s,68℃ 退火 1 min,72℃ 延伸2 min,变性、退火、延伸共进行30个循环,最后72℃延伸5 min。扩增片段长度应为228 bp。AvaⅡ酶切:反应体系如下:扩增产物 7.5 μl,限制性内切酶 AvaⅡ(10 U/μl)0.75 μl,10 × 酶切缓冲液2 μl,三蒸水补至总体系20 μl。37℃水浴消化过夜。3%琼脂糖凝胶电泳鉴定酶切产物,凝胶分析成像系统记录各样本酶切后基因分型。
1.3.5.3 ER-α基因多态性 PCR扩增:PCR反应体系:模板DNA(200 ng 左右)5 μl,10 × PCR 缓冲液 2.5 μl,MgCl2溶液2 μl,上游引物(20 pmol/μl)2 μl,下游引物(20 pmol/μl)2 μl,10 mmol/L dNTP(400 μmol/L)1 μl,Taq DNA 聚合酶(5 U/μl)1 μl,三蒸水补至总体积 25 μl。PCR 循环条件:95℃ 预变性5 min,94℃变性 40 s,60℃退火 40 秒,72℃ 延伸 90 s,变性、退火、延伸共进行35个循环,最后72℃延伸5 min。扩增片段长度为1 300 bp。XbaⅠ和PvuⅡ分别酶切ER-α PCR扩增产物:XbaⅠ酶切:反应体系如下:扩增产物 5 μl,酶 XbaⅠ(15 U/μl)0.75 μl,10%BSA 2 μl,10 × 酶切缓冲液 2 μl,三蒸水 10.25 μl,总体积20 μl。充分混匀后置于37℃水浴箱水浴消化过夜;PvuⅡ酶切:反应体系如下:扩增产物 5 μl,PvuⅡ(10 U/μl)0.75 μl,10 × 酶切缓冲液 2 μl,三蒸水补至总体系 20 μl。37℃水浴消化过夜。1.5%琼脂糖凝胶电泳鉴定酶切产物,凝胶分析成像系统下观察各样本酶切后产物的条带情况,记录各样本ER-α基因分型。
1.3.6 血生化指标的测定 晨起空腹抽取外周静脉血液1 ml,分离血清。血糖的测定:葡萄糖氧化酶法。血中总胆固醇测定:酶比色法。血中甘油三酯测定:酶比色法。用全自动血生化分析仪测定高密度脂蛋白胆固醇(HDL-Ch),低密度脂蛋白胆固醇(LDL-Ch),极低密度脂蛋白胆固醇(VLDL-Ch)含量(河北省中医院检验中心)。
1.4 统计分析 利用Hardy-Weinbreg平衡检验方法对样本进行各个基因型分布平衡检验,检验样本是否具有群体性,代表性。使用SPSS17.0软件和SAS V8软件进行统计分析,使用直接计数法记录并计算各基因的基因型,等位基因的频数和频率。组间比较基因频率,等位基因频率采用χ2检验和Fisher确切概率法。用非参数Mann-Whitney检验统计分析两个组间是否存在差别。用非参数Kruskal-Wallis H检验统计分析两个以上组间是否存在差别,有差别用Nemenyi检验进行两两比较。
2 结果
2.1 APOE基因 APOE基因(HhaⅠ)基因型分为 E2/E2,E2/E3,E2/E4,E3/E3,E3/E4,E4/E4 共 6 型。本次采样 E2/E2,E4/E4型缺失。总共测定180人APOE基因型,其中女性132名,男性48人。E2/E3型13.9%,E2/E4型1.1%,E3/E3型76.1%,E3/E4型8.9%。经检验基因型分布符合Hardy-Weinberg平衡。等位基因频率 E2共为7.5%,E3共为87.5%,E4共为5%。
APOE基因型组间比较血清总胆固醇水平时,其中男性、年龄≥60岁亚组中APOE基因型组间胆固醇水平存在差别,Nemenyi检验进行组间两两比较:E3/E3型胆固醇水平高于E2/E3型(P=0.041)。若APOE等位基因组间比较胆固醇水平时,其中男性、年龄≥60岁亚组中胆固醇水平有差别(P=0.025),Nemenyi检验进行组间两两比较:E3等位基因组胆固醇水平高于E2组(P=0.018),结果见表1,表2。
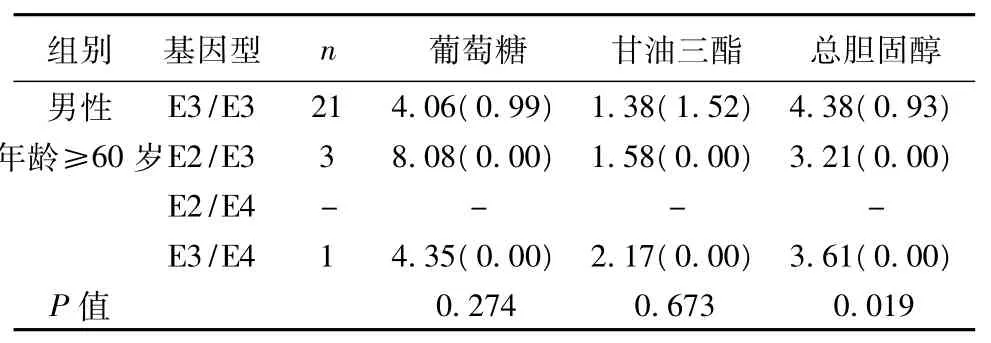
表1 APOE基因型之间血清生化指标比较〔M(QR),mmol/L〕
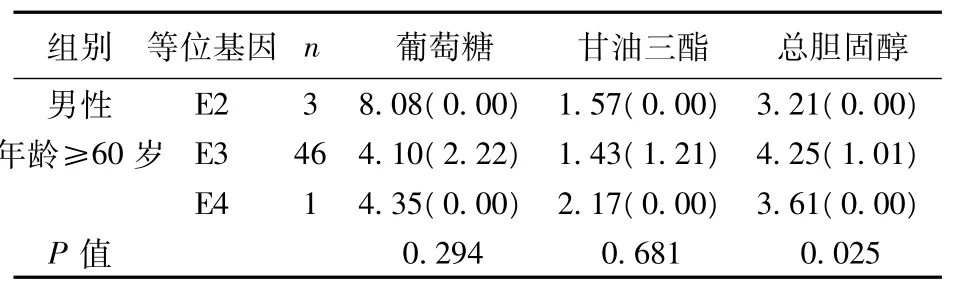
表2 APOE等位基因之间血清生化指标比较〔M(QR),mmol/L〕
APOE基因型组间比较VLDL-Ch水平时,其中全性别、全年龄亚组中VLDL-Ch水平可能有差别(P=0.042),Nemenyi检验进行组间两两比较:E2/E3型VLDL-Ch水平高于E3/E3型(P=0.044)。若APOE等位基因组间比较VLDL-Ch水平时,全性别、全年龄亚组中VLDL-Ch含量可能有差别(P=0.027),Nemenyi检验进行组间两两比较:E2等位基因组VLDL-Ch水平高于E3组(P=0.029),见表3,表4。
2.2 LDLR基因 LDLR基因(AvaⅡ)基因型分为(AA,aa,Aa)3型。总共测定182人LDLR基因的基因型,其中女性134名,男性48人。AA型59.4%,aa型1.6%,Aa型39%,经检测基因型分布符合Hardy-Weinberg平衡。LDLR等位基因分A,a,等位基因频率:A等位基因共为78.8%,a等位基因共为21.2%。
LDLR基因基因型组间比较LDL-Ch水平时,其中全性别、年龄≥60岁亚组中LDLR基因基因型组间LDL-Ch水平存在差异(P=0.03),Nemenyi检验进行组间两两比较:aa型LDL-Ch水平高于Aa型(P=0.034),见表5。

表3 APOE基因型之间血清生化指标比较〔M(QR),mmol/L〕
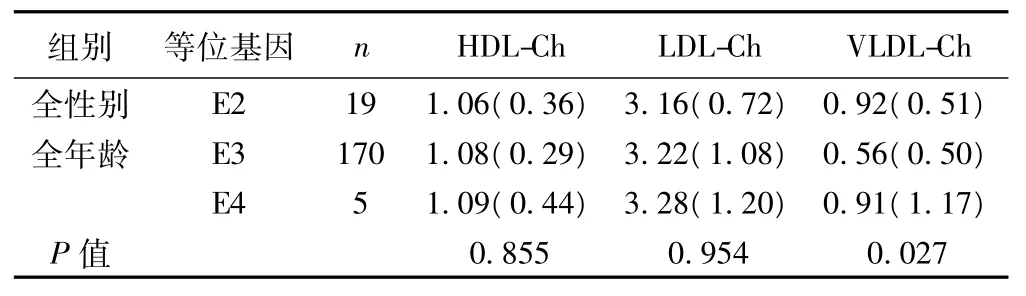
表4 APOE等位基因之间血清生化指标比较〔M(QR),mmol/L〕

表5 LDLR基因等位基因之间血清生化指标比较〔M(QR),mmol/L〕
2.3 ER-α(XbaⅠ)基因型 ER-α 基因(XbaⅠ)基因型分为(XX,xx,Xx)3型。总共测定177人,其中女性132名,男性45人。XX型3.4%,xx型51.4%,Xx型45.2%,经检测基因型分布符合Hardy-Weinberg平衡。等位基因分X,x种。等位基因频率:X等位基因26%,x等位基因74%。ER-α(XbaⅠ)各基因型组间胆固醇水平不存在差异。见表6。

表6 ER-α(XbaⅠ)等位基因之间血清生化的比较〔M(QR),mmol/L〕
2.4 ER-α(PvuⅡ)基因型 ER-α 基因(PvuⅡ)基因型分为(PP,pp,Pp)3型。总共测定177人,其中女性132名,男性45人。PP型14.1%,pp型41.8%,Pp型 44.1%,经检测基因型分布符合Hardy-Weinberg平衡。等位基因分P,p种。等位基因频率:P等位基因共为36.2%,p等位基因共为63.8%。
ER-α基因(PvuⅡ)基因型比较 LDL-Ch水平时,其中全性别、年龄<60岁亚组等位基因组间LDL-Ch水平可能存在差异,p等位基因组LDL-Ch水平高于P等位基因组(P=0.048),见表7。在男性、年龄≥60岁亚组中,等位基因组间HDL-Ch水平可能存在差异,p等位基因组HDL-Ch水平高低于P等位基因组(P=0.018),见表8。

表7 ER-α(PvuⅡ)等位基因之间血清生化指标比较〔M(QR),mmol/L〕
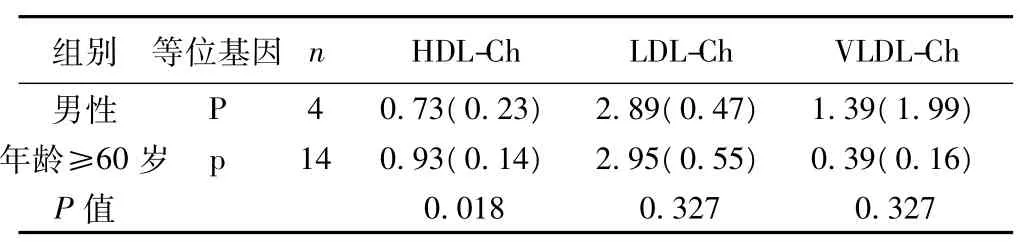
表8 ER-α(PvuⅡ)等位基因之间血清生化指标比较〔M(QR),mmol/L〕
3 讨论
APOE不同的异构体与LDL受体的亲和力也有所不同,对脂类的代谢也有不同的影响。本研究表明在石家庄社区内,APOE的基因型可以影响到血胆固醇的含量,尽管APOE基因E4等位基因是AD的易感基因,我们的研究结果表明,在所研究的年龄段和性别中,APOE基因 E4等位基因并不伴随着血胆固醇的升高,推测其他的基因因素也参与内源性决定血胆固醇水平。
LDLR基因编码存在于多种细胞膜上低密度脂蛋白受体,它的主要功能是从血液中识别和结合LDL,将它们转入细胞。受体复合物进入细胞后被分解并释放胆固醇,这些胆固醇被细胞利用、储存或者排出体外。LDLR基因第13外显子上存在一个AvaⅡ酶切多态性位点,这一位点的多态性与tau蛋白增多有关,而tau蛋白的脑内异常是AD的病理变化之一,所以此多态性位点可能与AD有关〔7〕。本研究在分析LDLR第13外显子(AvaⅡ)基因多态性与血生化指标相关性时发现:全性别(年龄≥60岁组)中,aa型LDL-Ch水平明显高于 Aa型,这一结果更加支持了血浆中胆固醇的水平是受多基因调控的判断。
ER-α基因包括8个外显子和7个内含子。在第一内含子上有两个多态性位点,相差只有50 bp,分别为A/G的SNP位点(被限制性内切酶XbaⅠ识别)和T/C的SNP位点(被限制性内切酶PvuⅡ识别)。这两个酶切位点可能对雌激素受体α的基因表达效率产生一定的影响〔6〕。大量临床调查分析显示,绝经后妇女使用雌激素的替代治疗可以有效地减少AD的发病风险,这提示ER对脑神经组织具有保护作用,而ER的功能和基因表达可能会受到DNA多态性的影响。在瑞典,女性家族性AD发病风险的提高与同时携带ER-α基因Xba I位点xx基因型加APOE基因E4等位基因有关,亦和同时携带ER-α基因(PvuⅡ)pp基因型加APOE基因E4等位基因具有相关性〔7〕。本研究结果提示ER-α基因(PvuⅡ)等位基因除了可能调控基因表达效率外,也可能参与控制血胆固醇的水平〔8〕。
本研究胆固醇水平除与饮食因素有关外,还与基因多态性有关。我们认为:人体存在多个决定血胆固醇水平的基因,并且基因作用所占得比重不同。这就如同“大鱼”和“小鱼”的关系,假如APOE基因效应是一条“大鱼”,那么其他众多基因的作用就如同“小鱼”,有一个叠加的作用。另一方面,这些基因在人生的不同时期所呈现的效应不同。在个体青年时,基因效应不明显,当进入中老年期,这种基因效应将逐渐表现出来。这些基因的多态性共同决定血中胆固醇水平的增龄性改变,通过持续检测血胆固醇水平的增龄性变化和多个相关基因的多态性,也许可以为AD高危人群的超早期筛查及预防和诊断提供帮助。
1 Nilufer ET.Genetics of Alzheimer′s disease:a Centennial Review〔J〕.Neuro Clin,2007;25(5):611-67.
2 Shobab LA,Hsiung GY,Feldman HH,et al.Cholesterol in Alzheimer′s disease〔J〕.Lancet Neurol,2005;4(12):841-52.
3 Zhou B,Teramukai S,Fukushima M,et al.Prevention and treatment of dementia or Alzheimer′s disease by statins:a meta-analysis〔J〕.Dement Geriatr Cogn disord,2007;23(1):194-201.
4 Reiman EM,Chen K,Langbaum JBS,et al.Higher serum total cholesterol levels in late middle age are associated with glucose hypometabolism in brain regions affected by Alzheimer′s disease and normal aging〔J〕.Neurolmage,2011;49(1):169-76.
5 Lamsa R,Helisalmi S,Tapiola T,et al.Genetic study evaluating LDLR polymorphisms and Alzheimer′s disease〔J〕.Neurobiol Aging,2008;29(7):848-55.
6 黄宪章,李 艳.雌激素受体基因多态性的研究进展〔J〕.国外医学临床生物·化学与检验学分册,2000;21(5):254-5.
7 Mattila KM,Axelman K,Rinne JO,et al.Interaction between estrogen receptor 1 and the ε4 allele of apolipoprotein E increases the risk of familial Alzheimer′s disease in women〔J〕.Neurosci Letters,2000;282(1-2):45-8.
8 Molvarec A,Nagy B,Kovacs M,et al.Lipid,haemostatic and inflammatory variables in relation to the estrogen receptor α(ESR1)Pvu II and Xba I gene polymorphisms〔J〕.Clinica Chimica Acta,2007;380(1):157-64.
