TAT-tCNTF提高Aβ损伤细胞模型的GSH水平和SOD酶活性研究
2012-08-01吴行伟任文静赵振满陈晓倩王德花刘泽源曲恒燕军事医学科学院附属医院药学部北京0007军事医学科学院附属医院检验科北京0007
吴行伟,张 琴,唐 希,吴 坤,任文静,赵振满,陈晓倩,金 欣,王德花,刘泽源,曲恒燕(.军事医学科学院附属医院药学部,北京 0007;.军事医学科学院附属医院检验科,北京 0007)
阿尔茨海默病(alzheimer disease, AD)为中枢神经系统退行性疾病,β淀粉样蛋白(amyloid beta, Aβ)异常聚集和老年斑的形成被认为是AD发病的主要机制[1]。目前治疗AD的药物多是针对其引起的外在症状,缺乏能从根本上抑制Aβ聚集,阻止老年斑形成,促进神经元存活的药物。睫状神经营养因子(ciliary neurotrophic factor, CNTF)能促使多种神经细胞的存活,是第一个被发现的能维持在体和离体脊髓运动神经元的存活及突起生长的营养因子[2-5]。CNTF能有效对抗Aβ的毒性并能抑制老年斑的形成,对AD的治疗具有积极作用,但由于其分子量大,水溶性差,难以透过血脑屏障,故难以发挥对AD疾病的治疗作用。人类免疫缺陷病毒-1(HIV-1)的反义激活转录蛋白(transactivator transcription, TAT)中的TAT48-58是由11个氨基酸组成的蛋白转导域,能携带生物大分子透过生物膜和血脑屏障而不改变其生物活性[6]。我们的前期研究[4,7]将截短式的tCNTF与TAT连接在一起得到TAT-tCNTF融合蛋白,并证明了其既能有效透过生物膜和血脑屏障,又能发挥对AD疾病模型的治疗作用。
由Aβ诱导的脑组织及神经细胞的氧化应激效应对AD的发生和发展具有重要作用[8-11],Aβ25-35是Aβ肽产生神经毒性的重要活性片段[12-13],故本实验采用体外Aβ25-35损伤人骨髓神经母细胞瘤(SH-SY5Y)细胞模拟体内AD模型。有报道称HIV-1-TAT蛋白能诱导细胞的氧化应激,诱导内皮细胞衰老和凋亡[14-15]。本课题组所研究的TAT-tCNTF融合蛋白中的TAT部分来源自HIV-1-TAT蛋白,可能具有增加模型内细胞和组织氧化应激程度的效应,从而加重AD疾病的程度。故此,我们选择重组人睫状神经营养因子(rhCNTF)和TAT-tCNTF中包含的蛋白转导肽部分TAT48-58以及我们自行表达的TAT-tCNTF,采用析因设计和单因素多水平设计方法设计实验,研究上述不同蛋白和Aβ损伤与否,以及不同浓度的TAT48-58肽段对SH-SY5Y细胞中SOD酶活性和GSH水平变化,为深入研究TAT-tCNTF治疗AD的作用机制提供参考。
1 材料与方法
1.1 试剂与材料
神经母瘤细胞SH-SY5Y(军事医学科学院附属医院临床药理室),SOD检测试剂盒(日本株式会社同仁化学研究所),GSH检测试剂盒(美国R&D公司),rhCNTF、Aβ25-35(Sigma公司),RPMI1640培养液(GIBCO公司),胎牛血清(北京四季青公司),TAT-tCNTF(本实验室自行合成并验证活性),TAT48-58肽段(上海波泰生物科技有限公司)。
1.2 TAT-tCNTF、TAT48-58和rhCNTF对Aβ损伤/非损伤模型的抗氧化效应
1.2.1 实验设计 本实验采用2×4析因设计,实验因素为Aβ损伤与否和加入蛋白类型,Aβ损伤因素分为“损伤”和“不损伤”两个水平,加入蛋白类型因素的水平分别为TAT-tCNTF、TAT48-58、rhCNTF和无蛋白对照组。故实验分为8组:①损伤加TAT-tCNTF组;②损伤加TAT48-58组;③损伤加rhCNTF组;④损伤不加蛋白组;⑤无损伤加TAT-tCNTF组;⑥无损伤加TAT48-58组;⑦无损伤加rhCNTF组;⑧无损伤不加蛋白组。每组重复五次。
1.2.2 实验方法 (1)Aβ模型的建立:将Aβ肽以无菌双蒸水溶解配制成浓度为1 g·L-1的溶液,37 ℃下孵育1周以使其聚合。将聚合态的Aβ以10 μmol·L-1与SH-SY5Y细胞共同孵育24 h,即得损伤模型。
(2)实验内容:收集SH-SY5Y细胞,以2×105个/孔铺6孔板,37 ℃、5%CO2饱和湿度条件下孵育2 h以使其贴壁。依实验设计,向损伤模型细胞孔加入经37 ℃孵育1周(以使其聚合)后的Aβ使其终浓度为10 μmol·L-1。37 ℃孵育24 h,依实验设计,向不同蛋白组中加入TAT-tCNTF、TAT48-58和rhCNTF,使TAT-tCNTF和rhCNTF的终浓度为250 μg·L-1,TAT48-58短肽以其分子量换算与TAT-tCNTF相同物质的量的终浓度为17.8 μg·L-1。37 ℃孵育24 h。消化收集细胞,反复冻融细胞5次以使其完全破碎,离心后取上清用SOD试剂盒检测SOD的酶活性;用GSH试剂盒检测GSH的含量。
1.3 TAT48-58肽段对SH-SY5Y细胞的氧化应激效应
1.3.1 实验设计 本实验采用单因素5水平设计,因素为TAT48-58肽的浓度,水平为0,178,356,890,1780 μg·L-1,每水平重复5次。
1.3.2 实验方法 收集SH-SY5Y细胞,2×105个/孔铺6孔板,37 ℃、5%CO2孵育3 h使其完全贴壁后加不同浓度TAT48-58,继续孵育48 h。反复冻融5次使细胞破碎,离心取上清行GSH含量和SOD酶活性的检测。
1.4 统计方法
结果采用(平均值±标准差)表示,析因设计结果采用析因设计定量资料的方差分析进行统计,两两比较采用LSMEANS方法实现;单因素多水平设计采用单因素多水平定量资料的假设检验。统计软件采用SAS 9.1标准版。
2 结果
2.1 TAT-tCNTF对Aβ损伤模型的抗氧化效应
2.1.1 方差分析的总模型 SOD酶活性资料和GSH水平资料的方差分析模型统计量和P值分别是F=6.15,P= 0.000 1和F= 9.45,P= 0.000 1,说明模型均具有统计学意义,可用于资料的统计分析。本实验的实验结果如表1,TAT-tCNTF组和rhCNTF组分别与对照组比较的结果见图1和图2。
表1 加入不同的蛋白对SH-SY5Y细胞Aβ损伤/非损伤模型的SOD活性抑制率和GSH含量影响结果.n = 5,±sTab 1 Results of the inhibition ratio of SOD and concentration of GSH in SH-SY5Y cells damaged or undamaged by Aβ after being given different kinds of protein.n = 5,±s

表1 加入不同的蛋白对SH-SY5Y细胞Aβ损伤/非损伤模型的SOD活性抑制率和GSH含量影响结果.n = 5,±sTab 1 Results of the inhibition ratio of SOD and concentration of GSH in SH-SY5Y cells damaged or undamaged by Aβ after being given different kinds of protein.n = 5,±s
GSH浓度/U·L-1 TAT-tCNTF TAT rhCNTF 对照 TAT-tCNTF TAT rhCNTF 对照损伤 0.57±0.01 0.52±0.05 0.53±0.01 0.49±0.06 5283±578 4505±625 4992±150 4214±214非损伤 0.61±0.02 0.51±0.03 0.55±0.02 0.55±0.02 6394±173 5103±569 5722±125 5242±42损伤与否 SOD活性/%
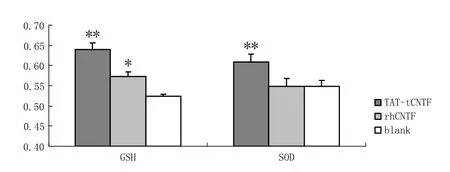
图1 TAT-tCNTF,rhCNTF对非Aβ损伤模型GSH水平和SOD酶活性的影响注:GSH水平数值为1/10 000 U·L-1;与RPMI1640培养基对照组相比, **P < 0.01,*P < 0.05Fig 1 The GSH levels and SOD activity of Aβ undamaged model treated by TAT-tCNTF and rhCNTFNote: the GSH level value is 1/10 000 U·L-1; compared with the RPMI1640 control group, ** P < 0.01, *P < 0.05
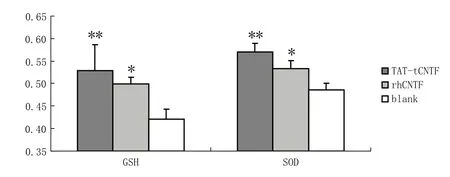
图2 TAT-tCNTF, rhCNTF对Aβ损伤模型GSH水平和SOD酶活性的影响注:GSH水平数值为1/10 000 U·L-1;与RPMI1640培养基对照组相比, **P < 0.01,*P < 0.05Fig 2 The GSH levels and SOD activity of Aβ damaged model treated by TAT-tCNTF and rhCNTFNote: the GSH level value is 1/10 000 U·L-1; compared with the RPMI1640 control group, **P < 0.01, *P < 0.05
2.1.2 方差分析结果 损伤与否和蛋白类型对SHSY5Y细胞的SOD酶活性影响均有统计学意义,由酶活性的平均值0.53(损伤模型),0.56(未损伤模型)可知,损伤模型小于未损伤模型。四种蛋白类型的SOD活性率平均值为0.59(TAT-tCNTF),0.52(TAT48-58),0.54(rhCNTF),0.52(无蛋白对照),由此可知融合蛋白TAT-tCNTF和rhCNTF可明显增高SH-SY5Y的SOD酶活性。TAT48-58与对照组相比SOD活性的差异无统计学意义。
损伤与否和蛋白类型对SH-SY5Y细胞的GSH含量影响均有统计学意义,由损伤因素平均值4749(损伤模型)小于5615(未损伤模型)可知,经Aβ损伤的SH-SY5Y细胞GSH水平明显下降。蛋白因素GSH含量平均值为5839(TAT-tCNTF),4804(TAT48-58),5357(rhCNTF),4728(无蛋白对照),可知TAT-tCNTF和rhCNTF均可增加细胞内GSH含量。各因素的统计量见表2。

表2 各因素对GSH水平和SOD活性影响方差分析统计量Tab 2 Statistics values to the variance analysis of GSH level and SOD activity affected by different factors
2.1.3 SOD活性数据方差分析两两比较结果 损伤模型加TAT-tCNTF组与损伤对照组相比P< 0.001,说明TAT-tCNTF能显著增加损伤模型的SOD酶活性;损伤模型加TAT-tCNTF组与损伤模型加rhCNTF组相比P> 0.05,说明TAT-tCNTF和rhCNTF对损伤模型SOD酶活性的影响无差异。无损伤加TAT-tCNTF组与无损伤无蛋白对照组相比P< 0.05,说明在Aβ无损伤的情况下,TAT-tCNTF也可以增加正常SH-SY5Y细胞的SOD酶活性。损伤模型加TAT48-58组与损伤模型无蛋白对照组相比P> 0.05,说明TAT对Aβ损伤模型SOD酶活性影响无统计学意义。无损伤加TAT48-58组与无损伤无蛋白对照组比较P> 0.05,说明在无损伤的情况下TAT48-58也不能改变SOD的酶活性。损伤模型加rhCNTF组与损伤模型对照组相比P< 0.05,说明rhCNTF能增加Aβ模型细胞的SOD酶活性;无损伤模型加rhCNTF组与无损伤模型组比较P> 0.05,说明rhCNTF不能显著提高正常SH-SY5Y细胞的SOD酶活性。SOD活性数据两两比较结果见表3。
2.1.4 SOD活性数据方差分析两两比较结果 损伤加TAT-tCNTF组与损伤无蛋白对照组相比P< 0.01,说明TAT-tCNTF能增加Aβ损伤模型细胞的GSH含量;无损伤加TAT-tCNTF组与无损伤无蛋白对照组相比P< 0.01,说明在无损伤的情况下TAT-tCNTF也能提高细胞内的GSH水平。而TAT48-58蛋白组无论损伤与否,与相应无蛋白组相比P均大于0.05,说明TAT48-58无明显增高细胞内GSH水平的效应。损伤模型加rhCNTF组与损伤无蛋白组相比P< 0.05,而无损伤加rhCNTF组与无损伤无蛋白对照组相比P> 0.05,说明rhCNTF在细胞无损伤的情况下不能显著提高细胞内的GSH水平。GSH含量检测水平间的两两比较结果见表4。
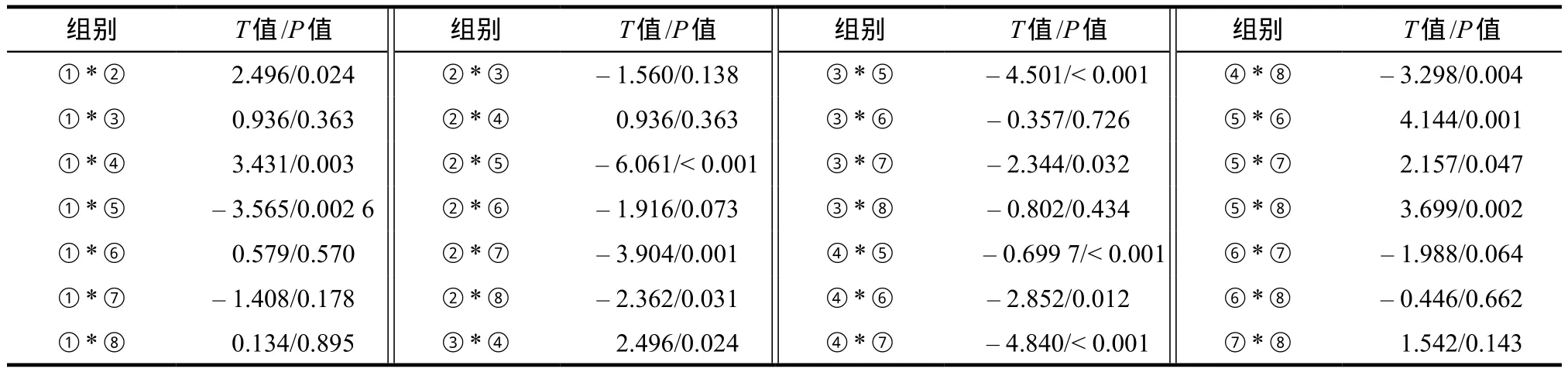
表3 不同蛋白对损伤/非损伤模型SOD水平影响实验数据结果各水平组两两比较表Tab 3 The compared results of each level to the SOD level data of damaged/undamaged model treated by different protein concentrations
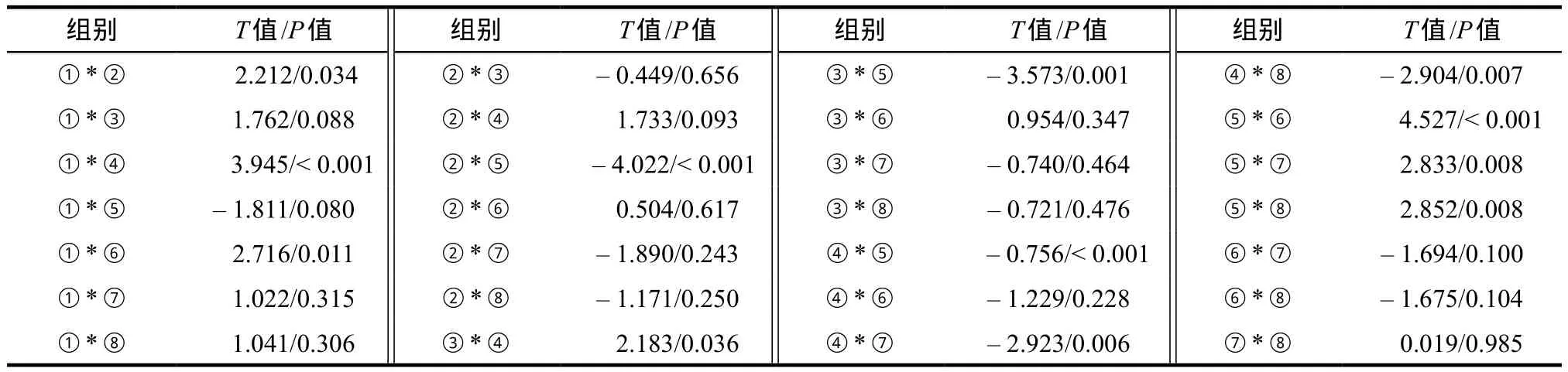
表4 不同蛋白对损伤/非损伤模型GSH水平影响实验数据结果各水平组两两比较表Tab 4 The compared results of each level to the GSH level data of damaged/undamaged model treated by different protein concentrations
表5 加入不同TAT48-58浓度对SH-SY5Y细胞的SOD活性和GSH含量影响结果.n = 5,±sTab 5 Results to the activity ratio of SOD and concentration of GSH in SH-SY5Ycells after being treated by concentrations of TAT48-58.n = 5,±s

表5 加入不同TAT48-58浓度对SH-SY5Y细胞的SOD活性和GSH含量影响结果.n = 5,±sTab 5 Results to the activity ratio of SOD and concentration of GSH in SH-SY5Ycells after being treated by concentrations of TAT48-58.n = 5,±s
TAT48-58浓度/μg·L-1 SOD活性/% GSH水平/U·L-1 0 0.548±0.015 843±43 178 0.549±0.023 929±10 356 0.507±0.065 959±121 890 0.547±0.043 981±205 1780 0.499±0.040 1145±246
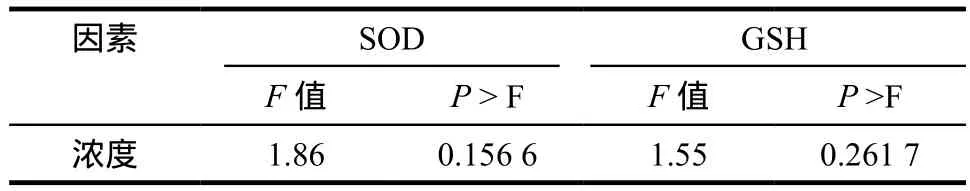
表6 不同浓度TAT48-58对SH-SY5Y细胞SOD活性和GSH水平影响的因素统计量Tab 6 Statistic values to the SOD activity and GSH level of SH-SY5Ycells treated by concentrations of TAT48-58
2.2 不同TAT48-58肽段浓度对SH-SY5Y细胞的GSH水平和SOD酶活性抑制率的影响
两指标因素P值均大于0.05,故可认为不同浓度的TAT48-58对SH-SY5Y细胞的GSH水平和SOD酶活性无影响。SOD的酶抑制率和GSH水平见表5,单因素5水平设计因素统计量见表6。
3 讨论
Aβ的聚集产生的致AD效应是目前接受最广泛的发病原因之一,大量文献显示AD的发病与氧自由基的存在和由其产生的氧化应激效应也是密不可分的[16-17],并且Aβ的聚集和氧化应激效应有着相互诱导相互促进的关系[18-19]。化合物的自由基清除能力和抗氧化应激能力也是衡量其缓解聚集态Aβ模型损伤程度和AD疾病效应的重要指示标准。GSH和SOD均是体内氧自由基有效的清除剂,GSH水平和SOD酶活性与体内氧自由基和氧化应激水平关系密切[19-22]。本实验采用聚集态的Aβ损伤SH-SY5Y细胞模型,验证与本课题组所研发的可穿膜重组TAT-tCNTF蛋白有关的几种蛋白与多肽(TAT-tCNTF、TAT48-58和rhCNTF)的抗氧化应激效应,证实了TAT-tCNTF能增加Aβ25-35损伤的SH-SY5Y细胞模型的GSH水平和SOD酶活性,从而降低细胞内的过氧化水平和增加细胞对抗氧化应激的能力,提示TAT-tCNTF能改善体外Aβ损伤细胞模型中的氧自由基和氧化应激水平。实验中发现TAT-tCNTF对非损伤模型的GSH和SOD也有促进作用,提示了TAT-tCNTF融合蛋白作为抗氧化应激效应预防用药方面的价值。
有文献证实HIV-1的TAT蛋白能增加细胞内的氧化应激水平[14-15],从而诱导细胞的损伤和凋亡。TAT-tCNTF蛋白中的TAT48-58序列是上述蛋白的一段11个氨基酸的肽段,本实验通过对其不同水平对SHSY5Y细胞的GSH水平和SOD酶活力检测,并没有发现其能够降低两者的水平,说明TAT48-58不能促进SHSY5Y细胞氧化应激的发生发展。同时也证实了与TAT连接后,CNTF发挥降低Aβ损伤模型细胞的过氧化水平不受影响,TAT-tCNTF产生的效果与rhCNTF的效果是无明显差异的。进一步说明本实验室制备的可穿膜重组融合蛋白能对AD疾病模型起到一定的调节和改善作用。但对于TAT-tCNTF的穿膜机制和对抗AD更深入的机制还有待于进一步研究。
本实验采用析因设计,避免了对照不全的统计学错误,使实验结果准确、可信。析因设计是因素各个水平的全组合设计,可分析每个因素及各因素间的交互作用对结果的影响,也可实现每两个水平的两两比较,使数据结果所得到的信息能够毫无遗漏的呈现出来,实验结果的信息能够充分利用。单因素多水平设计和析因设计方差分析的优点是能够完整的综合整个数据资料,减少了假阳性错误出现的概率。常用于两组数据比较的t检验方法与单因素多水平设计和析因设计方差分析相比较,割裂了实验设计的完整性,且在分析整个因素所引起的差异时难以给出准确的统计量和概率值。
本研究确证了TAT-tCNTF能提高Aβ损伤的SHSY5Y细胞模型的GSH水平和SOD活性的效应,并否认了来自HIV-1-TAT序列的片段TAT48-58可引起细胞内氧化应激作用,为TAT-tCNTF对抗AD的作用机制研究开拓了氧化应激方面的新思路,并为其作为预防和治疗AD疾病药物的进一步研发提供了药效学依据。
[1] Mattson MP, Guo Q, Furukawa K,et al.Presenilins, the endoplasmic reticulum, and neuronal apoptosis in Alzheimer's disease[J].J Neurochem, 1998, 70: 1-14.
[2] Sendner M, Arakawa Y, Stockli K,et al.Effect of ciliary neurotrophi factor on motonneuron survival[J].Cell Sei Suppl,1991, 15: 103-109.
[3] 石向群,陈兴洲,陆兵勋.睫状神经营养因子及受体的研究进展[J].国外医学脑血管疾病分册,1999,7(2):76-79.
[4] 曲恒燕,刘泽源,李媛媛,等.TAT-tCNTF融合蛋白对Aβ25-35诱导SH-SY5Y细胞损伤的保护作用[J].中国药理学通报,2010,26(4):442-446.
[5] 张予阳,于庆海.神经营养因子对缺血性脑损伤的影响及其药物调节[J].中国药理学通报,2003,19(3):261-264.
[6] Noguchi H, Matsumoto S.Protein transduction technology: a novel therapeutic perspective[J].Acta Med Okayama, 2006,60(1): 1-11.
[7] Qu HY, Zhang T, Li XL,et al.Transducible P11-CNTF rescues the learning and memory impairments induced by amyloid-beta peptide in mice[J].Eur J Pharmacol, 2008, 594(1-3): 93-100.
[8] Cenini G, Sultana R, Memo M,et al.Effects of oxidative and nitrosative stress in brain on p53 proapoptotic protein in amnestic mild cognitive impairment and Alzheimer disease[J].Free Radic Biol Med, 2008, 45(1): 81-85.
[9] Resende R, Moreira PI, Proenca T,et al.Brain oxidative stress in a triple-transgenic mouse model of Alzheimer disease[J].Free Radic Biol Med, 2008, 44(12): 2051-2057.
[10] Gackowski D, Rozalski R, Siomek A,et al.Oxidative stress and oxidative DNA damage is characteristic for mixed Alzheimer disease/vascular dementia[J].J Neurol Sci, 2008, 266(1-2): 57-62.
[11] PraticòD.Evidence of oxidative stress in Alzheimer' s disease brain and antioxidant therapy: lights and shadows[J].Ann N Y Acad Sci, 2008, 1147: 70-78.
[12] Tong-Lay Lau, Gehman JD, Wade JD,et al.Membrane interactions and the effect of metal ions of the amyloidogenic fragment Aβ(25-35) in comparison to Aβ(1-42)[J].Biochimica et Biophysica Acta, 2007, 1768: 2400-2408.
[13] Yankner BA, Duffy LK, Kirschner DA.Neurotrophic and neurotoxic effects of amyloid β protein: reversal by tachykinin neuropeptides[J].Science, 1990, 250(4978): 279-282.
[14] Price TO, Uras F, Banks WA,et al.A novel antioxidant N-acetylcysteine amide prevents gp120- and Tat-induced oxidative stress in brain endothelial cells[J].Exp Neurol, 2006,201(1): 193-202.
[15] Price TO, Ercal N, Nakaoke R,et al.Banks.HIV-1 viral proteins gp120 and Tat induce oxidative stress in brain endothelial cells[J].Brain Research, 2005, 1045: 57-63.
[16] Mann DM, Jones D, Snowden JS,et al.Pathological changes in the brain of a patient with familial Alzheimer's disease having a missense mutation at codon 717 in the amyloid precursor protein gene[J].Neurosci Lett, 1992, 137(2):225-228.
[17] Varadarajan S, Yatin S, Aksenova M,et al.Review: Alzheimer's amyloid β-peptide-associated free radical oxidative stress and neurotoxicity[J].J Struct Biol, 2000, 130(2-3): 184-208.
[18] 章培军,吕永利,赖红,等.氧自由基对胎鼠海马神经元ATPase和SOM的影响及人参皂甙的保护作用[J].中国医科大学学报,2000,29(3):170-171,174.
[19] 王健,许彩民,潘华珍.β淀粉样肽引起的自由基与阿尔茨海默病[J].生命的化学,2002,22(1): 50-52.
[20] Rehman A, Whiteman M, Halliwell B.Scavenging of hydroxyl radicals but not of peroxynitrite by inhibitors and substrates of nitric oxide synthases[J].Br J Pharmacol, 1997, 122(8):1702-1706.
[21] Wong BS, Brown DR, Pan T,et al.Oxidative impairment in scrapie-infected mice is associated with brain metals perturbations and altered antioxidant activities[J].J Neurochem, 2001, 79: 689-698.
[22] Takenaga M, Ohta Y, Tokura Y,et al.Lecithinized superoxide dismutase (PC-SOD) improved spinal cord injury-induced motor dysfunction through suppression of oxidative stress and enhancement of neurotrophic factor production[J].J Control Release, 2006, 110: 283-289.
