拓扑异构酶Ⅱα表达与蒽环类化疗药远期疗效
2012-08-01杜文娟秦文星王雅杰解放军总医院药材处北京00853第二军医大学长海医院肿瘤科上海00433
杜文娟,王 冬,秦文星,冯 丹,王雅杰(.解放军总医院药材处,北京 00853;.第二军医大学长海医院肿瘤科,上海00433)
拓扑异构酶Ⅱα(topoisomeraseⅡα,TopoⅡα)是包括蒽环类药物在内的多种抗肿瘤药物的潜在作用靶点[1],位于17号染色体的q12-21,与Her-2基因相邻。蒽环类药物并非对所有的乳腺癌患者均有疗效,即便初始治疗有效的患者在多次治疗后往往出现耐药[2],因此,对蒽环类药物疗效的预测指标成为乳腺癌个体化治疗的重要部分。作为蒽环类药物潜在的靶点,我们推测TopoⅡα有可能成为含蒽环类化疗的疗效预测指标。本文回顾性分析了乳腺癌患者的肿瘤组织中TopoⅡα的表达状况,讨论了含蒽环类化疗方案对晚期乳腺癌患者5年总生存率和5年无进展生存率的影响,旨在探讨乳腺癌组织中TopoⅡα的表达与乳腺癌患者远期疗效的关系。
1 资料与方法
1.1 对象
选取解放军总医院2000年1月- 2006年1月收治的200例女性晚期乳腺癌患者进行回顾性研究。患者年龄19~75岁,中位年龄47岁。患者首次就诊时,肿瘤为局部晚期或者已经发生远处转移,无法进行根治性手术切除。所有患者均行肿瘤组织切取活检并且病理诊断明确,其中,浸润性导管癌172例,浸润性小叶癌10例,髓样癌4例,黏液样癌8例,复合癌6例。治疗前经CT或者MRI检查确认有可测量、可评估的肿瘤病灶。患者既往未接受含蒽环类药物方案治疗,未行放疗;所采用的化疗方案包括:(1)CEF方案(环磷酰胺,表柔比星,5-Fu);(2)TAC方案(多西他赛,吡柔比星,环磷酰胺);(3)CAF方案(环磷酰胺,吡柔比星,5-Fu);(4)AC方案(吡柔比星,环磷酰胺);(5)CTF(环磷酰胺,多西他赛,5-Fu);(6)CMF方案(环磷酰胺,氨甲喋呤,5-Fu)。应用含蒽环药物的化疗方案中,表柔比星的剂量为90 mg·m-2,吡柔比星剂量为40~50 mg·m-2。每位患者接受化疗至少4~6周期。患者应用不同化疗方案情况见表1,P=0.219。

表 1 不同化疗方案中乳腺癌患者的Topo Ⅱα表达Tab 1 The expression of TopoⅡα in the patients receiving different chemotherapy regimens
1.2 方法
1.2.1 试剂与仪器 TopoⅡα一抗采用鼠抗人TopoⅡα单克隆抗体;TopoⅡα二抗采用二步法抗兔/鼠通用型二抗;DAB显色剂均购自北京中杉生物技术公司。
1.2.2 免疫组化方法 TopoⅡα表达采用SP免疫组化染色方法测定,所有标本均经10%甲醛固定,石蜡包埋,连续切片4 μm厚,常规用3% H2O2溶液作用10 min,微波修复抗原,依次加入一抗(抗TopoⅡα),二抗(抗TopoⅡα),DAB显色,苏木素复染后封片观察。以TBS液代替一抗作阴性对照,用已知扁桃体组织作阳性对照。
1.3 患者肿瘤标本指标
依据患者发病年龄、原发肿瘤直径、组织学分级、远处转移数等情况进行分类评估。其中,组织病理学分级法是Nottingham联合乳腺癌组织学分级法。
1.4 染色结果判定标准
TopoⅡα染色主要位于胞核内,呈清晰棕黄色或黄色弥漫性分布。由2位以上病理科医师在不知患者临床和病理资料的情况下对免疫组化染色结果进行评定,阳性细胞数≥20%为阳性,< 20%为阴性。
1.5 疗效判断
采用RECIST实体瘤疗效评价标准。测量指标:最大径总和变化;完全缓解(CR):全部病灶消失,至少维持4周,无新病灶出现;部分缓解(PR):最大径总和缩小≥30%,至少维持4周;稳定(SD):介于PR和PD之间;进展(PD):增加超过20%,或出现新病灶。统计学分析时将完全缓解和部分缓解合并为化疗有效,稳定和进展合并为化疗无效。每3个化疗周期进行疗效评估,达到PR和CR者4周时需要疗效确认。
1.6 统计学方法
研究中涉及数据应用SPSS13.0软件进行分析,以P< 0.05表示差异有统计学意义。生存率计算采用Kaplan-Meier法,两组比较采用log-rank检验。
1.7 随访资料
对200例患者进行随访,最短随访60个月,最长随访132个月,中位随访时间96个月。总生存的随访起点为进入试验开始、终点为死亡。无进展生存的随访起点为进入试验开始,终点为恶化或死亡。随访方式为家访、电话随访、信访及门诊随访。200例患者中有179例随访资料完整,21例失访,失访率为10.5%。随访截止时间为2011年2月1日。
2 结果
2.1 乳腺癌患者TopoⅡα表达情况
200例患者中采用CMF方案40例,CTF方案17例,其余采用含蒽环类药物方案143例。经过免疫组织化学法检测,200例乳腺癌患者中TopoⅡα阳性表达124例(见图1),TopoⅡα阴性表达76例(见图2)。

图1 TopoⅡα 在乳腺浸润性导管癌中的阳性表达(SPX200)Fig 1 The positive expression of TopoⅡα in breast infitrating ductal carcinoma (SPX200)
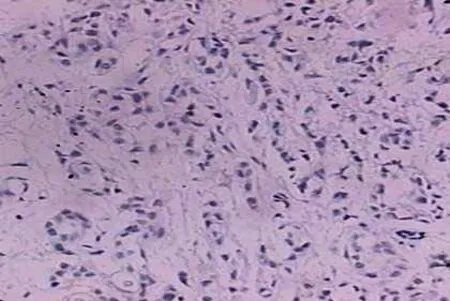
图2 TopoⅡα 在乳腺浸润性导管癌中的阴性表达(SPX200)Fig 2 The negative expression of TopoⅡα in breast infitrating ductal carcinoma (SPX200)
2.2 TopoⅡα阳性表达与接受含蒽环方案化疗生存情况相关性
用Kaplan-Meier法估计TopoⅡα阳性组患者含有蒽环方案与不含蒽环方案的5年总生存率及无进展生存率(见图3、图4)。两组比较采用log-rank检验。经log-rank检验提示:TopoⅡα阳性表达者接受蒽环方案治疗的总生存及无进展生存时间均长于未接受蒽环方案治疗的患者,且具有统计学意义(P值分别为0.011及0.002)。
2.3 TopoⅡα阴性表达与接受蒽环方案化疗生存情况相关性
用Kaplan-Meier法估计TopoⅡα阴性组患者含有蒽环方案与不含蒽环方案的5年总生存率及无进展生存率(见图5、图6)。两组比较采用log-rank检验。经log-rank检验提示:TopoⅡα阴性表达者接受蒽环方案治疗的总生存及无进展生存时间与未接受蒽环方案治疗的患者之间无统计学差异(P值分别为0.841及0.897)。
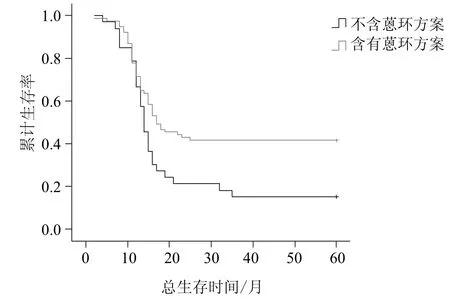
图3 TopoⅡα阳性组患者用不同化疗方案的5年总生存率Fig 3 Overall survival according to different chemotherapy regimens in the patients of TopoⅡα positive expression

图4 TopoⅡα阳性组患者用不同化疗方案的5年无进展生存率Fig 4 Progression-free survival according to different chemotherapy regimens in the patients of TopoⅡα positive expression
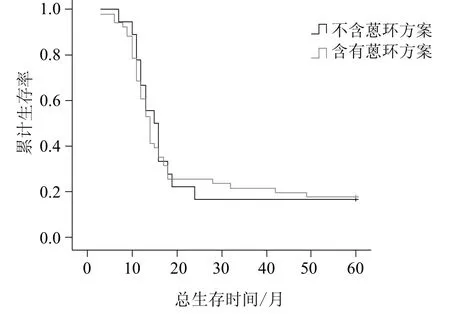
图5 TopoⅡα阴性组患者用不同化疗方案的5年总生存率Fig 5 Overall survival according to different chemotherapy regimens in the patients of TopoⅡα negative expression
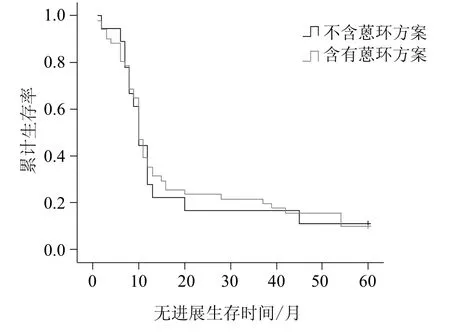
图6 TopoⅡα阴性组患者用不同化疗方案的5年无进展生存率Fig 6 Progression-free survival according to different chemotherapy regimens in the patients of TopoⅡα negative expression
3 讨论
乳腺癌的化疗目前已经进入了个体化治疗阶段,基因检测在指导化疗及预后中的作用日益明显[3]。通过基因检测来指导治疗策略,可以有的放矢,减少过度化疗及无效治疗,增加药品的经济学及社会效益。给予患者一种潜在的毒性药物总是要权衡预期的疗效和副作用,应用蒽环类治疗乳腺癌之前选择可能最大受益的个体是非常重要的。编码TopoⅡα的基因是蒽环类药物作用的主要靶点。因此,大量研究评估了TopoⅡα基因扩增能否作为预测乳腺癌对蒽环类药物化疗反应的标志物。
国内外近年来的研究表明:TopoⅡα蛋白表达或基因异常与蒽环类药物在新辅助治疗、辅助治疗及晚期姑息治疗的疗效预测有关[4]。Konecny等[5]报道高危乳腺癌患者在新辅助治疗方案中应用蒽环类药物,TopoⅡα扩增患者获得更高的病理完全缓解率。在DBCG89D临床试验中,980位绝经前、后的高危患者随机接受CEF或CMF方案化疗,收集其中773位(79%)患者肿瘤组织并用荧光原位杂交(FISH)检测TopoⅡα基因,25%的患者TopoⅡα基因异常。从无复发生存期(RFS)来看,TopoⅡα基因扩增的患者较TopoⅡα基因正常者应用蒽环类药物方案获得较好的RFS。多变量Cox回归分析表明基因扩增的肿瘤患者用CEF治疗使复发风险降低61%。TopoⅡα基因扩增的预测价值在另一个TopoⅡα临床试验BCIRG006中也被评估。3222位HER-2扩增的乳腺癌患者随机给予ACT方案(阿霉素、环磷酰胺和紫杉醇),ACTH方案(阿霉素、环磷酰胺、紫杉醇和曲妥珠单抗)或TCH方案(多西紫杉醇、卡铂和曲妥珠单抗)化疗。其中一个亚组(2120位患者)的TopoⅡα基因状态用FISH检测,结果35%的患者有TopoⅡα基因扩增,未用蒽环类药物治疗的患者(TCH)不论TopoⅡα基因状态如何,治疗效果类似。然而,应用含蒽环类药物治疗组(ACT和ACTH),TopoⅡα基因扩增患者有较长的无病生存期。根据此研究结果,我们可以得出结论:TopoⅡα基因无扩增的患者可能是非蒽环类为基础的化疗方案的理想对象,从而可以避免蒽环类药物潜在的心脏毒性。对于TopoⅡ基因缺失,有体外实验研究发现TopoⅡα基因缺失的MDA-361乳腺癌细胞系的TopoⅡα蛋白表达较对照组降低55%,对阿霉素的耐药性较对照组增加2.4倍。而在上述DBCG89D临床试验则观察到与TopoⅡα扩增有类似的趋势,但无统计学意义。
由于TopoⅡα蛋白表达在转录及翻译层面受到诸多调控,基因的表达量提高可能不会显著改变蛋白的表达。一些学者对TopoⅡα基因状态与IHC法检测TopoⅡα蛋白表达关系进行了研究,发现两者并无密切联系。Sheen-Chen SM等[6]在TopoⅡα基因扩增和TopoⅡα蛋白过表达的相互关系的研究中,发现蛋白过表达不是随着基因扩增而扩增的。之前研究多是对于TopoⅡα基因扩增的预测价值进行研究。在目前临床实践中,相对于基因检测,免疫组织化学检测蛋白表达更为普及。因此,本研究对200例晚期乳腺癌患者一线应用含蒽环类的化疗方案,分析TopoⅡα蛋白表达与患者蒽环类化疗药远期疗效相关性进行分析,包括5年总生存率和5年无进展生存率。结果发现:TopoⅡα阳性患者用蒽环方案治疗后5年总生存率和5年无进展生存率均高于未用蒽环方案的患者;TopoⅡα阴性患者用蒽环方案治疗后5年总生存率和5年无进展生存率与不用蒽环类患者差异均无统计学意义。TopoⅡα的蛋白表达为乳腺癌的治疗提供了一定的依据,TopoⅡα阳性的患者可以优先考虑含蒽环类的化疗方案[7],以提高患者的生存率,从而提高化疗疗效。
TopoⅡα基因及蛋白表达情况的复杂性给TopoⅡα治疗预测的临床研究带来了诸多困难,在解释各项研究所得出的结果时必须十分谨慎。另外,TopoⅡα表达是否和其他化疗药也有密切关系,TopoⅡα阳性患者是否对某些化疗药物耐药或者无效,TopoⅡα表达是否对靶向治疗提供一定的指导依据,仍有待于进一步研究。
[1] Qi X, Hou S, Lepp A,et al.Phosphorylation and stabilization of topoisomerase IIα protein by p38γ mitogen-activated protein kinase sensitize breast cancer cells to its poisons[J].J Biol Chem,2011, 286(41): 35883-35890.
[2] Biesaga B, Niemiec J, Ziobro M,et al.Prognostic potential of topoisomerase IIα and HER2 in a retrospective analysis of early advanced breast cancer patients treated with adjuvant anthracycline chemotherapy[J].Breast, 2011, 20(4): 338-350.
[3] Nielsen KV, Brünner N.Re: topoisomerase II alpha and responsiveness of breast cancer to adjuvant chemotherapy[J].J Natl Cancer Inst, 2011, 103(4): 352-353.
[4] Du Y, Zhou Q, Yin W,et al.The role of topoisomerase IIα in predicting sensitivity to anthracyclines in breast cancer patients: a meta-analysis of published literatures[J].Breast Cancer Res Treat,2011, 129(3): 839-848.
[5] Konecny GE, PaulettiG, Untch M,et al.Association between HER2, TOP2A, and response to anthracycline-based preoperative chemotherapy in high-risk primary breast cancer[J].Breast Cancer Res Treat, 2010, 120(2): 481-489.
[6] Sheen-Chen SM, Huang CY, Zhang H,et al.Lack of prognostic value of topoisomerase II alpha in patients with breast cancer:analysis with tissue microarray[J].Anticancer Res, 2010, 30(6):2459-2462.
[7] Glynn RW, Miller N, Whelan MC,et al.Topoisomerase 2 alpha and the case for individualized breast cancer therapy[J].Ann Surg Oncol, 2010, 17(5): 1392-1397.
