云南省烟草疫霉生理小种的初步鉴定
2012-07-31李梅云
李梅云
(云南省烟草农业科学研究院,云南 玉溪 653100)
烟草黑胫病是烟草(Nicotiana tabacumL.)生产上的毁灭性病害之一,是制约我国各烟区烟叶生产的最重要因素[1-3]。经验证明,以抗病品种为中心的综合防治,能有效控制烟草黑胫病的为害[4]。在实施综合防治计划中,应注意的重要问题之一就是烟草黑胫病菌的变异性。在烟草的生产过程中,新的高毒力菌系或新的生理小种的出现,往往使一批抗病品种“丧失”抗病性而成为感病品种,造成病害大流行。研究烟草黑胫病菌生理小种的变化和组成及其与寄主抗性间的关系,对烟草抗黑胫病育种工作极为重要。为此,笔者所在课题组于 2004—2005年从云南各主要产烟州、市分离纯化84株黑胫病菌,进行了致病性测定,2006—2008年对 55个地方代表菌株进行生理小种鉴别。
1 材料与方法
1.1 试验时间、地点
试验于2004—2008年在云南省烟草农业科学研究院研和试验基地温室与实验室进行。
1.2 试验材料
1.2.1 供试菌株与品种 所有菌株均采自云南各主要产烟地州,于2004—2005年间先后分离纯化。鉴别寄主包括 N.plumbaginifolia、N.nudicaulis、NC1071、L8,抗病对照品种K326和感病对照品种小黄金1025。
1.2.2 培养基与试剂 燕麦液体培养基用于摇床加富培养,固体培养基用于菌株活化与培养,加0.05 g/mL氯霉素用于病原的分离与纯化。
蔗糖-柠檬酸-维生素-无机盐(SCBM)液体培养基[3]:蒸馏水1000 mL、蔗糖30 g、柠檬酸20 g、氯化钙1.0 g、硝酸钾2.0 g、磷酸二氢钾0.67 g、磷酸氢二钾0.33 g、1%三氯化铁10滴、VB1 1 mg。TTC液体培养基为上述培养基中加入0.05%TTC;TTC固体培养基为燕麦琼脂培养基内加入0.05%TTC。
1%糖标准混合溶液:取果糖、葡萄糖、蔗糖各1 g,混合后75%酒精溶解定容至100 mL。苯胺-二苯胺-磷酸显色剂:1 g二苯胺溶于1 mL苯胺、5 mL 85%磷酸、50 mL丙酮组成的混合溶液中。漂白粉滤液:称取10 g漂白粉溶于140 mL水中,过滤。现配现用。
1.3 试验方法
1.3.1 致病性测定 供试菌种燕麦琼脂培养基28 ℃培养7 d。烟苗移栽前2周,挑取菌丝体接种培养液,120 r/min、28 ℃摇床培养2周,骤然降温,制成游动孢子悬浮液。调节游动孢子悬浮液浓度 108CFU/mL,备用。
供试品种漂浮育苗,待烟苗长到6~8叶期移栽到塑料花盆(Φ16 cm)中,缓苗生长10 d。
菌株孢子悬浮液灌根接种红花大金元 10叶期左右大小烟株。具体方法:在烟苗茎基部划一伤口,游动孢子悬浮液灌根接种于伤口处,脱脂棉保湿。每株15 mL,每菌株设3个重复,每重复15株,设清水对照,接种3 d后开始进行调查,按照严重度分级标准进行分级,计算发病率与病情指数[5]。
1.3.2 温室中生理小种的鉴定 从致病性测定试验中挑选出强致病力菌株、中致病力菌株、弱致病力菌株3个菌系共55个代表菌株进行生理小种鉴定。将供试菌株的游动孢子悬浮液分别接种6个供试品种烟苗。每菌株设3次重复,另设清水对照,3 d后开始进行病害分级调查,计算病情指数并根据抗性评价标准[6]进行抗性评价。结合前人烟草黑胫病菌0、1、2和3号小种的寄主反应[3,7-11]判断生理小种类型(表1)。

表1 烟草黑胫病菌0、1、2和3号小种的寄主反应Table 1 Host reaction of Phytophthora parasitica var.nicotianae race 0, 1, 2 and 3
1.3.3 生理生化鉴定 根据温室生理小种鉴定结果,从中取代表菌株 18个,包括各种抗感病反应类型,分别用三氯苯基四唑氮(TTC)法与硅胶层析法对烟草黑胫病菌菌株所属生理小种进行鉴别。
供试菌株在 TTC固体培养基平板上的颜色变化:TTC法测定的病菌在SCBM固体(pH 5.5)培养基28 ℃恒温培养,培养基分别加TTC(0.05%,w/v)和不加2种处理,定期观察菌落生长和颜色反应。每处理设3个重复,以不加TTC的燕麦琼脂培养基为对照,观察颜色反应。
硅胶G层析分析各菌株中的糖分:用于硅胶层析的菌悬液来自SCBM液体培养。取培养9 d的菌悬液准备病菌菌株层析样品时,菌悬液先用纱布过滤,去掉菌丝体,液体部分离心(700 rpm,10 min)沉淀剩余菌体,上清液作为层析样本使用。没有培养过病菌的培养基原液同样离心,上清液用作对照。用移液器吸取样品1.5 μL点样,吹干。将一端放入盛有展层溶剂的层析缸中,当展层溶剂到达距薄析顶端约1 cm处时取出薄板,60 ℃烘箱烘干,显色。标注液为 1%的蔗糖、葡萄糖和果糖混合溶液,展层剂溶液含正丁醇、冰醋酸、乙醚和水(9:6:3:1),显色剂为苯胺-二苯胺-磷酸显色剂。层析完成后计算 Rf值,公式为 Rf=h/H,其中,h为原点到色斑中心距离,H为原点到展层剂前沿的距离。
2 结 果
2.1 致病性
2004年分离的 39株烟草黑胫病菌致病率22.22%~100%,平均发病率93.73%,未接种植株没有发病。病指 2.8~25.0有 17株,占总菌株数的43.59%;病指 25.1~60.0有 10株,占 25.64%;病指60.1~100.0有12株,占30.77%。2005年分离的45个菌株致病率在 66.67%~100%,平均发病率为96.05%,未接种植株没有发病。病指16.7~25.0有7株,占15.56%;病指25.1~60.0有10株,占22.22%;病指60.1~80.0有20株,占44.44%;病指80.1~100.0有8株,占17.78%。
2.2 生理小种的初步鉴定
对照烟草黑胫病菌0、1、2和3号小种的寄主反应(表2),供试55个菌株中,第1种反应类型33个菌株可确定为0号生理小种,第2种反应类型9个菌株和第3种反应类型8个菌株对NC1071、N.nudicaulis和N.plumbaginifolia抗病,但由于L8品种的叶对0号生理小种感病,根据寄主对病菌的抗性,可以判断这17个菌株为0号或3号生理小种,究竟是0号还是3号小种可通过生理生化方法判断。剩余的5个菌株中51~54号4个菌株对L8表现抗病,说明它们不是1或3号生理小种,28#菌株对L8与NC1071表现中感,对N.nudicaulis和N.plumbaginifolia表现抗病,究竟是属于新的分化类型还是由于它们的致病力悬殊引起的,需进一步鉴定。
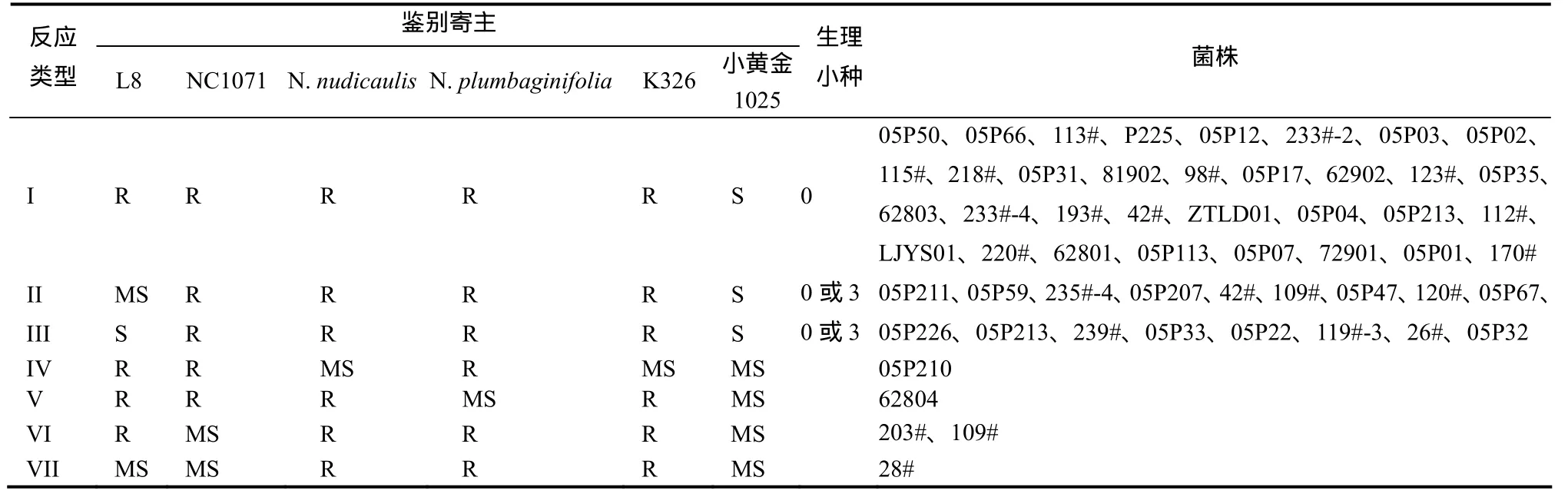
表2 各分离菌株生理小种的初步鉴定Table 2 Preliminary race indentification of Phytophthora parasitica var.nicotianae
2.3 生理生化鉴定
2.3.1 供试分离物在 TTC固体培养基平板上的颜色变化 18个菌株在TTC固体培养基中均产生变色反应(图1、表3)。各分离物在TTC固体培养基上生长时,先移入的菌块呈红色,继而伸入基质的菌丝变色,自培养皿背面观察菌落扩展呈放射状,外缘菌丝颜色稍浅,气生菌丝均为白色絮状。显微镜下观察与一般菌丝相似,无颜色变化及生长差异。生长120 h后,05P47、05P66、28#三个分离物的菌丝颜色较浅,05P22、05P33、05P35、05P59、26#、62803分离物的菌丝颜色稍浅,但这些分离物的气生菌丝都茂盛,这可能与分离物在燕麦琼脂培养基上的代谢特点有关。

图1 分离物在TTC培养基的变色反应Fig.1 Color change of Phytophthora parasitica var.nicotianae (Ppn) strains
在燕麦+TTC固体培养基上生长时,烟草黑胫病菌0号和1号小种产生脱氢酶,该酶作用于TTC产生红色脂溶性化合物(图1),另外两个小种不产生脱氢酶,用含 TTC培养基培养时不显红色[12]。根据培养基的显色反应区别烟草黑胫病菌小种时,通常观察到72 h即做出能否显色的判断。根据培养物引起“燕麦+TTC”固体培养基颜色变化的情况,18个待测菌株均显示0号和1号小种的特征。
2.3.2 硅胶 G层析分析各分离物培养滤液中的糖分 硅胶层析是鉴定烟草黑胫病菌生理小种的重要方法,通过检测病菌利用碳水化合物的代谢产物,帮助判断小种归属。硅胶层析试验通常使用标准的糖溶液,与待测样本同时进行试验,根据层析带型和用作标准的糖类在层析板上的迁移率(Rf),通过比较,确认待测样本所含糖的种类。对照表4对比各色斑颜色和Rf值大小证实A为葡萄糖、B为果糖、C及原液CK为蔗糖。D色斑的Rf值最小且与其他值有明显差异,其色斑颜色也与标准样的任何一种不相同,据John L.Mcintyre的报道应为蔗果三糖。据报道只有黑胫病菌0号和1号小种经代谢能产生蔗果三糖,3号小种不能产生。我们试图用这个方法鉴别云南菌株是0号还是1号小种,结果表明,18个待测菌株均能产生蔗果三糖,仍然只能归为0号或1号小种(图2,表4)。无论是层析带型还是Rf值的相对大小,都表明来自云南的18个菌株即符合0号小种的特征,也符合1号生理小种的特征,与TTC培养基鉴别结果一致。

表3 各分离物在TTC固体培养基随时间的颜色变化Table 3 Color change with time after incubating Ppn on TTC medium
3 讨 论

图2 各供试菌株硅胶G层析后现色结果Fig.2 Thin-layer silica gel chromatography on glass plates was used to visualize products

表4 层析板色斑Rf值比较Table 4 Rates (Rf values) of sugar flow during thin-layer silica gel chromatograph
依据鉴别寄主的反应,1~33号菌株鉴定结果为0号生理小种;34~50号菌株依据鉴别寄主的反应,为0号或3号生理小种,TTC培养基、硅胶G薄层层析的鉴定结果否定了它们为 3号生理小种的可能,说明L8表现中感或感病是因为L8叶片的特殊反应引起的,由此确定34~50号菌株为0号生理小种;51~54号4个菌株对L8表现抗病,说明它们不是1或3号生理小种,它们对NC1071、N.nudicaulis和N.plumbaginifolia中的2个鉴别寄主表现抗病,对另外1个鉴别寄主表现中度感病,也不完全符合0、2号生理小种的判断;28#菌株对L8与NC1071表现中感,对N.nudicaulis和N.plumbaginifolia表现抗病,所以不是1号生理小种,根据TTC培养基与硅胶层析鉴定结果,应为0号或1号生理小种,51~55号菌株究竟是不是0号生理小种还是属于新的分化类型,还是由于他们的致病力悬殊引起的,需要进一步深入研究。根据以上研究结果,供试55个烟草黑胫病菌中有50个菌株为0号生理小种,占供试菌系的90.91%,由此说明云南省烟草黑胫病菌优势菌为0号生理小种,在本次鉴定的供试菌株中未发现1、2、3号生理小种。
黑胫病菌0号、1号小种可以使TTC培养基变色,其基本机制是脱氢酶与TTC发生氧化还原反应生成有色物。至于TTC与脱氢酶作用的具体机制,染色深浅与TTC含量、培养基成分有无直接或间接关系尚待进一步研究。黑胫病菌能分泌水解酶,将蔗糖水解为果糖、葡萄糖而被同化,蔗果三糖由两个果糖和一个葡萄糖组成。至于该复合物究竟在生化反应过程中的哪一个步骤产生有待进一步研究。
[1]杨建卿,江彤,陈学平,等.不同香料烟品种和品系对烟草黑胫病菌的抗病性研究[J].中国烟草学报,2001,7(3):34-36.
[2]王智发,刘延荣,谢成颂,等.山东省烟草黑胫病菌生理小种初步鉴定[J].植物保护学报,1985,12(1):51-55.
[3]王智发,刘延荣,谢成颂,等.我国烟草黑胫病菌生理小种鉴定[J].山东农业大学学报,1987,18(1):1-8.
[4]张竹林.抗烟草黑胫病品种(系)试验简报[J].烟草科技,1995(1):38-39.
[5]任广伟,孔凡玉,王凤龙,等.GB/T 23222—2008 烟草病害分级及调查方法[S].北京:中国标准出版社,2008.
[6]孔凡玉,王凤龙,张成省,等.GB/T 23224—2008 烟草品种抗病性鉴定[S].北京:中国标准出版社,2008.
[7]Mcintyre J L, Taylor G S.Race 3 ofPhytophthora parasiticavar.nicotianae[J].Phytopathology, 1978,68(1): 35-38.
[8]朱贤朝,郭振业,刘保安.山东省烟草黑胫病菌中出现0号和1号小种的分化[J].中国烟草,1986(2):8-10.
[9]Mcintyre J L, Taylor G S.Screening tobacco seedling for resistance toPhytophthora parasiticavar.nicotianae[J].Phytopathology, 1976, 66: 70-73.
[10]Stokes G W, Litton C C.Source of black shank resistance in tobacco and reaction to race 0 and 1 ofphytophthora parasiticavar.nicotianae[J].Phytopathology, 1966, 56: 678-680.
[11]Wills W H, Moore L D.Response of some cultivars and lines of tobacco to stem inoculation withPhytophthora parasiticavar.nicotianae[J].Tobacco Science, 1971, 4:51-53.
[12]Mcintyre J L, Hankin L.Lack of kestose production by race 3 ofPhytophthora parasiticavar.nicotianaedifferentiates it from races 0 and 1[J].Mycologia, 1977,69: 756-760.
