糖尿病小鼠肾小球微血管密度与VEGF表达的研究*
2012-07-31田河林韦立顺许忠新康艳辉赵如同金东岭
田河林,韦立顺,许忠新,康艳辉,赵如同,金东岭
(河北工程大学医学院,河北 邯郸 056029)
糖尿病微血管病变是糖尿病常见而严重的并发症,是导致糖尿病患者生存质量下降的主要原因。新生血管的形成在糖尿病微血管病变的发生与发展过程中发挥重要作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管新生的主要促进因子[1]。微血管密度(microvessel density,MVD)是反映血管生成的生物指标,白细胞分化抗原CD34在血管内皮细胞有强阳性表达,是目前检测微血管的可靠标记[2]。VEGF在糖尿病视网膜病变中的作用研究较为广泛,VEGF在糖尿病肾病中的作用近年来日益受到关注。有关糖尿病肾小球VEGF表达与微血管密度关系的研究国内外鲜有报道。本研究采用链脲佐菌素(streptozotocin,STZ)诱导糖尿病小鼠模型,应用免疫组织化学方法观察CD34和VEGF在糖尿病小鼠肾小球的表达,探讨MVD与VEGF表达的关系,为糖尿病微血管病变的发病机制和干预措施提供依据。
材料和方法
1 动物
清洁级昆明种小鼠,雄性,30~35 g,由河北省实验动物中心提供,许可证号为SCXK(冀)2008-1-008。
2 试剂与仪器
链脲佐菌素购自Alexis;CD34单抗、VEGF单抗、SP检测试剂盒及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。血糖仪及血糖试纸购自艾康生物技术(杭州)有限公司;CX41型Olympus显微镜。
3 主要方法
3.1 糖尿病模型建立与分组 所有动物饲养于室温、12 h光/暗条件下,喂以鼠全价颗粒饲料,自由饮水,适应性饲养1周后开始实验。将小鼠禁食(不禁水)12 h,称重,尾尖取血测空腹血糖。实验前用pH 4.4柠檬酸缓冲液将链脲佐菌素配成1%溶液。造模小鼠1次性腹腔注射1%链脲佐菌素溶液(pH 4.5)150 mg/kg;对照组小鼠腹腔注射等容量柠檬酸缓冲液。72 h后测空腹血糖,空腹血糖高于16.7 mmol/L确定为造模成功糖尿病小鼠[3]。取糖尿病小鼠和正常对照小鼠各18只,分别饲养于鼠笼中,每笼6只。
3.2 标本采集与免疫组化染色 每周定时测量1次小鼠空腹体重与血糖,连续观察6周。分别于第2、4、6周从糖尿病组和对照组中随机抽取各6只小鼠,腹腔注射乌拉坦(1 g/kg)麻醉,摘取肾脏,以10%中性甲醛固定,常规脱水,石蜡包埋,连续4 μm切片,分别作HE染色和免疫组化染色。CD34及VEGF染色采用链酶亲和素-过氧化物酶(streptavidin-peroxidase,SP)法,操作步骤按SP试剂盒说明书进行。3%H2O2室温孵育,抗原热修复,常规免疫组化标记,DAB显色,苏木素复染,中性树胶封片,显微镜观察。用PBS代替Ⅰ抗作阴性对照。
3.3 结果观察与判断 取HE染色切片进行组织形态学观察,采用组织细胞病理分析软件进行计量学测定,在400倍视野下测量肾小球直径、周长和面积,每张切片取5个肾小球,取其平均值。血管内皮细胞浆呈棕黄色染色为CD34染色阳性,单个血管内皮细胞或细胞簇染色阳性判定为1个微血管;在400倍视野下取5个肾小球计数微血管数目,取其平均值作为微血管密度值。细胞浆中出现棕黄色颗粒为VEGF表达阳性,按细胞染色强度计分(a):浅黄色1分,棕黄色2分,棕褐色3分;按显色细胞百分率计分(b):≤30%细胞显色1分,31% -60%细胞显色2分,≥61%细胞显色3分;将2项得分的积作为VEGF表达指数(VEGF index),即VEGF index=a×b[4];在400倍视野下观察,每张切片取5个肾小球,取其平均值作为VEGF index值。
4 统计学处理
结 果
1 一般状况
对照组小鼠活动与精神状态良好。糖尿病组小鼠活动减少,精神萎靡;摄食、饮水及排尿量明显增多(数据略),空腹血糖明显高于对照组(P<0.01),见表1;造模后小鼠体重逐渐下降,第4、6周时体重显著低于对照组(P<0.01),见表2。
表1 对照组与糖尿病组小鼠血糖水平变化Table 1.Changes of blood glucose level in control and diabetic mice(mmol/L.n=6)

表1 对照组与糖尿病组小鼠血糖水平变化Table 1.Changes of blood glucose level in control and diabetic mice(mmol/L.n=6)
**P <0.01 vs control group.
Control 6.8 ±1.3 7.0 ±2.0 7.5 ±2.0 7.2 ±2.3 Diabetic 6.5 ±1.4 27.1 ±2.3**26.5 ±2.7**28.6 ±3.0**
表2 对照组与糖尿病组小鼠体重变化Table 2.Changes of body weight in control and diabetic mice(g..n=6)

表2 对照组与糖尿病组小鼠体重变化Table 2.Changes of body weight in control and diabetic mice(g..n=6)
**P <0.01 vs control group.
**Control 36.2 ±2.2 38.5 ±2.1 40.2 ±2.8 42.3 ±2.6 Diabetic 37.1 ±2.6 36.7 ±2.3 32.4 ±3.0**31.5 ±2.2
2 组织形态学
镜下可见,糖尿病组小鼠肾小球明显肥大,肾小球毛细血管数目增多,血管扩张,细胞外基质增多;肾髓质部分肾小管上皮细胞水肿,管腔扩张,内皮细胞数目增多,见图1。组织细胞计量学测定结果表明,糖尿病组小鼠肾小球直径、周长和面积均显著大于对照组(P<0.05,P<0.01),见表3。

Figure 1.Histomorphological changes in glomeruli of control(A)and diabetic(B)mice 6 weeks after treatment(HE staining,×400).图1 HE染色显示对照组和糖尿病组小鼠肾小球组织形态学变化
表3 对照组与糖尿病组小鼠肾小球直径、周长及面积变化Table 3.Changes of diameter,perimeter and area of glomeruli in control and diabetic mice(.n=6)

表3 对照组与糖尿病组小鼠肾小球直径、周长及面积变化Table 3.Changes of diameter,perimeter and area of glomeruli in control and diabetic mice(.n=6)
*P <0.05,**P <0.01 vs control group.
Control 48.8 ±8.3 49.0 ±8.7 50.1 ±9.1 19.1 ±3.3 19.1 ±3.1 19.0 ±4.0 20.1 ±7.2 20.1 ±6.2 20.3 ±7.2 Diabetic 56.7 ±9.2 72.3 ±8.5** 80.6 ±8.9** 23.5 ±3.5* 29.2 ±3.5** 31.2 ±3.9** 31.2 ±8.6* 50.4 ±10.2**51.1 ±11.3**
3 微血管密度与VEGF表达
与对照组相比,糖尿病组小鼠肾小球CD34染色在第2周时无明显差异,第4周和第6周CD34染色明显增强,见图2,肾小球MVD显著增大(P<0.01),见表4;糖尿病组小鼠肾小球VEGF表达在第2周时亦无明显变化,第4周和第6周VEGF表达增强,见图3,VEGF指数显著高于对照组(P<0.01),见表4。相关性分析结果表明,糖尿病小鼠MVD值与VEGF 表达指数存在显著正相关(r=0.9979,P <0.05)。
讨 论
糖尿病是危害人类生命健康的慢性代谢性疾病,实验性糖尿病动物模型的建立,不仅对研究糖尿病的病因和发病机制具有重要意义,而且为研究降糖药作用机制及筛选降糖药提供实验依据。糖尿病动物模型大体分为实验性、自发性和转基因糖尿病模型,目前国内外应用较多的是注射STZ诱导的实验性糖尿病动物模型。本实验采用一次性腹腔注射STZ法,建立糖尿病小鼠模型。成模后小鼠出现多食、多饮、多尿及体重减轻等症状,其空腹血糖明显高于16.7 mmol/L,且高血糖状态持续至第6周而不下降,与文献报道成模症状相符[5]。
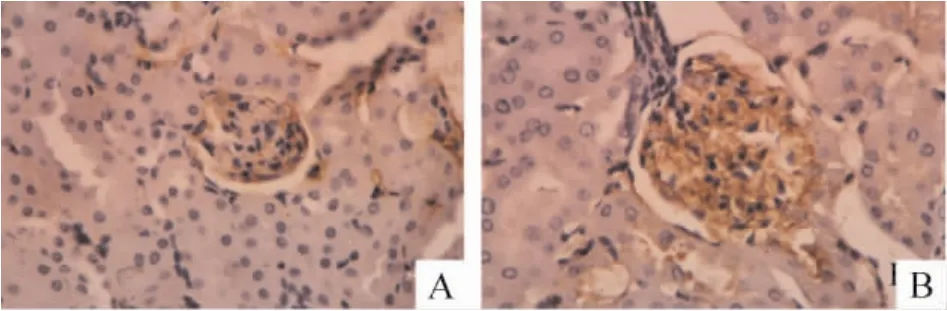
Figure 2.Immunohistochemistry showed CD34 expression in glomeruli of control(A)and diabetic(B)mice 6 weeks after treatment(SP staining,×400).图2 免疫组化染色显示CD34在对照组和糖尿病组小鼠肾小球的表达

Figure 3.Immunohistochemistry showed VEGF expression in glomeruli of control(A)and diabetic(B)mice 6 weeks after treatment(SP stainning,×400).图3 免疫组化染色显示VEGF在对照组和糖尿病组小鼠肾小球的表达
表4 对照组与糖尿病组小鼠肾小球微血管密度及VEGF表达Table 4.Changes of MVD and VEGF expression of glomeruli in control and diabetic mice(.n=6)

表4 对照组与糖尿病组小鼠肾小球微血管密度及VEGF表达Table 4.Changes of MVD and VEGF expression of glomeruli in control and diabetic mice(.n=6)
**P <0.01 vs control group.
VEGF index 2 weeks 4 weeks 6 weeks 2 weeks 4 weeks 6 weeks Control 14.1 ±2.2 14.6 ±2.9 15.2 ±2.6 2.4 ±1.2 2 Group MVD.4 ±1.1 2.5 ±1.3 Diabetic 16.3 ±2.7 21.7 ±2.4** 25.3 ±2.5** 3.6 ±1.4 6.1 ±1.5** 8.2 ±1.6**
组织形态学观察发现,糖尿病小鼠肾小球明显肥大,肾小球直径、周长及面积显著大于对照组小鼠;并出现细胞外基质增多,肾小管上皮细胞水肿、管腔扩张等现象。高糖一直被认为是导致糖尿病肾脏形态及功能异常的主要原因,其机制之一是糖基化终产物的大量形成和聚积,引起肾小球多种细胞增生,导致肾小球肥大、细胞外基质增多和肾小球硬化;高糖还可能通过增加多元醇途径活性、增加组织氧化应激过程或减少细胞外基质降解等多种途径造成组织损害[6-7]。
免疫组化染色显示,糖尿病小鼠肾小球CD34表达明显增强,第4周后其微血管密度显著高于正常对照组;同时,糖尿病小鼠肾小球VEGF表达显著高于正常对照组。目前认为,多种细胞因子参与了糖尿病微血管病变的发生与发展过程,其中VEGF与糖尿病肾脏病变有密切联系。VEGF是一种内皮细胞特异性丝裂原,广泛分布于人和动物肝、肾、眼等多种组织,以旁分泌形式作用于内皮细胞相应受体,可刺激内皮细胞的增殖与分化,参与生理性和病理性新生血管形成,并增加微血管的通透性[8-9]。在糖尿病状态下,高糖、糖基化终末产物、转化生长因子β等多种因素均可促使VEGF的合成与分泌,VEGF表达的上调导致内皮细胞功能障碍和血管病变[10]。
VEGF在糖尿病视网膜病变中的作用已经明确,眼内VEGF水平高低与新生血管形成及视网膜病变严重程度密切相关。本研究结果发现,糖尿病小鼠肾小球新生血管生成增多,微血管密度增大,且与肾小球VEGF表达呈显著正相关。在STZ诱导的糖尿病大鼠模型中发现,VEGF在糖尿病早期(第3周)肾小球的表达即显著增高[11]。临床资料显示,早期糖尿病患者肾小球上皮细胞VEGF表达上升;糖尿病患者血中VEGF水平较健康对照组和无微血管并发症患者明显增高[12]。显然,VEGF表达上调与糖尿病肾脏微血管病变密切相关[13]。研究表明,高糖可诱导大鼠肾系膜细胞、牛视网膜细胞和人血管平滑肌细胞VEGF表达上调,其机制可能是通过蛋白激酶C(protein kinase C,PKC)依赖途径实现的,PKC抑制剂和VEGF抗体则可改善糖尿病肾脏病变[14-15]。
综上所述,STZ诱导糖尿病小鼠肾小球明显扩张,肾小球微血管密度显著增加,且与肾小球VEGF表达呈显著正相关,提示糖尿病肾脏病变与VEGF表达上调密切相关,抗VEGF治疗可能成为糖尿病肾微血管病变新的防治措施。
[1]Cox CM,D'Agostino SL,Miller MK,et al.Apelin,the ligand for the endothelial G-protein-coupled receptor,APJ,is a potent angiogenic factor required for normal vascular development of the frog embryo[J].Dev Biol,2006,296(1):177-189.
[2]Acevedo LM,Londono I,Oubaha M,et al.Glomerular CD34 expression in short- and long- term diabetes[J].J Histochem Cytochem,2008,56(6):605-614.
[3]刁雪红,申 锷,张跃力,等.抑制Rac1通过降低磷酸化p38 MAPK提高1型糖尿病小鼠的心脏功能[J].中国病理生理杂志,2010,26(7):1285-1289.
[4]Pareek G,Shevchuk M,Armenakas NA,et al.The effect of finasteride on the expression of vascular endothelial growth factor and microvessel density:a possible mechanism for decreased prostatic bleeding in treated patients[J].J Urol,2003,169(1):20 -23.
[5]Jensen LJ,Denner L,Schrijvers BF,et al.Renal effects of a neutralising RAGE-antibody in long-term streptozotocin - diabetic mice[J].J Endocrinol,2006,188(3):493-501.
[6]谭正怀,沈映君.高血糖与糖尿病肾病[J].中国临床药理学与治疗学,2002,7(6):565 -569.
[7]陶凯忠.高血糖与糖尿病血管病变及机制[J].中国糖尿病杂志,2001,9(5):306-308.
[8]Bortoloso E,Del Prete D,Dalla Vestra1 M,et al.Quantitave and qualitative changes in vascular endothelial growth factor gene expression in glomeruli of patients with type 2 diabetes[J].Eur J Endocrinol,2004,150(6):799 -807.
[9]De Vriese AS,Tilton RG,Stephan CC,et al.Vascular endothelial growth factor is essential for hyperglycemiainduced structural and functional alterations of the peritoneal membrane[J].J Am Soc Nephrol,2001,12(8):1734-1741.
[10]Tsuchida K,Makita Z,Yamagishi S,et al.Suppression of transforming growth factor beta and vascular endothelial growth factor in diabetic nephropathy in rats by a novel advanced glycation end product inhibitor,OPB - 9195[J].Diabetologia,1999,42(5):579 -588.
[11]Cooper ME,Vranes D,Youssef S,et al.Increased renal expression of vascular endothelial growth factor(VEGF)and its receptor VEGFR - 2 in experimental diabetes[J].Diabetes,1999,48(11):2229 -2239.
[12]Chiarelli F,Spagnoli A,Basciani F,et al.Vascular endothelial growth factor(VEGF)in children,adolescents and young adults with type 1 diabetes mellitus:relation to glycaemic control and microvascular complications[J].Diabet Med,2000,17(9):650-656.
[13]周 智,杨曦明,李艳君,等.血浆血管内皮生长因子及血管紧张素Ⅱ与糖尿病肾病的关系[J].中国病理生理杂志,2002,18(5):550-552.
[14]Cha DR,Kim NH,Yoon JW,et al.Role of vascular endothelial growth factor in diabetic nephropathy[J].Kidney Int,2000,77:S104 - S112.
[15]De Vriese AS,Tilton RG,Elger M,et al.Antibodies against vascular endothelial growth factor improve early renal dysfunction in experimental diabetes[J].J Am Soc Nephrol,2001,12(5):993 -1000.
