高盐高脂摄入致大鼠主动脉重构及辛伐他汀的阻断作用*
2012-07-31尹明景温汉春叶永维管庆林黄皓章黄露霜朱继金
尹明景,温汉春,叶永维,管庆林,黄皓章,黄露霜,朱继金△
(广西医科大学第一附属医院1急诊科,2心血管病研究所,广西 南宁 530021)
大量临床与动物实验资料表明高血压、高血脂是人类动脉粥样硬化(atherosclerosis,AS)的最主要危险因素,高钠盐高脂肪饮食则是被证明是最重要的导致血管粥样硬化的环境因素[1-2]。CD40系统的相互作用作为炎症信号的重要转导通路,在动脉粥样硬化的发生、发展、变化的过程中发挥重要作用[3-4]。他汀类药物被证明有稳定AS的斑块等多重效应作用而广泛使用于治疗高胆固醇血症和冠心病[5-6]。本研究通过利用高盐和高脂肪摄入模拟导致动脉硬化的最重要的环境因素,观察动脉血压、血脂、血清可溶性 CD40配体(soluble CD40 ligand,sCD40L)浓度、动脉组织CD40/CD40L表达强度以及血管构型参数变化情况和他汀类药物对这一过程的影响,以探讨动脉粥样硬化及他汀类药物的治疗效果和机制。
材料和方法
1 试剂与主要设备
1.1 主要试剂 胆酸钠片购于上海实业联合集团长城药业有限公司;胆固醇购于天津光夏精细化工研究所;维生素D3注射液购于浙江仙据制药股份有限公司;辛伐他汀片购于江苏黄河药业股份有限公司;苏木素购于福州迈新生物科技开发有限公司;油红O购于上海锐聪科技发展有限公司;大鼠sCD40L ELISA试剂盒购于上海玉博生物科技有限公司;兔抗大鼠CD40L单克隆抗体购自上海玉博生物科技公司;羊抗兔辣根过氧化物酶标记Ⅱ抗购自上海玉博生物科技公司。
1.2 主要设备 鼠尾血压计测量系统(北京奥尔森特科技有限公司);病理组织切片机(Leitz,1512型);Olympus Vanox显微镜照相系统(Optical Co.Ltd);图像分析仪(Leica,DMR+0550型);贝克曼全自动生化仪与血液生化指标检测(贝克曼库尔特公司,广西医科大学一附院临床检验中心完成);酶标仪(伯乐牌全自动酶标仪,由广西医科大学动物实验中心提供)。
2 动物模型的建立
2.1 动物分组与饲养 雄性SD成年大鼠60只,体重200~250 g,清洁级,由广西医科大学实验动物中心提供。动物标准饲料喂养2周后按随机分组法分为5组(n=12):正常对照组(normal,N组)、高脂摄入组(high fat group,F 组)、高盐组(high salt group,S组)、高盐高脂组(SF组)和高盐高脂加辛伐他汀组(T组)。大鼠同置于相对恒温(25℃)、恒湿(75%)房间,饮水、饲料不限,继续喂养16周。饲料配方:N组:标准饲料,每100 g含食盐0.4%;F组:标准饲料添加10%蛋黄粉、0.3%胆酸、5%猪油、1.2%胆固醇,在3 d内腹腔注射7×105IU/kg的总剂量的维生素D3;S组:在标准饲料中加入4%的食用盐;SF组:高脂配方中添加4%食用盐;T组:高盐与高脂饲料配方中加入辛伐他汀2 mg/kg。所有饲料由广西医科大学实验动物中心配制和提供。
2.2 血压测量 动物饲养16周后,使用北京奥尔森特科技有限公司无创鼠尾血压计测量系统,记录每只大鼠鼠尾动脉血压(收缩压),每只测4~6次,取平均值。
2.3 组织取材与数据的测量
检测血压后,10%的水合氯醛腹腔注射麻醉,开腹后从下腔静脉穿刺取血,离心分离血清,置于-20℃保存,用于检测总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)及sCD40L浓度。
剖开大鼠胸腔与腹腔,完整切取动脉瓣上主动脉起始部至髂动脉分叉处的主动脉,长度约3 cm左右。先取主动脉瓣上血管以10 μm厚度连续石蜡切片,取切片进行免疫组化染色、油红O染色和常规苏木精-伊红染色。免疫组化染色图片利用病理图文分析系统进行形态参数和吸光度测量,显示染色强度和含量,将结果按强阳性、弱阳性和阴性进行分级。油红O染色显示动脉组织脂肪浸润情况;HE染色将动脉内膜、中膜与外膜显色清楚。将动脉环的切片置于显微镜下,放大倍数为40倍使之包括完整的动脉环并将图像用摄影镜头传输到微机显示屏上,鼠标描出动脉环的内腔和外环(不包括外膜外的结缔组织)的完整轮廓,用Leica分析软件平面法,计算出血管内腔面积和血管横断面积,并由此计算两者的比值和中膜的厚度。
3 统计学处理
结 果
1 实验动物的情况
动物喂养期间,共喂养60只大鼠,存活55只,高盐高脂组死亡3只,死于肺部感染;单纯高脂组死亡1只,辛伐他汀干预组死亡1只,经检查未发现明显病因。
2 各组大鼠干预后血压与体重的变化
F组和SF大鼠体重明显增加(P<0.01),而S组和T组与N组无明显差异。S组与F组血压均超过正常水平(P<0.01),SF组血压增高更明显(与F组或S组比,P<0.01)。T组较 SF组血压有所下降,但未能降至正常水平,与单一因素干预组无明显差异,见表1。
3 各组大鼠血脂的变化
SF组TC和TG较其它组明显升高(P<0.01);F组TC和TG较N组亦明显升高(P<0.01);而S组TG未见明显改变;N组与T组之间无明显差异,见表2。
表1 各组大鼠收缩压和体重Table 1.Systolic blood pressure(SBP)and body weight(BW)of rats in each group()

表1 各组大鼠收缩压和体重Table 1.Systolic blood pressure(SBP)and body weight(BW)of rats in each group()
△△P <0.01 vs N group;##P <0.01 vs SF group.N:control;S:high salt;F:high fat;SF:high salt+high fat;T:high salt+high fat+simvastatin.
344.5 ±27.6 N 12 128.0 ±13.2 354.8 ±39.2 S 12 156.4 ±18.0△△## 361.1 ±25.6 F 10 148.9 ±27.3△△## 390.9 ±35.6△△SF 10 170.5 ±14.8△△ 412.3 ±45.6△△T 11 154.4 ±13.1△△
表2 各组大鼠血脂Table 2.Serum lipids in rats(mmol/L.)
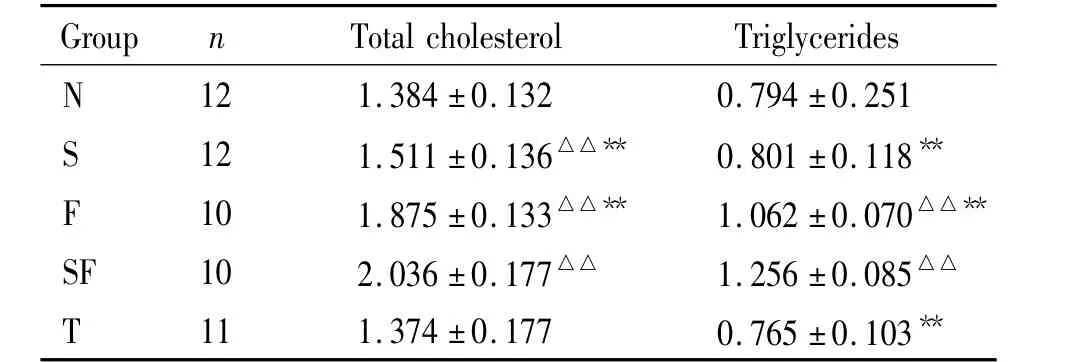
表2 各组大鼠血脂Table 2.Serum lipids in rats(mmol/L.)
△△P <0.01 vs N group;**P <0.01 vs SF group.
Total cholesterol Triglycerides Group n
4 各组大鼠血清sCD40L浓度
S组、F组和SF组血清sCD40L浓度高于N组和T组(P<0.05);SF组血清sCD40L浓度高于S组和F组(P<0.05);S组与F组间差异无显著(P>0.05);而N组与T组间差异亦无显著(P>0.05),见表3。
表3 各组大鼠血清sCD40L浓度Table 3.The serum concentration of sCD40L(ng/L.)
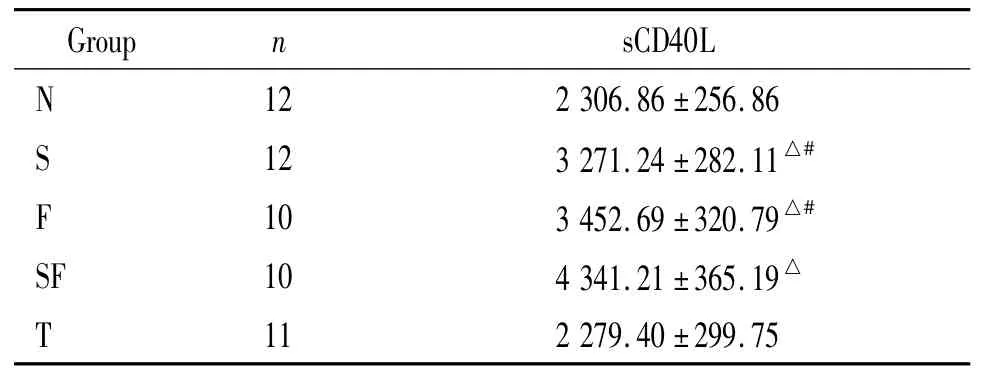
表3 各组大鼠血清sCD40L浓度Table 3.The serum concentration of sCD40L(ng/L.)
△P <0.05 vs N group;#P <0.05 vs SF group.
N 12 2306.86 ±256.86 S 12 3271.24 ±282.11△#F 10 3452.69 ±320.79△#SF 10 4341.21 ±365.19△11 2279.40 ±299.75 T
5 动脉组织CD40/CD40L表达
免疫组化染色结果显示,N组和T组无明显着色,胞核清晰;S组和F组呈弱阳性,蓝褐色较淡;SF组染色明显加深,呈暗蓝褐色,见图1。
采用Kruskal-Wallis秩和检验对各组的阳性率进行比较,结果显示升主动脉起始段动脉组织CD40/CD40L表达强度:S组、F组和SF组高于N组和T组(P<0.05),且SF组高于S组和F组(P<0.05),S组与F组、N组与T组间无明显差异(P>0.05),见表 4。
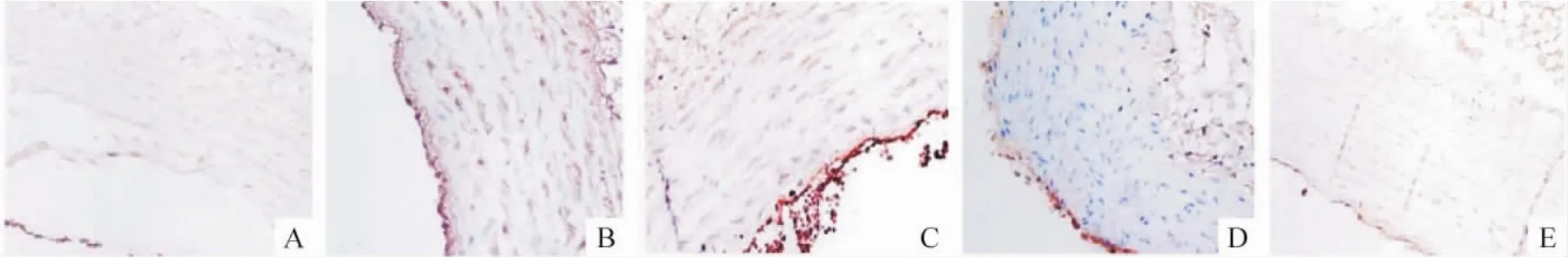
Figure 1.Immunohistochemical staining of CD40/CD40L(×100).A:control group;B:high salt group;C:high fat group;D:high fat+high salt group;E:high salt+high fat+simvastatin group.图1 各组免疫组化染色结果
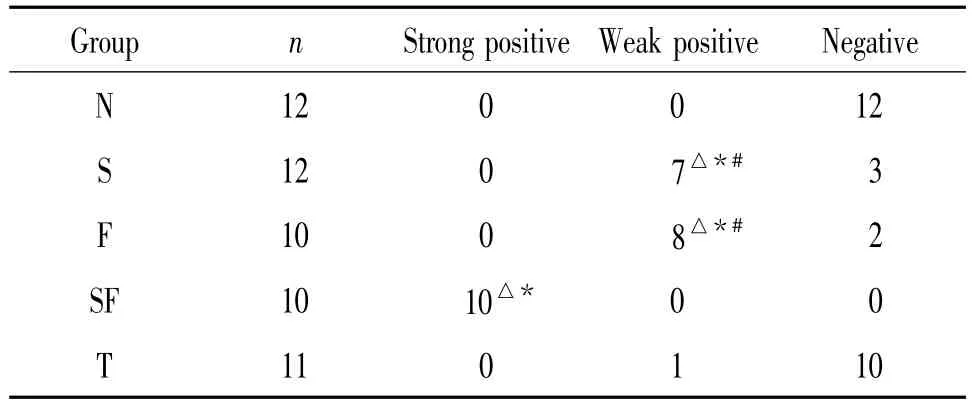
表4 各组大鼠动脉组织CD40/CD40L表达强度Table 4.CD40/CD40L expression in arterial tissues
6 各组大鼠动脉构型的变化
各组大鼠动脉构型的变化与N组相比,S组动脉中膜明显增厚,但血管内膜完整,管壁厚度均匀一致,血管内腔面积和血管横断面积均增加;高脂组摄入也存在类似改变,但管壁厚薄不均,有明显斑块形成,形态不规则,苏木素-油红O染色在高倍镜下为紫红色中膜层见桔红色的脂肪浸润,血管内腔明显变窄;SF组的这种改变更为明显,且使血管内腔面积与血管横断面积的比值明显缩小;而辛伐他汀治疗组未见明显动脉粥样硬化斑块和脂肪浸润,仅表现为中膜增厚,见表 5、图 2、3。
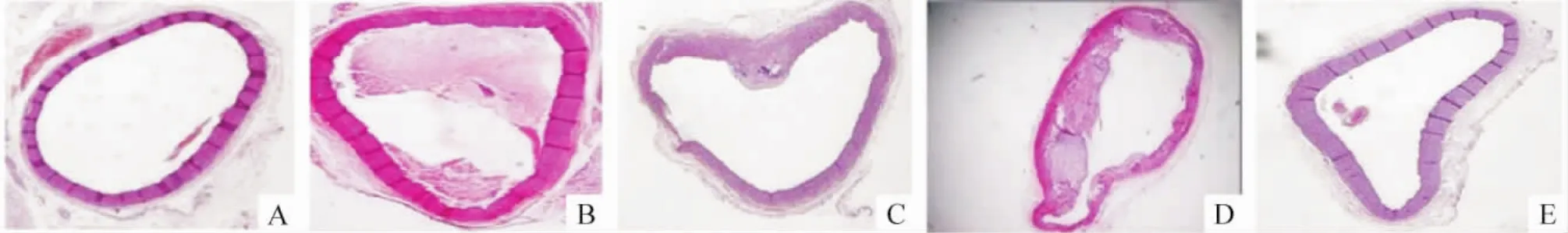
Figure 2.Configurational changes of aorta(HE staining,×40).A:control group;B:high salt group;C:high fat group;D:high fat+high salt group;E:high salt+high fat+simvastatin group.图2 各组大鼠动脉构型变化
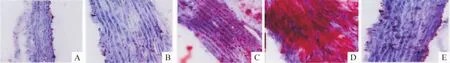
Figure 3.Configurational changes of aorta(oil red O staining,×100).A:control group;B:high salt group;C:high fat group;D:high fat+high salt group;E:simvastatin group.图3 各组大鼠动脉构型变化
表5 各组大鼠血管构型数值变化表Table 5.Vessel configuration values in each group()
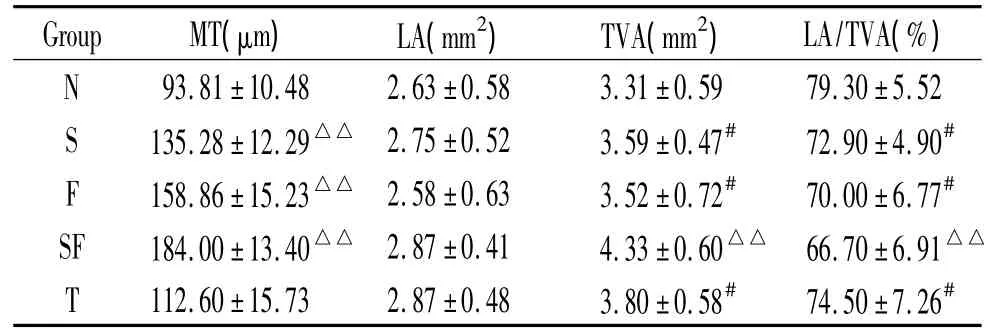
表5 各组大鼠血管构型数值变化表Table 5.Vessel configuration values in each group()
△△P <0.01 vs N group;#P <0.05 vs N group.MT:medium thickness;LA:lumen area;TVA:total vascular area.
Group MT(μm) LA(mm2) TVA(mm2) LA/TVA(%)N 93.81 ±10.48 2.63±0.58 3.31±0.59 79.30 ±5.52 S 135.28±12.29△△ 2.75±0.52 3.59±0.47# 72.90±4.90#F 158.86±15.23△△ 2.58±0.63 3.52±0.72# 70.00±6.77#SF 184.00±13.40△△ 2.87±0.41 4.33±0.60△△ 66.70±6.91△△T 112.60 ±15.73 2.87±0.48 3.80±0.58# 74.50 ±7.26#
讨 论
本研究通过高脂和高钠盐摄入干预普通SD大鼠16周后,高盐组或高脂组的大鼠血压明显高于正常组,动脉结构发生明显增厚甚至粥样硬化等病理变化,这种异常现象在高钠盐与高脂肪复合喂养组大鼠比任何单一因素喂养显著,而且血脂增高与血压呈正相关,提示高脂可能有加重高盐饮食所致大鼠动脉血压效应,两种因素在诱发血管病变方面可能有协同作用。
本实验发现高盐喂养大鼠发生动脉中膜增厚明显但均匀一致、血管内膜完整,血管和管腔面积均增加,血管横断面积和血管内腔面积均有明显的增大,但由于在中膜增厚的情况下,血管内腔面积/血管横断面积比例较正常变小,存在着所谓外向型重构现象,但未出现典型的动脉粥样硬化斑块,提示血管壁平滑肌增生导致中膜增厚和功能异常改变可能是高钠盐诱发高血压关键环节。另一方面,本研究中发现高脂饮食亦诱发大鼠血压升高,但其主动脉构型变化与高盐摄入组不同,动脉中膜明显增厚但很不均匀且出现典型的动脉粥样斑块,油红O染色发现其动脉管壁存在典型脂肪浸润,其血管内腔面积/血管横断面积比减少更明显,同时发现高盐高脂复合干预的大鼠,其动脉中膜厚度明显高于正常组与任何单一因素干预组,动脉粥样硬化改变也更加显著,提示高盐与高脂喂养导致的血管构型改变更加严重。根据上述研究表明,高盐高脂复合饮食较任何单一因素均能明显改变动脉构型,高盐饮食对动脉粥样硬化过程存在明显强化作用。
流行病学证实长期高盐饮食与一些人群动脉血压升高有一定关系,其机制可能是由于钠潴留使细胞外液容量增加,因此心排血量增加;血管平滑肌细胞内钠水平增高又导致细胞内钠离子浓度升高,并使血管收缩反应增强,因此外周血管阻力升高;高盐摄入甚至可以损害血管内皮功能和肾脏功能,这些均可促进高血压的形成[7-8]。而高血压又是AS重要的危险因素,过高的血管壁压力通过机械和化学双重刺激损伤内皮细胞,加上血流对血管壁的冲击会损害血管内膜,内皮的功能受到损伤后,血液中的脂质更加容易沉积在血管壁,促进动脉粥样硬化的发生和发展,促进血管中膜平滑肌层向内膜迁移,后者合成胶原和细胞外基质并发生自身增殖,同时分泌并激活多种细胞因子吸引循环中的单核细胞黏附聚集,迁入内膜下转化为巨噬细胞 ,后者与SMCs在内膜下吞噬脂质形成泡沫细胞,加速斑块的形成和内膜与中膜的增厚[9-10]。高脂肪摄入可以导致血脂增高、损伤动脉内膜,导致动脉硬化与血管重构,目前公认的机制之一是高胆固醇中富集的氧化修饰LDL(oxLDL)在动脉内膜受损情况下进入内膜下中层,吸附血液中的单核细胞迁入动脉内膜并转变为泡沫细胞[11-12]。在合并高血压情况下,二者互相促进,明显加剧动脉粥样硬化的形成。而发生了动脉粥样硬化的血管正常舒张功能减弱,血管壁的僵硬度增加,血压又会升高,二者之间互为因果,形成恶性循环。
本实验还通过辛伐他汀药物干预高盐高脂复合喂养的大鼠,其动脉中膜较正常组轻度增厚,但差异无统计学意义。其血管内腔面积/血管横断面积比较正常组也无明显改变,表明他汀类药物在逆转动脉斑块与改善血管重构的明显作用。大量实验研究和大规模临床试验也显示他汀类药物不仅具有调脂作用,还具有很多独立于其调脂作用的效果,即他汀类药物的多效性,如改善血管内皮功能、抑制炎症及抗氧化反应、抗血小板聚集和抑制血栓形成、稳定粥样硬化斑块、抑制心肌重塑及心肌细胞凋亡、抑制心脏电生理重塑及调节心脏植物神经功能等一系列降脂外作用[13-15]。
研究证实动脉粥样硬化是一种有免疫系统参与的慢性炎症,CD40和CD40配体系统作为重要的炎症信号通路是动脉粥样硬化的关键环节,与斑块的发生、发展密切相关[16]。本实验通过观察血清sCD40L表达水平的变化,作为观察炎症的指标。发现高盐组、高脂组、高盐高脂组血清sCD40L表达水平较正常组和治疗组明显升高,高盐高脂组sCD40L表达水平较高盐组和高脂组又明显升高,辛伐他汀治疗组与正常组间无明显差异,免疫组化检测各组大鼠升主动脉起始段动脉组织CD40/CD40L表达强度的差异亦与血清sCD40L表达水平差异类似。表明他汀类药物可通过抑制CD40/CD40L途径来保护动脉组织。随着他汀类药物作用机制的逐渐明朗和越来越多的循证医学支持,他汀类药物的应用前景将更加广泛。
以上研究表明,在较短时间予高盐高脂饮食可以诱导大鼠血压升高、血脂异常与动脉粥样硬化形成,建立类似代谢异常所致的高血压与动脉粥样硬化模型,他汀类药物不但具有降脂作用,对大鼠主动脉重构有明显抑制作用,提示他汀类药物在防治动脉粥样硬化和治疗代谢综合征方面有重要的作用。
[1]Appel LJ,Frohlich ED,Hall JE,et al.The importance of population-wide sodium reduction as a means to prevent cardiovascular disease and stroke:a call to action from the American Heart Association[J].Circulation,2011,123(10):1138-1143.
[2]Sniderman AD,Williams K,Contois JH,et al.A metaanalysis of low -density lipoprotein cholesterol,non-high- density lipoprotein cholesterol,and apolipoprotein B as markers of cardiovascular risk[J].Circ Cardiovasc Qual Outcomes,2011,4(3):337-345.
[3]程 军,李金平,田 卓,等.南蛇藤素对ApoE基因敲除小鼠主动脉粥样硬化斑块内CD40配体表达、巨噬细胞和平滑肌细胞数量的影响[J].中国病理生理杂志,2009,25(3):601-603.
[4]彭朝权,李翠芝,邹丽媛.可溶性CD40L在评价冠状动脉粥样硬化斑块易损伤中的意义[J].中国病理生理杂志,2008,24(10):1948-1952.
[5]Expert pannel on Detection,Evaluation and Treatment of High Blood cholesterol in Adults.Executive Summary of the Third Report of the National Cholesterol Education Program(NCEP)Expert Panel on Detection,Evaluation,and Treatment of High Blood Cholesterol in Adults(Adult Treatment Panel III)[J].JAMA,2001,285(19):2486-2497.
[6]Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease:the Scandinavian Simvastatin Survival Study(4S)[J].Lancet,1994,344(8934):1383-1389.
[7]Blaustein MP,Zhang J,Chen L,et al.How does salt retention raise blood pressure?[J].Am J Physiol Regul Integr Comp Physiol,2006,290(3):R514 - R523.
[8]Liu Z.Dietary sodium and the incidence of hypertension in the Chinese population:a review of nationwide surveys[J].Am J Hypertens,2009,22(9):929 -933.
[9]Ferrario CM,Smith R,Levy P,et al.The hypertensionlipid connection:insights into the relation between angiotensin II and cholesterol in atherogenesis[J].Am J Med Sci,2002,323(1):17 -24.
[10]Rosendorff C,Black HR,Cannon CP,et al.Treatment of hypertension in the prevention and management of ischemic heart disease:a scientific statement from the American Heart Association Council for High Blood Pressure Research and the Councils on Clinical Cardiology and Epidemiology and Prevention [J].Circulation,2007,115(21):2761-2788.
[11]Tsimikas S,Brilakis ES,Miller ER,et al.Oxidized phospholipids,Lp(a)lipoprotein,and coronary artery disease[J].N Engl J Med,2005,353(1):46-57.
[12]Kathiresan S.Lp(a)lipoprotein redux-from curious molecule to causal risk factor[J].N Engl J Med,2009,361(26):2573-2574.
[13]Moreno PR,Purushothaman KR,Sirol M,et al.Neovascularization in human atherosclerosis[J].Circulation,2006,113(18):2245-2252.
[14]Murphy SA,Cannon CP,Wiviott SD,et al.Reduction in recurrent cardiovascular events with intensive lipid-lowering statin therapy compared with moderate lipid-lowering statin therapy after acute coronary syndromes from the PROVE IT-TIMI 22(Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction 22)trial[J].J Am Coll Cardiol,2009,54(25):2358-2362.
[15]LaRosa JC,Grundy SM,Waters DD,et al.Intensive lipid lowering with atorvastatin in patients with stable coronary disease[J].N Engl J Med,2005,352(14):1425-1435.
[16]严金川,吴宗贵,仲人前,等.CD40-CD40L共同表达于人内皮细胞及人动脉粥样斑块中[J].中国病理生理杂志,2002,19(8):1021-1024.
