甘氨酸对高果糖饮食诱导的大鼠胰岛素抵抗及认知功能损害的影响*
2012-07-31吴惠文韩德五许瑞龄赵元昌
吴惠文,韩德五,许瑞龄,周 鑫,王 锋,赵元昌
(山西医科大学肝病研究所,基础医学院病理生理教研室,山西 太原 030001)
过多果糖(fructose,Fru)摄入引起肥胖、高血压、血脂代谢异常、2 型糖尿病等代谢性疾病[1-3]。胰岛素抵抗(insulin resistance,IR)作为诸多代谢性疾病发病的“共同土壤”,与认知功能损害或阿尔茨海默病(Alzheimer disease,AD)关系密切[4-5]。甚至有学者提出AD本身就是“脑的胰岛素抵抗状态”或“3型糖尿病”的观点[6]。脂多糖(lipopolysaccharides,LPS)是体内触发免疫反应、调节炎症级联反应最重要的因素,可参与多种代谢性疾病的发生、发展[7]。我室长期致力于研究肠源性内毒素血症(intestinal endotoxemia,IETM)在疾病损伤中的作用,并发现甘氨酸(glycine,Gly)可减轻多种肝损伤导致的IETM[8-9]。为此,我们拟观测甘氨酸是否可通过减轻IETM改善高果糖饮食诱导的IR和认知功能损害。
材料和方法
1 材料
1.1 主要试剂 血糖、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和总胆固醇(total cholesterol,TC)试剂盒购自中生北控公司;胰岛素、TNF-α、IL-6 ELISA试剂盒购自R&D;LPS试剂盒购自厦门鲎试剂实验厂;游离脂肪酸(free fatty acids,FFA)试剂盒购自南京建成公司;胰岛素受体β亚单位(insulin receptor β subunit,IRβ)、磷脂酰肌醇3- 激酶 α 亚单位(phosphatidylinositol 3 - kinase α subunit,PI3Kα)抗体购自 Cell Signaling Technology;磷酸化的IRβTyr1162/1163和 PI3KαTyr508抗体购自 Santa Cruz。
1.2 动物 清洁级雄性SD大鼠32只,体重230~240 g,购自山西医科大学动物中心。
2 动物分组及处理
大鼠随机分为4组,每组8只;对照组(control),饮用自来水;果糖模型组(Fru组),饮用含8% 果糖的自来水;干预组(Fru+Gly组),饮用含8%果糖+1% 甘氨酸的自来水;甘氨酸组(Gly组),饮用含1% 甘氨酸的自来水。大鼠自由饮水、进食(标准大鼠饲料),每月测量体重及收缩压。8个月末,在结束口服糖耐量试验及认知功能测试后,12 h禁食,1%戊巴比妥钠腹腔麻醉,腹主动脉取血并分离血浆,迅速分离大脑皮层,-80℃冷冻保存。
3 检测指标和方法
3.1 血浆指标检测 按试剂盒说明书分别测定血浆葡萄糖、TG、HDL - C、TC、FFA、胰岛素、LPS。计算胰岛素抵抗指数(homeostasis model assessment of IR,HOMA-IR),公式为:空腹血糖 (mmol/L)×空腹胰岛素 (103EU/L)/22.5。
3.2 口服糖耐量试验 12 h禁食,以50%的葡萄糖溶液灌胃(1.5 g/kg),分别于灌胃前(0 min)、灌胃后(15 min、30 min、120 min)尾静脉采血,采用血糖仪(罗氏活力型)检测血糖。
3.3 促炎因子检测 血浆及脑组织(10%脑皮层匀浆)TNF-α和IL-6的检测采用ELISA试剂盒并按照说明书操作进行。
3.4 Western blotting检测 IRβ、PI3Kα 及其磷酸化蛋白表达 取冻存皮层组织,分别置于玻璃匀浆器中加入1 mL组织裂解液在冰浴中反复研磨,裂解30 min,4℃ 12000 r/min离心20 min,取上清液 BCA法定量,调整各上样量 40 μL/well,7.5%SDS 聚丙乙烯酰胺凝电泳,4℃ PVDF转膜过夜,5%(W/V)脱脂奶粉室温封闭3 h,分别与目的抗体(IRβ和PI3Kα 抗体,1∶1000 稀释;磷酸化蛋白抗体,1∶750稀释)4℃杂交过夜,洗涤后,加入辣根过氧化酶标记的Ⅱ抗,室温孵育2 h,洗涤、曝光、显影,采用Quantity One(Bio-Rad Laboratories)对胶片进行灰度分析。
3.5 Morris水迷宫测试认知功能 Morris水迷宫系统由水迷宫装置、图像采集处理系统(Ethovision 3.0)组成。测试用的圆形水池直径150 cm,高30 cm,由内部涂抹成黑色油漆的不锈钢材料制作而成。水池内水的高度30 cm,水温保持在24~26℃。黑色的逃避平台直径14 cm,低于水面1.5 cm并放置于水池其中一个象限的中央。摄像机位于水池上方,记录大鼠游泳轨迹与时间。Morris水迷宫实验由3部分组成。其中,平台逃避实验连续持续5 d,每天上午、下午各进行2次。每次实验将大鼠面对池壁放入水池任何一象限中央,让其自由游泳寻找平台。当大鼠爬上平台时,让其在平台停留20 s,再进行下次实验。如果在120 s内,大鼠没有找到平台,则用手指引大鼠爬上平台,仍然让其在平台上停留20 s。实验中,大鼠到达平台的时间即为逃避潜伏期(escape latency)。空间探索实验在平台逃避实验结束后第6 d进行。实验前,移去水池内平台,用相同方法置大鼠与水池中,120 s内让大鼠自由游泳寻找平台,以测试大鼠空间记忆效果,主要记录大鼠在水池内不同象限游泳所花费的时间与距离。最后,实验主要测试大鼠游泳速度及视力水平。实验前,平台仍被放置到水池原先位置并高于水面1.5 cm,重复平台逃避实验3次,主要记录逃避潜伏期与游泳速度。
4 统计学处理
结 果
1 大鼠一般状况
实验期间,所有大鼠状况良好。模型组大鼠体重增长在第3~6月明显高于对照组(P<0.05,P<0.01),甘氨酸在第4月、第6月显著降低模型组体重增长(P<0.05),见图1A。模型组与对照组比较,第3月后收缩压明显升高(P <0.05,P <0.01),甘氨酸在第4~6月显著降低模型组收缩压的升高(P<0.05,P <0.01),见图1B。
2 血糖、血脂代谢变化
与对照组比较,模型组血糖、TG、TC、HDL-C和FFA水平显著升高(P<0.01);干预组与模型组比较,血糖、TG及 FFA 显著降低(P <0.05,P <0.01),但TC和HDL-C变化无显著差异,见表1。
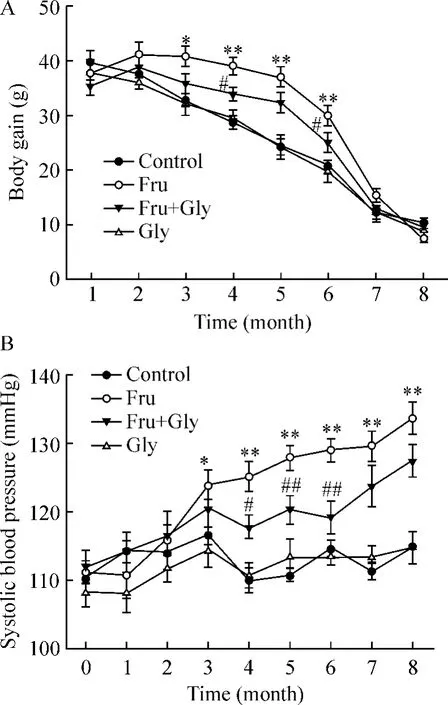
Figure 1.Effects of glycine(Gly)on monthly body weight gain and systolic blood pressure in high-fructose(Fru)diet rats.E.n=8.*P<0.05,**P<0.01 vs control group;#P <0.05,##P <0.01 vs Fru group.图1 甘氨酸对高果糖饮食大鼠每月体重增长与收缩压变化的影响
表1 甘氨酸对高果糖饮食大鼠血糖及血脂的影响Table 1.Effects of glycine on plasma glucose and lipid profiles in high-fructose diet rats(mmol/L.E.n=8)
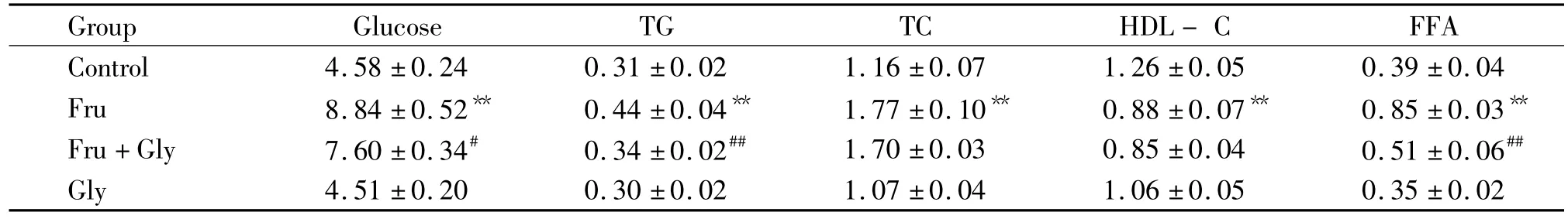
表1 甘氨酸对高果糖饮食大鼠血糖及血脂的影响Table 1.Effects of glycine on plasma glucose and lipid profiles in high-fructose diet rats(mmol/L.E.n=8)
**P <0.01 vs control group;#P <0.05,##P <0.01 vs Fru group.
Group Glucose TG TC HDL-C FFA Control 4.58 ±0.24 0.31 ±0.02 1.16 ±0.07 1.26 ±0.05 0.39 ±0.04 Fru 8.84 ±0.52** 0.44 ±0.04** 1.77 ±0.10** 0.88 ±0.07** 0.85 ±0.03**Fru+Gly 7.60 ±0.34# 0.34 ±0.02## 1.70 ±0.03 0.85 ±0.04 0.51 ±0.06##Gly 4.51 ±0.20 0.30 ±0.02 1.07 ±0.04 1.06 ±0.050.35 ±0.02
3 糖耐量实验结果
甘氨酸组各时点血糖与对照组比较,没有显著差异;模型组各时点血糖显著高于对照组(P<0.01);与模型组比较,干预组各时点血糖显著降低(P<0.05,P <0.01),见图2。
4 血浆胰岛素、LPS与HOMA-IR变化
模型组血浆胰岛素、LPS及HOMA-IR显著高于对照组(P<0.01);干预组上述指标显著低于模型组(P <0.01),见表2。
5 血浆LPS与HOMA-IR及FFA的相关性
血浆 LPS与 HOMA -IR(rs=0.75,P <0.01)及FFA(rs=0.62,P <0.01)呈显著正相关。
6 血浆及脑组织TNF-α、IL-6变化
模型组血浆及脑组织TNF-α、IL-6水平明显高于对照组(P<0.01);干预组与模型组比较,上述指标明显降低(P <0.01,P <0.05),见表3。
7 Western bloting结果
模型组皮层IRβ表达与对照组相比大约升高了2倍(P <0.01),但 p-IRβTyr1162/1163/IRβ 及 p-PI3KαTyr508/PI3Kα比值则显著降低(P<0.01);甘氨酸显著降低模型组IRβ的表达(P<0.05),显著提高2种蛋白表达的比值(P<0.01);对照组与甘氨酸组蛋白表达无显著差异,见图3A、B。
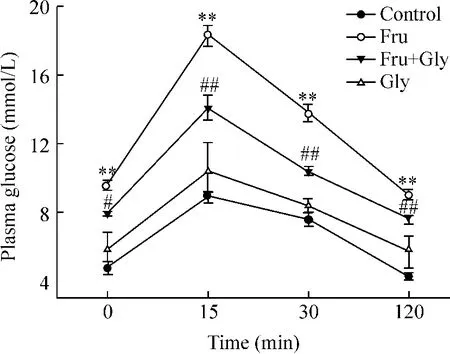
Figure 2.Effects of glycine on oral glucose tolerance test in high-fructose diet rats.E.n=8.**P<0.01 vs control group;#P <0.05,##P <0.01 vs Fru group.图2 甘氨酸对高果糖饮食大鼠口服糖耐量试验的影响
表2 甘氨酸对高果糖饮食大鼠血浆胰岛素、LPS及HOMA-IR的影响Table 2.Effects of glycine on plasma insulin,LPS and HOMA -IR in high-fructose diet rats(E.n=8)
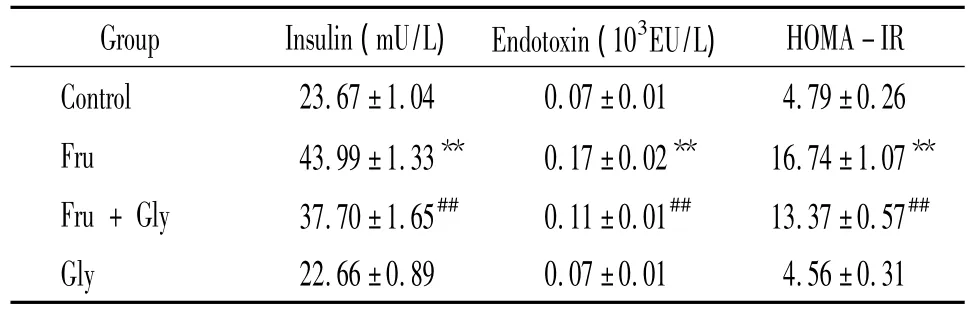
表2 甘氨酸对高果糖饮食大鼠血浆胰岛素、LPS及HOMA-IR的影响Table 2.Effects of glycine on plasma insulin,LPS and HOMA -IR in high-fructose diet rats(E.n=8)
**P <0.01 vs control group;##P <0.01 vs Fru group.
Group Insulin(mU/L) Endotoxin(103EU/L)HOMA-IR Control 23.67±1.04 0.07±0.01 4.79±0.26 Fru 43.99±1.33** 0.17±0.02** 16.74±1.07**Fru+Gly 37.70±1.65## 0.11±0.01## 13.37±0.57##Gly 22.66±0.89 0.07±0.01 4.56±0.31
表3 甘氨酸对高果糖饮食大鼠血浆及脑组织促炎因子的影响Table 3.Effects of glycine on pro-inflammatory cytokines in plasma and brain tissues in high-fructose diet rats(E.n=8)
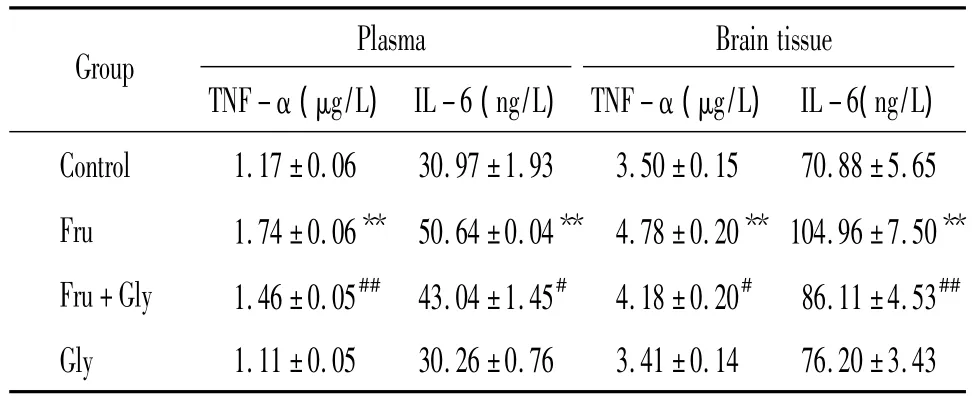
表3 甘氨酸对高果糖饮食大鼠血浆及脑组织促炎因子的影响Table 3.Effects of glycine on pro-inflammatory cytokines in plasma and brain tissues in high-fructose diet rats(E.n=8)
**P < 0.01 vs control group;#P < 0.05,##P < 0.01 vs Fru group.
Plasma Brain tissue TNF-α(μg/L)IL-6(ng/L)TNF-α (μg/L) IL-6(ng/L)Control 1.17±0.06 30.97±1.93 3.50±0.15 70.8 Group 438±5.65 Fru 1.74±0.06** 50.64±0.04** 4.78±0.20** 104.96±7.50**Fru+Gly 1.46±0.05## 43.04±1.45# 4.18±0.20# 86.11±4.53##Gly 1.11±0.05 30.26±0.76 3.41±0.14 76.20±3.
8 Morris水迷宫结果
随着测试天数的增加,大鼠平均逃避潜伏期从93.49 s下降到 26.95 s。在测试的第 1 d,4 组大鼠平均逃避潜伏期没有统计学差异;从第2 d起,模型组平均逃避潜伏期明显长于对照组(P<0.01);干预组与模型组比较,第4 d、5 d平均逃避潜伏期明显缩短(P<0.05);对照组和甘氨酸组平均逃避潜伏期无统计学差异,见图4A、B。空间探索实验结果显示,模型组在目标象限所占时间与总时间的百分比显著低于对照组(P<0.01);干预组与模型组比较,该百分比显著升高(P<0.05);对照组和甘氨酸组无显著差异,见图4C。测试大鼠游泳速度及视力实验结果表明,各组大鼠游泳速度(约14.5 cm/s)和可见平台逃避潜伏期(约14.2 s)无显著差异。
讨 论
食物中普遍添加蔗糖及果糖,是现代社会饮食的一个特点。大量研究表明,果糖过多摄入可引起肥胖、高血压、2 型糖尿病等代谢性疾病[1-3]。IR 作为代谢综合征(metabolic syndrome,MS)发病的共同病理机制参与了多种代谢性疾病的发生。本实验通过长期(8个月)高果糖饮食喂养诱导大鼠发生与人类相似的MS,如肥胖、高血压、血脂代谢紊乱、糖耐量异常、HOMA-IR升高等。果糖吸收后,经门脉进入肝脏,其代谢可绕过糖酵解限速酶-磷酸果糖激酶的调控,在果糖激酶作用下迅速转为1-磷酸果糖,后者经糖酵解或糖异生途径进一步转化为葡萄糖、糖原及TG。故高果糖饮食可引起肝脏TG聚集和FFA生成增加,引起肝脏对胰岛素敏感性下降和高胰岛素血症形成。
近年来研究表明,MS往往伴有全身轻度炎症反应,提示这种慢性亚临床炎症可能参与MS发病[10]。LPS是促发炎症级联反应最重要的因子,其结合Toll样受体4(Toll-like receptor 4,TLR4)受体通过IKK/NF-кB通路可导致促炎因子释放。多种肝损伤模型均伴有IETM,其通过启动炎症机制参与多种肝病的发生、发展[8-9,11]。Cani等[7]研究也证实,高脂饮食伴有的代谢性内毒素血症可启动大鼠发生肥胖及糖尿病。而敲除了TLR4基因可有效保护NF-κB介导的炎症和IR[12]。甘氨酸是机体一种非必需氨基酸,可降低多种肝损伤所伴的IETM[8-9]。本实验结果显示,长期高果糖饮食诱导大鼠发生MS时伴有IETM、轻度炎症及IR;甘氨酸能减轻模型组IETM、炎症及IR,并改善MS(如肥胖、高血压、血脂异常等)。本实验大鼠血浆LPS水平与IR高度相关提示,IETM可能是果糖饮食致外周IR发生的重要因素。LPS引起外周IR可能涉及的机制有:(1)LPS与TLR4受体结合通过IKK/NF-κB通路,释放大量的促炎因子(TNF-α、IL-6等)引起胰岛素受体底物酪氨酸磷酸化,诱发IR。(2)LPS可直接刺激脂肪分解为FFA,其通过TLR4受体介导,引起脂肪细胞、巨噬细胞及肝脏枯否细胞释放促炎因子,促发胰岛素信号转导异常,引起IR[12-13]。本实验结果也显示,模型组大鼠血浆FFA水平显著升高,并且与血浆LPS水平正相关。(3)LPS还可通过激活巨噬细胞产生活性氧自由基参与IR的发生[14]。
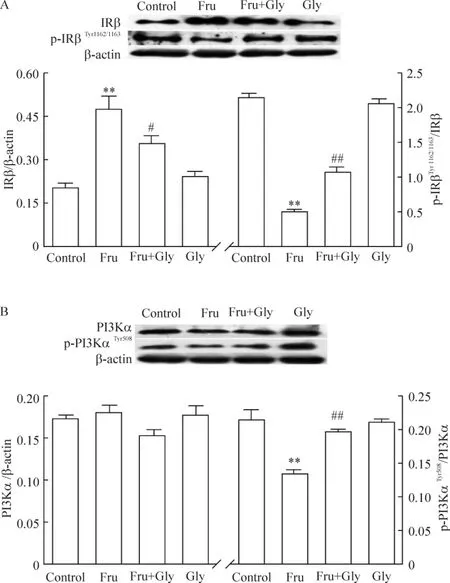
Figure 3.Effects of glycine on the expression of IRβ,p-IRβTyr1162/1163,PI3K α and p-PI3KαTyr508in the cerebral cortex in highfructose diet rats.A:relative densitometric values of IRβ/β-actin(left panel)and p-IRβTyr1162/1163/IRβ (right panel);B:relative densitometric values of PI3Kα/β-actin(left panel)and p-PI3KαTyr508/PI3Kα(right panel).E.n=8.**P <0.01 vs control group;#P <0.05,##P <0.01 vs Fru group.图3 甘氨酸对高果糖饮食大鼠大脑皮层IRβ、p-IRβTyr1162/1163、PI3Kα及p-PI3KαTyr508蛋白表达的影响

Figure 4.Effects of glycine on the results of Morris water maze test in high-fructose diet rats.A:the results of the escape latency test in different groups;B:original swimming traces of the rats in different groups in the hidden platform acquisition on the 4th day;C:the percentage of time spent in the target quadrant in different groups.E.n=8.**P<0.01 vs control group;#P<0.05 vs Fru group.图4 甘氨酸对高果糖饮食大鼠Morris水迷宫实验的影响
越来越多研究资料表明,MS与认知功能损害或者 AD 关系密切[4-5]。Yaffe 等[4]对 2632 名 MS 患者调查结果表明,MS是认知功能下降的高危险因素。近年来研究认为,胰岛素信号转导在调节脑内糖代谢中发挥重要作用,进而对神经发育和学习、记忆产生影响[15]。Ho 等[16]发现,高脂饮食可诱导小鼠发生中枢IR,其与学习、记忆功能损害密切相关。本研究显示,长期高果糖饮食既引起大鼠发生MS,也引起认知功能发生损害。尽管MS与认知功能损害之间的机制尚未完全阐明,但普遍认为IR发挥着重要作用。IRβ和PI3K是胰岛素信号转导关键蛋白,其功能减弱是形成IR的重要分子基础。本研究发现,长期高果糖饮食不仅诱导大鼠发生外周IR和炎症反应,同时中枢也出现明显的 IR(p-IRβTyr1162/1163/IRβ 和 p -PI3KαTyr508/PI3Kα 比值降低)和炎症反应;甘氨酸通过降低IETM可改善模型组中枢IR、炎症和认知功能。以上结果提示,中枢IR及炎症在模型组大鼠认知功能障碍发生中可能起关键作用。模型组大鼠发生中枢IR或认知功能损害可能的原因有:(1)外周炎症因子通过活化脑血管内皮细胞进入脑内,可引起中枢炎症反应,进而影响认知功能[17]。本实验也发现,甘氨酸通过降低IETM可显著降低外周与中枢的促炎因子水平。(2)慢性高胰岛素血症通过下调血脑屏障胰岛素受体,减少胰岛素转运进入脑,也可促进中枢 IR的发生[18]。(3)外周少量LPS在其受体介导下可进入脑,进而激活小胶质细胞释放促炎因子,促进中枢 IR的发生[19-20]。在实验中我们还发现,甘氨酸对高果糖饮食诱导的早期血压升高具有改善作用(待发表)。
综上所述,在长期高果糖饮食诱导大鼠发生外周及中枢IR中IETM发挥着重要作用。甘氨酸通过降低IETM可减轻外周与中枢炎症和IR,进而改善高果糖饮食诱导的MS和认知功能障碍。
[1]Basciano H,Federico L,Adeli K.Fructose,insulin resistance,and metabolic dyslipidemia[J].Nutr Metab(Lond),2005,2(1):5.
[2]Schulze MB,Manson JE,Ludwig DS,et al.Sugar -sweetened beverages,weight gain,and incidence of type 2 diabetes in young and middle- aged women[J].JAMA,2004,292(8):927-934.
[3]Bray GA,Nielsen SJ,Popkin BM.Consumption of highfructose corn syrup in beverages may play a role in the epidemic of obesity[J].Am J Clin Nutr,2004,79(4):537-543.
[4]Yaffe K,Blackwell T,Kanaya AM,et al.Diabetes,impaired fasting glucose,and development of cognitive impairment in older women[J].Neurology,2004,63(4):658-663.
[5]Arvanitakis Z,Wilson RS,Bienias JL,et al.Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function[J].Arch Neurol,2004,61(5):661 -666.
[6]Steen E,Terry BM,Rivera EJ,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease-is this type 3 diabetes?[J].J Alzheimers Dis,2005,7(1):63 -80.
[7]Cani PD,Amar J,Iglesias MA,et al.Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes,2007,56(7):1761-1772.
[8]张 巍,员克明,韩德五.甘氨酸防治大鼠肠源性内毒素血症机制研究[J].山西医科大学学报,2003,34(2):97-98.
[9]李 夏,韩德五,赵龙凤.甘氨酸对非乙醇性脂肪性肝病大鼠肝组织PPARα表达的影响[J].中国病理生理杂志,2006,22(9):1829-1832.
[10]Haffner SM.Risk constellations in patients with the metabolic syndrome:epidemiology,diagnosis,and treatment patterns[J].Am J Med,2006,119(1):3 -9.
[11]Han DW.Intestinal endotoxemia as a pathogenetic mechanism in liver failure[J].World J Gastroenterol,2002,8(6):961-965.
[12]Shi H,Kokoeva MV,Inouye K,et al.TLR4 links innate immunity and fatty acid - induced insulin resistance[J].J Clin Invest,2006,116(11):3015 -3025.
[13]Zu L,He J,Jiang H,et al.Bacterial endotoxin stimulates adipose lipolysis via Toll-like receptor 4 and extracellular signal- regulated kinase pathway[J].J Biol Chem,2009,284(9):5915-5926.
[14]李兰芳,郭 玉,唐国涛,等.高脂饮食导致大鼠肝脏胰岛素抵抗的作用机制[J].中国病理生理杂志,2011,27(2):310-314.
[15]Gerozissis K.Brain insulin,energy and glucose homeostasis;genes,environment and metabolic pathologies[J].Eur J Pharmacol,2008,585(1):38 -49.
[16]Ho L,Qin W,Pompl PN,et al.Diet-induced insulin resistance promotes amyloidosis in a transgenic mouse model of Alzheimer's disease[J].FASEB J,2004,18(7):902-904.
[17]Konsman JP,Parnet P,Dantzer R.Cytokine-induced sickness behaviour:mechanisms and implications[J].Trends Neurosci,2002,25(3):154 -159.
[18]Wallum BJ,Taborsky GJ,Porte D,et al.Cerebrospinal fluid insulin levels increase during intravenous insulin infusions in man[J].J Clin Endocrinol Metab,1987,64(1):190-194.
[19]Banks WA,Robinson SM.Minimal penetration of lipopolysaccharide across the murine blood - brain barrier[J].Brain Behav Immun,2010,24(1):102-109.
[20]Kim WG,Mohney RP,Wilson B,et al.Regional difference in susceptibility to lipopolysaccharide-induced neurotoxicity in the rat brain:role of microglia[J].J Neurosci,2000,20(16):6309 -6316.
