黑曲霉苹果酸酶基因的敲除及其功能研究
2012-07-28尹升明耿红冉
尹升明,耿红冉,周 闯,刘 浩
(1.天津科技大学生物工程学院 工业发酵微生物教育部重点实验室,天津 300457;2.中国生物技术发展中心,北京 100039)
黑曲霉在生物技术产业中有着重要的应用价值,不仅广泛应用于食品、药物和工业酶制剂的生产,同时也是表达外源蛋白的细胞工厂[1]。黑曲霉基因组测序已完成,大约包括3400万个碱基,为基础和应用性研究提供了极大的便利,但黑曲霉大部分基因功能仍是未知的[2],因此对黑曲霉的研究不能仅依赖于生物信息学,更需要采用分子生物学手段对其基因功能进行研究[3]。
苹果酸酶(Malic enzyme,ME)广泛存在于自然界中[4~6],是调控苹果酸代谢的关键酶,可以催化苹果酸氧化脱羧的可逆反应以及伴随NAD(P)+的还原反应。线粒体中的NAD-ME催化丙酮酸脱羧,在TCA循环中起重要作用[7]。采用分子生物学探讨ME基因在黑曲霉中的功能将为研究苹果酸代谢及其辅酶再生奠定基础[8]。
作者在此利用农杆菌(Agrobacteriumtumefaciens)介导的转化方法转化黑曲霉,通过同源重组敲除黑曲霉ME基因,筛选ME基因敲除菌株,对其进行发酵实验来研究ME基因在TCA循环中的作用,并对ME基因敲除菌株的生长、发育和代谢进行了深入研究。
1 实验
1.1 材料
1.1.1 菌株与质粒
黑曲霉野生型菌株,编号ATCC1015,由中科院天津工业微生物研究所孙际滨实验室提供;农杆菌AGL1、大肠杆菌(E.coli)DH5α、质粒p44(由pCAMBIA1300改造而来),均自行保存。
1.1.2 培养基
LB培养基(g·L-1):蛋白胨 10,酵母浸出物 5,NaCl 10。固体培养基加琼脂 20 g·L-1[9]。
马铃薯葡萄糖培养基(PDA):称取去皮马铃薯200 g,切成小块,加1000 mL水煮沸30 min,用双层纱布滤成清液,加水至1000 mL,然后加入20 g葡萄糖完全溶解,pH值自然。固体培养基加琼脂20 g[10]。
诱导培养基(IM)及真菌完全培养基(CM)参照文献[11]配制。
发酵培养基(g·L-1):葡萄糖50,NH4NO32.5,KH2PO42.0,MgSO4·7H2O 1.0,NaCl 1.0,CaCl20.1,酵母浸出物 0.5,FeSO4·7H2O 0.0005,ZnSO4·7H2O 0.0005,CuSO4·5H2O 0.00025[9]。
1.1.3 酶与试剂
限制性内切酶HindⅢ、PstⅠ、BamHⅠ、KpnⅠ、T4DNA ligase、Taq DNA Polymerase,Fermentas公司;KOD FX,东洋纺(上海)生物科技有限公司;PCR产物纯化及胶回收试剂盒,北京索莱宝科技有限公司;胰蛋白胨、酵母提取物,OXOID公司;其它试剂均为国产色谱纯。
1.1.4 引物
本实验所用黑曲霉菌株为A.nigerATCC1015,其基因组测序工作已于2006年完成,并在http://genome.jgi-psf.org/公布,本实验所涉及到的与ME基因相关序列均通过该网站获得。采用的引物见表1。

表1 PCR引物
注:上述引物由北京六合华大基因科技股份有限公司合成
1.2 方法
1.2.1ME基因敲除质粒p44-ME::hyg的构建
首先以A.nigerATCC1015的基因组为模板,利用引物ME-upf/ME-upr、ME-downf/ME-downr进行PCR扩增,分别得到ME基因的5′端片段及3′端片段。PCR扩增条件:95 ℃预变性2 min;95 ℃变性40 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min。然后将5′端片段与p44质粒分别酶切(BamHⅠ/KpnⅠ)后连接得到p44-ME1,将3′端片段与p44-ME1用HindⅢ/PstⅠ酶切后连接得到p44-ME::hyg。最后将p44-ME::hyg分别用BamHI/KpnⅠ与HindⅢ/PstⅠ酶切验证。
1.2.2 农杆菌介导T-DNA转化
将构建好的质粒p44-ME::hyg转入农杆菌AGL1[12],在诱导培养基上活化至OD=0.8后,取100 μL该菌液与等量的黑曲霉孢子(1×107个·mL-1)滴加在0.45 μm醋酸纤维素膜上,然后将膜贴在诱导培养基(含200 μmol·L-1AS和100 μg·mL-1Kanamycin)上,30 ℃培养48~72 h。
1.2.3ME基因敲除菌株的筛选鉴定
将共培养物转移至筛选培养基(CM+200 μmol·L-1Cefotaxine+200 μg·mL-1Hygromycin)上,30 ℃培养4~5 d,得到黑曲霉转化子。然后在PDA液体培养基中30 ℃、200 r·min-1培养2~3 d,得到菌丝体。采用苯酚-氯仿抽提法提取基因组,通过常规PCR扩增筛选出ME基因敲除菌株。PCR所用聚合酶为KOD FX。PCR扩增条件:94 ℃预变性2 min;94 ℃变性30 s,56 ℃退火30 s,68 ℃延伸1 min,30个循环;68 ℃延伸5 min。
1.2.4 目的菌株的发酵
发酵罐规格为贝朗A plus 5 L,装液量为4 L。采用孢子接种,接种量为5×108个·mL-1,初始pH值2.5,转速 200 r·min-1,通气量0.3 vvm;孢子萌发后(大约16 h)pH值4.5,转速 600 r·min-1,通气量1 vvm。用1 mol·L-1NaHCO3与2 mol·L-1HCl调节pH值[13]。每隔12 h取样检测。
1.2.5 发酵液中有机酸含量的测定
采用高效液相色谱法(HPLC)测定。取发酵液2 mL通过0.22 μm微孔滤膜过滤得到清液,稀释适当倍数用于液相色谱分析。使用Bio-Rad Aminex®HPX-87H有机酸专用液相色谱柱;有机酸含量采用紫外检测器检测,检测波长为210 nm;甘油及残糖含量采用视差检测器检测;流动相为5 mmol·L-1硫酸溶液;流速0.6 mL·min-1;柱温65 ℃;进样量10 μL[14]。根据标准曲线计算发酵液中相关物质的含量。
2 结果与讨论
2.1 ME蛋白结构预测及曲霉家族ME蛋白序列比对(图1)
黑曲霉基因组数据预测ME基因编码含666个氨基酸的蛋白,Broadinstitute预测该蛋白中含有一个N-端结构域和一个NAD结合结构域(图1a)。
从基因组数据库中获取曲霉家族ME蛋白序列并采用clustalx1.83软件进行比对,发现该蛋白在曲霉属中相似度均大于85%,说明该蛋白在曲霉属中十分保守(图1b)。

图1 ME蛋白结构预测及曲霉家族ME蛋白序列比对
2.2 敲除质粒p44-ME::hyg的构建
采用苯酚-氯仿抽提法提取黑曲霉ATCC1015基因组,用作常规PCR的模板,分别扩增黑曲霉ME基因的上下游各1.0 kb的片段,并将它们分别连接到质粒p44潮霉素基因的上下游,得到敲除质粒p44-ME::hyg(图2a)。将p44-ME::hyg分别用BamHⅠ/KpnⅠ与HindⅢ/PstⅠ进行酶切,各得到一条1.0 kb左右的条带,分别为连接到质粒上的ME基因的上下游同源臂,说明 p44-ME::hyg构建成功,是需要的含有同源臂的敲除质粒(图2b)。

M.Marker 1.Bam HⅠ/Kpn Ⅰ酶切 2.Hin dⅢ/Pst Ⅰ酶切
2.3 ME基因敲除菌株的筛选与鉴定
在共培养过程中,同源序列可能发生交换,产生敲除菌株(图3a)。共培养物在筛选培养基上生长出转化子,选择30株单独培养,得到菌丝体,提取DNA并进行PCR验证,得到1株敲除菌株△ME。提取野生株和突变株基因组,利用ME-upf1/ME-downr1进行引物PCR验证,野生株(图3b 1#泳道)有一条1.2 kb左右的目的条带,而突变株(图3b 2#泳道)没有(后面引物所在部分被潮霉素基因取代了);利用ME-upf1/ME-hyg引物进行PCR验证,突变株(图3b 4#泳道)有一条1.2 kb左右的目的条带,而野生株(图3b 3#泳道)则没有(野生株没有潮霉素基因)。
这些表明菌株△ME即为敲除ME基因后的突变菌株。
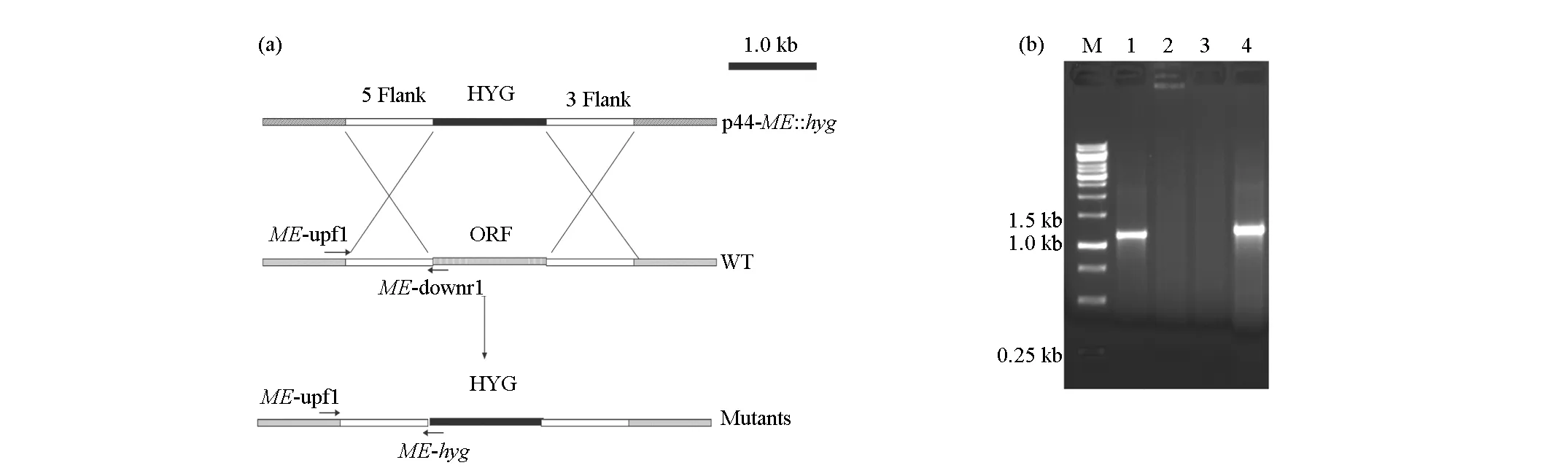
M.Marker 1.ME-upf1/ME-downr1,WT 2.ME-upf1/ME-downr1,△ME 3.ME-upf1/ME-hyg,WT 4.ME-upf1/ME-hyg,△ME
2.4 菌体和残糖的测定
将野生株与△ME突变株单独发酵培养,每隔12 h取样检测菌体干重与残糖量,结果见图4。

图 4 发酵过程曲线
由图4可看出,野生株与△ME突变株的菌体生长状况相似,并且残糖量也非常接近,说明ME基因的敲除对菌体生长的影响并不明显。
2.5 发酵过程代谢物含量的测定
将野生株与△ME突变株单独发酵培养96 h,每12 h取一次样,将菌液通过0.22 μm滤膜过滤,采用HPLC测定代谢物含量,结果见图5。

图5 代谢物最高产量
由图5可看出,与野生株相比,△ME突变株柠檬酸、草酸、丙酮酸以及苹果酸的产量没有明显变化,说明ME基因的敲除对代谢影响不大。
2.6 讨论
虽然不同生物体中ME有不同的生理功能,但它们的氨基酸序列却高度保守。根据大肠杆菌MaeB的氨基酸序列,可以推测出它含有3个保守结构域,其中N-端结构域和NAD结合结构域为苹果酸酶所特有;C-端结构域与没有苹果酸酶活性但能够催化乙酰基群转化成正磷酸盐的PTA(Phosphotransacetylases)同源[15]。
卷枝毛霉(Mucorcircinelloides)中的苹果酸酶被认为是该真菌中生物合成多不饱和脂肪酸所需要的重要酶,它持续为脂肪酸合成酶进行链延伸提供NADPH[6]。在植物的TCA循环过程中,线粒体中NAD-ME催化丙酮酸脱羧[7]。在对拟南芥的研究中发现,NADP-ME只在特定的发育阶段发挥作用[16]。
3 结论
将黑曲霉中的ME基因敲除之后获得1株ME基因敲除的突变株。对突变株进行发酵研究,发现其TCA循环各种有机酸、柠檬酸、草酸、丙酮酸以及苹果酸的产量与野生株相比没有明显变化,说明ME基因的敲除对代谢并没有产生明显影响。在真菌中,由于其代谢系统的复杂性,如在TCA循环中存在很多代谢支路及其代谢相关的酶,单个基因敲除后对代谢的影响可能不是很大。
参考文献:
[1] Baker S E.Aspergillusnigergenomics:Past,present and into the future[J].Medical Mycology,2006,44(S1):17-21.
[2] Pel H J,de Winde J H,Archer D B,et al.Genome sequencing and analysis of the versatile cell factoryAspergillusnigerCBS 513.88[J].Nature Biotechnology,2007,25(2):221-231.
[3] Michielse C B,Hooykaas P J,van de Hondel C A,et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Current Genetics,2005,48(1):1-17.
[4] Chang G G,Tong L.Structure and function of malic enzymes,a new class of oxidative decarboxylases[J].Biochem,2003,42(44):12721-12733.
[5] Detarsio E,Andreo C S,Drincovich M F.Basic residues play key roles in catalysis and NADP+-specificity in maize(ZeamaysL.) photosynthetic NADP+-dependent malic enzyme[J].Biochem J,2004,382(Pt3):1025-1030.
[6] Wynn J P,Hamid A B A,Ratledge C.The role of malic enzyme in the regulation of lipid accumulation in filamentous fungi[J].Microbi,1999,145(8):1911-1917.
[7] Song Y D,Wynn J P,Li Y H,et al.A pre-genetic study of the isoforms of malic enzyme associated with lipid accumulation inMucorcircinelloides[J].Microbi,2001,147(6):1507-1515.
[8] Dolezal P,Vanacova S,Tachezy J,et al.Malic enzymes ofTrichomonasvaginalis:Two enzyme families,two distinct origins[J].Gene,2004,329:81-92.
[9] Michielse C B,Ram A F J,Hooykaas P J J,et al.Agrobacterium-mediated transformation ofAspergillusawamoriin the absence of full-length VirD2,VirC2,or VirE2 leads to insertion of aberrant T-DNA structures[J].Journal of Bacteriology,2004,186(7):2038-2045.
[10] Sugui J A,Chang Y C,Kwon-Chung K J.Agrobacteriumtumefaciens-mediated transformation ofAspergillusfumigatus:An efficient tool for insertional mutagenesis and targeted gene disruption[J].Applied and Environmental Microbiology,2005,71(4):1798-1802.
[11] Michielse C B,Hooykaas P J,van den Hondel C A,et al.Agrobacterium-mediated transformation of the filamentous fungusAspergillusawamori[J].Nature Protocols,2008,3(10):1671-1678.
[12] den Dulk-Ras A,Hooykaas P J J.Electroporation ofAgrobacteriumtumefaciens[J].Methods of Molecular Biology,1995,55:63-72.
[13] Roukas T.Carob pod:A new substrate for citric acid production byAspergillusniger[J].Applied Biochemistry and Biotechnology,1998,74(1):43-53.
[14] Samragy Y A,Khorshid M A,Foda M I,et al.Effect of fermentation conditions on the production of citric acid from cheese whey byAspergillusniger[J].International Journal of Food Microbiology,1996,29(2-3):411-416.
[15] Marchler-Bauer A,Anderson J B,Cherukuri P F,et al.A conserved domain database for protein classification[J].Nucleic Acids Res,2005,33:192-196.
[16] Wheeler M C G,Tronconi M A,Drincovich M F,et al.A comprehensive analysis of the NADP-malic enzyme gene family ofArabidopsis[J].Plant Phy,2005,139(1):39-51.
