白藜芦醇对大鼠海马CA1区诱发癫痫样放电的影响
2012-07-28尤竹燕王斌生王烈成
尤竹燕,王斌生,解 敏,李 珍,王烈成
(1.安徽医科大学基础医学院生理学教研室,安徽合肥 230032;2.浙江大学医学院血液细胞生物学实验室,浙江杭州 310058)
癫痫是由多种原因引起的局部脑区神经元群异常放电所致的行为和功能异常的发作性慢性中枢神经系统疾病。颞叶癫痫(temporal lobe epilepsy,TLE)是临床上最常见的癫痫类型,但由于目前对其机制还不是很明确,因此给它的治疗带来很大困难。癫痫的药物防治目前研究进展缓慢,使用经典的抗癫痫药物如苯妥英钠、丙戊酸等可有效地控制部分癫痫发作,但仍有20%~25%癫痫患者经正规抗癫痫药物治疗后难以控制,发展成为慢性或难治性癫痫。另外,由于目前经典的抗癫痫药物在药动学和药理学上均有缺陷,因此临床上一直在找寻新型的抗癫痫药物。白藜芦醇(Res)是多种植物在遭受损伤、紫外线照射和真菌感染时合成的一种抗菌素[1],具有多酚结构,并具有抗氧化、清除自由基、抗癌、抗诱变、抗衰老和降血脂等方面的作用。目前认为,Res对神经元有一定的营养、损伤修复和保护作用[2],近年来,Res对癫痫的治疗也逐渐引起了关注[3]。本研究采用离体脑片场电位记录技术,通过在灌流脑脊液中加入不同浓度的Res,观察并分析Res对大鼠海马CA1区癫痫样活动的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 普通级Wistar大鼠,♂,体质量200~240 g,由南京医科大学实验动物中心提供。
1.1.2 试剂 KA、bicuculline、Res均购自 Sigma公司,水合氯醛、戊巴比妥钠购自中国医药集团上海化学试剂公司。
1.1.3 仪器 SN-2脑立体定位仪(日本 Narishige);Strong 90颅骨钻 (韩国 Saeshin公司);NVSLM1振动切片机(美国WPI);P-97微电极拉制仪(美国Sutter);Model 3000 AC/DC差分放大器(美国A-M systems);Master-8生物电刺激器(以色列A.M.P.I.);powerlab 8/30 数据采集分析系统(澳大利亚ADInstruments)。
1.2 方法
1.2.1 TLE动物模型建立 大鼠经水合氯醛(350 mg·kg-1)腹腔麻醉后,固定于立体定位仪上,暴露颅骨,按大鼠立体定位图谱[4]确定右侧海马CA3区注射靶点(AP:-4.0 mm,ML:4.4 mm,DV:3.8 mm),用微量注射针注入 2.5 ~3 μl KA(0.4 g·L-1),注射15 min,留针 10 min,术后缝合头皮。大鼠急性发作等级参照Racine标准分级[5],达到Ⅳ级及以上视为建模成功,模型大鼠在手术后2~4周进行细胞外场电位记录。
1.2.2 离体脑片制备 大鼠用2%戊巴比妥钠麻醉后迅速断头取脑,置于持续给予95%O2和5%CO2混合气的4℃人工脑脊液(artificial cerebrospinal fluid,ACSF)中。待脑组织冷却后按水平切面切成400 μm厚的脑片,并将其移至含(30 ±2)℃ ACSF的孵育槽中,持续通入混合气,孵育1~2 h。ACSF成分 (mmol· L-1)包 括:NaCl 124,KCl 4.5,NaH2PO41.6,MgCl22.1,CaCl22.7,NaHCO326,Glucose 10,pH调定在7.4左右。
1.2.3 场电位记录 将孵育的脑片移至记录槽,持续灌流95%O2和5%CO2混合气饱和的ACSF,灌流速度2 ml·min-1,温度32℃。刺激电极为双极钨丝电极,通过高倍显微镜及定位仪的辅助操作,将其置于辐射层Schaffer侧支通路;记录电极为内充2 mol·L-1NaCl的玻璃微电极,阻抗5~8 MΩ,置于CA1区锥体细胞层记录群峰电位(population spike,PS)。刺激频率0.033 Hz,波宽0.1 ms。由记录电极引导的诱发电位经微电极放大器放大,输入powerlab数据采集系统进行观察、记录和分析。药物实验通过脑片灌流给药途径,给药前稳定记录诱发电位30 min。
1.3 统计学处理 采用SPSS 13.0统计软件分析,实验结果以±s表示,组间均数用t检验进行比较。
2 结果
2.1 白藜芦醇对正常大鼠海马CA1区PS的影响电刺激离体海马脑片Schaffer侧支,在CA1区锥体细胞层通常可记录到单个PS,见Fig 1A;在灌流正常脑片的ACSF中分别加入低、中和高剂量(分别为 5、15、50 μmol·L-1)的 Res,当含有相应浓度的Res持续灌流脑片20 min后记录的PS分别为灌流前的(98.32±1.3)%、(97.29±2.9)%、(96.46±1.5)%,经统计学分析PS幅度均无明显变化(n=8,P >0.05)。见 Fig 1B,Fig 1C 及 Fig 1D。
2.2 Bicuculline及KA诱发大鼠海马CA1区痫样放电活动的PS 用GABAA受体拮抗剂bicuculline(30 μmol·L-1)灌流正常海马脑片 20 min 后可引起4~6个PS的痫样放电活动,见Fig 2A;KA造模成功后所致的大鼠海马脑片也可记录到4~6个PS的痫样放电活动,见Fig 2B。
2.3 不同浓度的白藜芦醇对bicuculline所致大鼠海马CA1区癫痫样活动PS的影响
2.3.1 低、中剂量 Res对大鼠海马CA1区诱发癫痫样活动PS的影响 在正常海马脑片灌流bicuculline 20 min的基础上,再灌流低剂量的Res(5 μmol·L-1)20 min后,前4个PS幅度均无明显变化,分别为灌流前的(99.61±3.1)%、(102.66±3.2)%、(98.91±3.2)%、(99.65±3.3)%(n=8,P >0.05;Fig 3A)。用中剂量的 Res(15 μmol·L-1)灌流海马脑片20min后,前4个PS幅度也无明显变化,分别为灌流前的(98.27±2.9)%、(97.60±4.8)%、(97.08±5.4)%、(100.40±4.6)%(n=8,P >0.05;见 Fig 3B)。提示脑片灌流 5 ~15 μmol·L-1的Res对bicuculline所致的CA1区癫痫样放电活动没有明显的影响。
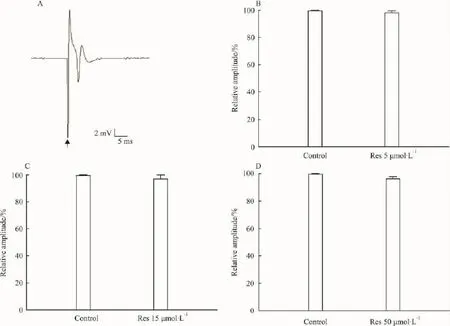
Fig 1 Effects of resveratrol on PS in rat hippocampal CA1 region(The arrow marks the stimulus artifact of PS)

Fig 2 PS of epileptiform discharges evoked by bicuculline(A)and KA(B)in rat hippocampal CA1 region
2.3.2 高剂量的Res对大鼠海马CA1区诱发癫痫样活动PS的影响 在正常海马脑片灌流bicuculline 20 min的基础上,再灌流高剂量的Res(50 μmol·L-1)20 min后,前4个PS幅度均出现明显性降低,分别为灌流前的(70.13±5.4)%、(67.87±3.6)%、(63.09±3.5)%、(61.01±5.3)%(n=8,P<0.01;Fig 3C);并且PS数目也明显减少,为灌流前的(82.02±1.3)%(n=8,P <0.01;Fig 3D)。以上结果表明 50 μmol·L-1的 Res对 bicuculline 所致的CA1区癫痫样放电活动有部分抑制作用。
2.4 不同浓度的白藜芦醇对癫痫模型大鼠海马CA1区PS的影响 在颞叶癫痫模型大鼠海马脑片上,用低剂量的Res(5 μmol·L-1)灌流海马脑片20 min后,前4个PS幅度均无明显变化,分别为灌流前的(98.61±3.3)%、(96.55±4.9)%、(95.22±2.5)%、(98.49±3.1)%(n=6,P >0.05;Fig 4A);用中剂量的 Res(15 μmol·L-1)灌流海马脑片20 min后,前4个PS幅度也无明显变化,分别为灌流前的(100.52±1.3)%、(101.30±2.7)%、(102.68±3.1)%、(103.36 ±3.2)%(n=6,P >0.05,Fig 4B)。而用高剂量的 Res(50 μmol·L-1)灌流海马脑片20 min后,前4个PS幅度均明显降低,分别为灌流前的(84.39±5.4)%、(84.40±4.9)%、(83.88±4.8)%、(81.30±6.3)%(n=6,P <0.01;Fig 4C);PS数目也明显减少,为灌流前的(84.58±2.4)%(n=6,P < 0.01;Fig 4D)。提示 50 μmol·L-1的Res对癫痫大鼠海马CA1区场电位异常放电有部分抑制作用。
3 讨论
癫痫是由多种病因引起的慢性中枢神经系统疾病,各种癫痫发作的本质都是由中枢神经系统某些细胞群发生突然地、过度地、同步地异常放电所引起的行为异常,异常放电的确切机制至今尚未完全阐明。目前较一致的观点是癫痫发病是因为中枢神经系统兴奋性与抑制性不平衡所致。近年来的研究表明,这种兴奋与抑制间的不平衡主要与突触传递[6]、氧化应激[1]及受体介导[7]等的改变有关。
Bicuculline是大鼠海马GABAA受体的拮抗剂,GABA是中枢神经系统抑制性递质,其离子型GABAA受体的激活可增加神经元细胞膜的Cl-通透性,产生抑制性突触后电位,发挥抑制效应[8]。通过海马脑片灌流bicuculline可以使这种抑制作用减弱,并记录到多个PS的痫样放电活动(见Fig 2)。KA是从海人草中提取的一种外源性氨基酸,其化学结构类似于谷氨酸,是兴奋性氨基酸 KA受体的特异性激动剂,具有很强的兴奋作用。本实验通过在大鼠海马内微量注射KA对海马产生兴奋毒性,从而诱发癫痫,且此种模型与人类癫痫的病理变化和行为表现很相似[9-10],通过脑片灌流的方式也可记录到多个PS的痫样放电活动(见Fig 2)。

Fig 3 Effects of resveratrol with low,middle and high dose on PS evoked by bicuculline in rat hippocampal CA1 region
本研究通过离体脑片的场电位记录发现随着白藜芦醇灌流浓度增加到50 μmol·L-1对大鼠海马CA1区诱发的癫痫样电活动有部分抑制作用,Res不但能降低大鼠海马Bicuculline诱发的癫痫样电活动,且能降低注射KA的造成大鼠癫痫模型的海马CA1区的癫痫样电活动,提示一定浓度的白藜芦醇对癫痫的异常放电有一定的抑制效应,这与我们以往在整体癫痫大鼠模型所观察的结果一致[10]。Bicuculline和KA均可使大鼠海马兴奋性与抑制性神经元上受体表达失衡,兴奋性神经元过度兴奋,抑制性神经元大量死亡,从而使海马处于过兴奋状态导致癫痫样场电位出现多个群峰电位(PS)。Res能有效对抗KA诱导的癫痫大鼠海马CA1、CA3和齿状回(DG)门区神经元死亡[10],同时Res也能有效抑制KA诱导的星形胶质细胞和小胶质细胞兴奋[11]。本实验室既往研究也发现 Res具有保护TLE大鼠的CA1和CA3a区神经元免受损伤的作用,并明显地抑制MFS,降低了海马内神经元同步化放电和癫痫自发发作的频率,具有较好的抗癫痫作用[11]。Res不但能明显地抑制KA诱导的慢性颞叶癫痫大鼠的痫样自发发作,且对KA诱导的颞叶癫痫大鼠癫痫不同发作时期海马兴奋性/抑制性氨基酸递质比例的失衡有一定的逆转作用[12]。Gupta等指出Res能对抗KA诱导的癫痫大鼠海马活性氧(ROS)水平的增加,而ROS可以使大鼠海马兴奋性神经元活性增加,推测Res通过降低大鼠脑内氧化应激水平抑制癫痫的发生[1]。另外,我们之前还发现癫痫大鼠CA1区多个PS的癫痫样电活动可能是由于锥体细胞轴突回返形成的突触联系激活了NMDA受体,并和非NMDA受体共同介导,而NMDA受体主要参与癫痫样电活动靠后的PS[13]。因此,Res可能通过调节NMDA受体的功能对CA1区诱发的癫痫样电活动产生部分抑制作用。

Fig 4 Effects of resveratrol with low,middle and high dose on PS in hippocampal CA1 region of rat TLE model
综上所述,白藜芦醇可能通过改善突触传递、降低氧化应激或者调节受体功能这些机制来产生抗癫痫作用,且白藜芦醇可透过血脑屏障[14],这也为临床治疗癫痫提供了依据。本研究虽然在实验室之前研究的基础上通过脑片灌流技术进一步揭示了白藜芦醇的抗癫痫作用,但具体的作用机制亟待进行更深入的研究。
[1] Balestrazzi A,Bonadei M,Calvio C,et al.Leaf-associated bacteria from transgenic white poplar producing resveratrol-like compounds:Isolation,molecular characterization,and evaluation of oxidative stress tolerance[J].Can J Microbiol,2009,55:829 -40.
[2] 李 珍,王斌生,孔德虎,王烈成.白藜芦醇预处理对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J].中国药理学通报,2010,26(6):802 -6.
[2] Li Z,Wang B S,Kong D H,Wang L C.Neuroprotective effects of preconditioning with resveratrol on focal cerebral ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):802 -6.
[3] Munjal M A,Bharathi H,Ashok K S.Progress in neuroprotective strategies for preventing epilepsy[J].Prog Neurobiol,2008,84:363-404.
[4] Watson C,Paxinos G.The rat brain in stereotaxic coordinates[M].Imprint:Academic press,2007:145 -65.
[5] Racine R,Okujava V,Chipashvili S.Modification of seizure activity by electrical stimulation.3.Mechanisms[J].Electroencephalogr Clin Neurophysiol,1972,32(3):295 -9.
[6] Scharfman H E.The CA3“backprojection”to the dentate gyrus[J].Prog Brain Res,2007,163:627 -37.
[7] Okazaki M M,Nadler J V.Glutamate receptor involvement in dentate granule cell epileptiform activity evoked by mossy fiber stimulation[J].Brain Res,2001,915(1):58 -69.
[8] Jang I S,Nakamura M,Ito Y,Akaike N.Presynaptic GABAA receptors facilitate spontaneous glutamate release from presynaptic terminals on mechanically dissociated rat CA3 pyramidal neurons[J].Neuroscience,2006,138(1):25 -35.
[9] Bragin A,Engel J J,Wilson C L,et al.Electrophysiologic analysis of a chronic seizure model after unilateral hippocampal KA injection[J].Epilepsia,1999,40(9):1210 -21.
[10] Wu Z,Xu Q,Zhang R,et al.Protective effect of resveratrol against kainate-induced temporal lobe epilepsy in rats[J].Neurochem Res,2009,34(8):1393 -400.
[11] Bastianetto S,Zheng W H,Quirion R.Neuroprotective abilities of resveratrol and other red wine constituents against nitric oxide-related toxicity in cultured hippocampal neurons[J].Br J Pharmacol,2000,131(4):711 -20.
[12]李 敏,孔德虎,许 奇,王烈成.颞叶癫痫大鼠不同时期海马和皮层氨基酸类递质的变化[J].安徽医科大学学报,2010,45(2):135-8.
[12] Li M,Kong DH,Xu Q,Wang L C.Effects of resveratrol on variations of the amino acids in hippocampus and cortex in different periods of temporal lobe epilepsy[J].Acta Univ Med Anhui,2010,45(2):135-8.
[13]王斌生,尤竹燕,解 敏,等.介导大鼠海马CA1区癫痫样活动的离子型关酸受体的变化[J].安徽医科大学学报,2011,46(7):640-7.
[13] Wang B S,You Z Y,Xie M,et al.Variations of ionotropic glutamate receptors mediating epileptiform activity in rat hippocampal CA1 region[J].Acta Univ Med Anhui,2011,46(7):640 -7.
[14] Mokni M,Elkahoui S,Limam F,et al.Effect of resveratrol on antioxidant enzyme activities in the brain of healthy rat[J].Neurochem Res,2007,32:981 -7.
