黄芩提取物中黄酮类成分血浆蛋白结合率的测定
2012-07-28冯志强谢智勇廖琼峰
冯志强,韩 坚,谢智勇,廖琼峰,张 蕾
(1.广州中医药大学中药学院,广东广州 510006;2.中山大学药学院,广东 广州 510080)
黄芩(Radix Scutellariae)为唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根,主要活性成分为黄酮类化合物[1]。临床上药理作用广泛,在许多方剂中均有配伍使用,如《金匮要略》收载方剂248方,其中含黄芩有20余方[2]。血浆蛋白结合率是进行药动学研究的重要参数[3],而关于黄芩黄酮类成分,目前仅有黄芩苷单体血浆蛋白结合率的报道文献[4-5],对于总黄酮部位中多种黄酮类成分血浆蛋白结合率的研究尚未见报道。本文以黄芩苷(namely baicalin,BL)、汉黄芩苷(wogonoside,WL)、汉黄芩素(wogonin,W)、千层纸素A(oroxylin A,OA)作为检测指标,采用平衡透析法研究其在大鼠血浆中的药物蛋白结合率,为进一步研究黄芩及其复方的药动学提供基础参数。
1 仪器与材料
1.1 仪器 AnkeTDL-40B离心机(上海科学安瓶科学仪器制造厂);Precisa XS225A十万分之一分析天平;天美T2000P高效液相色谱仪(UV detector,上海天美科学仪器有限公司);透析袋(14 000 D,广州文睿科学仪器有限公司)。
1.2 试药 黄芩总黄酮(水提酸沉;各指标成分含量:黄芩苷50.05%,汉黄芩苷1.06%,汉黄芩素6.39%,千层纸素A 0.83%);黄芩苷、汉黄芩素(中国药品生物制品检定所,批号:110715-200212、1514-200202);汉黄芩苷(西安融升生物科技有限公司,批号:091126,含量>98%);千层纸素 A、高丽槐素(自制,含量>98%);色谱甲醇、乙腈(Merk公司);其余试剂为分析纯。
1.3 实验动物 SD大鼠,180~220 g,♀♂各半,广州中医药大学实验动物中心。
2 方法与结果
2.1 色谱条件 Phenomenex Synergi C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1% 甲酸水(B),梯度洗脱:0~5 min(A:32% ~35%),5~15 min(A:35% ~50%),15 ~25 min,(A:50% ~50%);流速 1.0 ml·min-1;检测波长:275 nm;进样量:20 μl。
2.2 样品处理
2.2.1 透析内液 取空白血浆(或透析内液)200 μl,加入混合系列对照品溶液(或甲醇)600 μl,内标(400 mg·L-1)100 μl,涡旋 3 min,12 000 r·min-1离心 5 min,取上清液。
2.2.2 透析外液 除不加内标外,其他同“2.2.1”项下操作。
2.3 方法学建立
2.3.1 专属性实验 通过比较大鼠空白血浆(或空白透析液)、空白血浆(或空白透析液)加对照品和给药透析平衡后透析内液(或透析外液)的色谱图,来考察分析方法的专属性,结果表明,血浆和透析外液中内源性物质及黄芩提取物中的其它组分与指标化合物分离度良好,不干扰测定(Fig 1)。
2.3.2 标准曲线的绘制 分别精密称取黄芩苷、汉黄芩苷、汉黄芩素、千层纸素A对照品适量,用色谱甲醇配制成浓度分别为994、422、135和107 mg·L-1的对照品储备液。各精密吸取适量,分别配制两组6个不同浓度的混合对照品溶液(内、外液)。取大鼠空白血浆和空白透析液各200 μl,按“2.2”项下方法处理样品,记录色谱图和峰面积。采用加权(1/χ2)最小二乘法,以各成分峰面积与内标峰面积的比值(Ai/As)对质量浓度(Ci)进行线性回归,求得回归方程即为透析内液标准曲线;以各成分峰面积(Ai)对质量浓度(Ci)进行线性回归,得回归方程即为透析外液标准曲线(Tab 1)。

Fig 1 HPLC chromatograms of four major flavonoids in total flavonoids extract of scutellaria baicalensis Georgi inside and outside the dialysis membranes
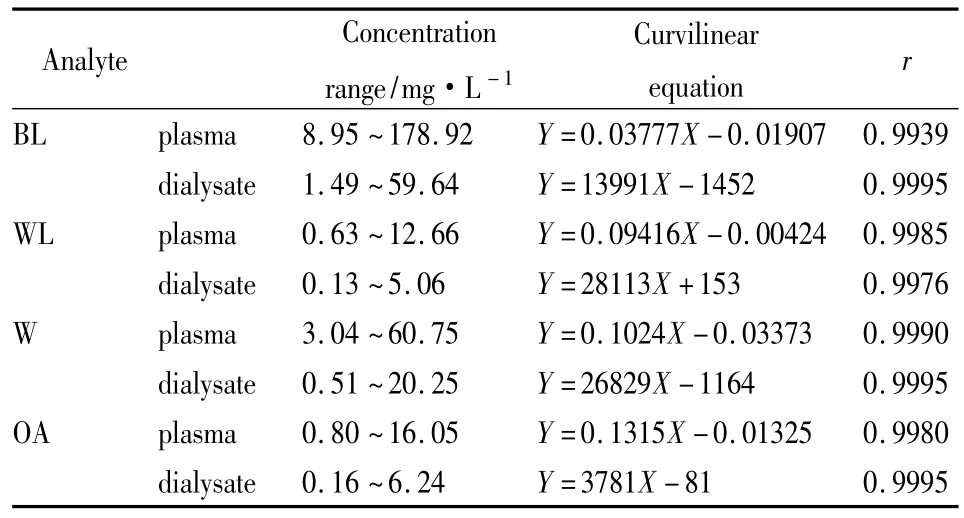
Tab 1 Standard curves of four compounds in plasma
2.3.3 准确度与精密度 按“2.3.2”项下方法配制低、中、高3个浓度的模拟血浆样品和模拟透析液样品,按各样品处理方法考察准确度和精密度。模拟血浆样品的测定结果进行单因素方差分析,考察日内和日间精密度(RSD),准确度以相对误差(RE%)表示,见Tab 2。
2.3.4 提取回收率 用空白血浆配制成低、中、高3个浓度的模拟血浆样品,每一浓度6样本分析,照“2.2”项下方法操作,峰面积记为A;同时,另以水代替血浆同法制备,峰面积记为B。以每一浓度两种处理方法的峰面积比值(A/B)计算提取回收率,3种浓度下各成分的提取回收率分别为BL(66.1±3.0)%、WL(90.8±6.4)%、W(95.4±7.8)%、OA(93.6±4.6)%。同法测定内标的提取回收率为(91.7±2.0)%。
2.3.5 稳定性考察 分别考察模拟血浆样品和模拟透析外液样品在-20℃冻藏14 d、预处理后室温放置和4℃条件下放置的稳定性。结果表明:血浆样品中,黄芩苷-20℃冻藏14 d、室温放置6 h和4℃放置24 h均稳定;平衡透析液中,黄芩苷室温下不稳定,但在4℃条件下可稳定36 h。其余成分各条件下均稳定。
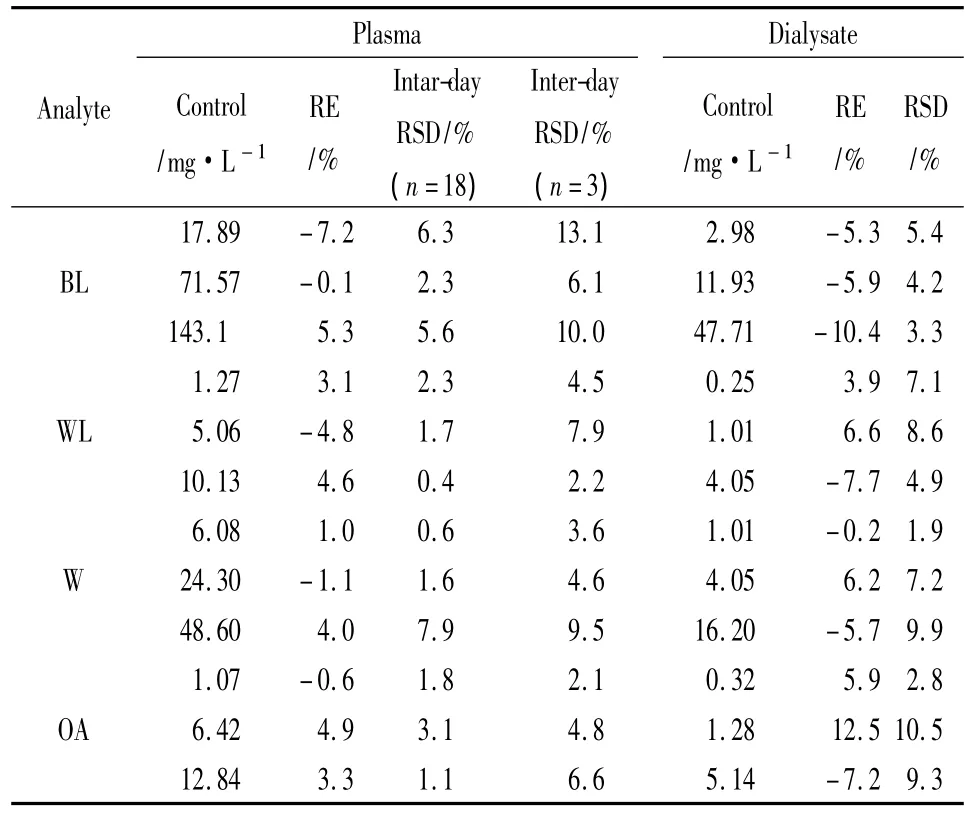
Tab 2 Validation of the intra-day and inter-day assays
2.4 血浆蛋白结合率的测定 将预处理过的透析袋(长度约10 cm)一端折叠,结扎,于另一端加入新鲜大鼠血浆2 ml,留一小段气泡,后将其扎紧,悬浮于盛有20 ml含药透析液(提取物浓度41.6、62.4和104 mg·L-1)的广口瓶中,每浓度3样本,置4°C的冰箱冷藏平衡(12 h),精密移取内、外液200 μl,按“2.2”项下方法操作,分别测定透析袋内血浆药物浓度(总浓度Dt)和透析外液中药物浓度(游离药物浓度Df),根据公式:血浆蛋白结合率=(Dt– Df)/Dt×100%计算各指标成分的血浆蛋白结合率(Tab 3)。数据应用F检验验证其方差齐性后,采用SPSS 13.0软件进行方差分析,结果表明,黄芩苷和汉黄芩苷在大鼠血浆中的蛋白结合率存在质量浓度依赖性(P<0.01),汉黄芩素和千层纸素A则不存在质量浓度依赖性(P>0.05)。
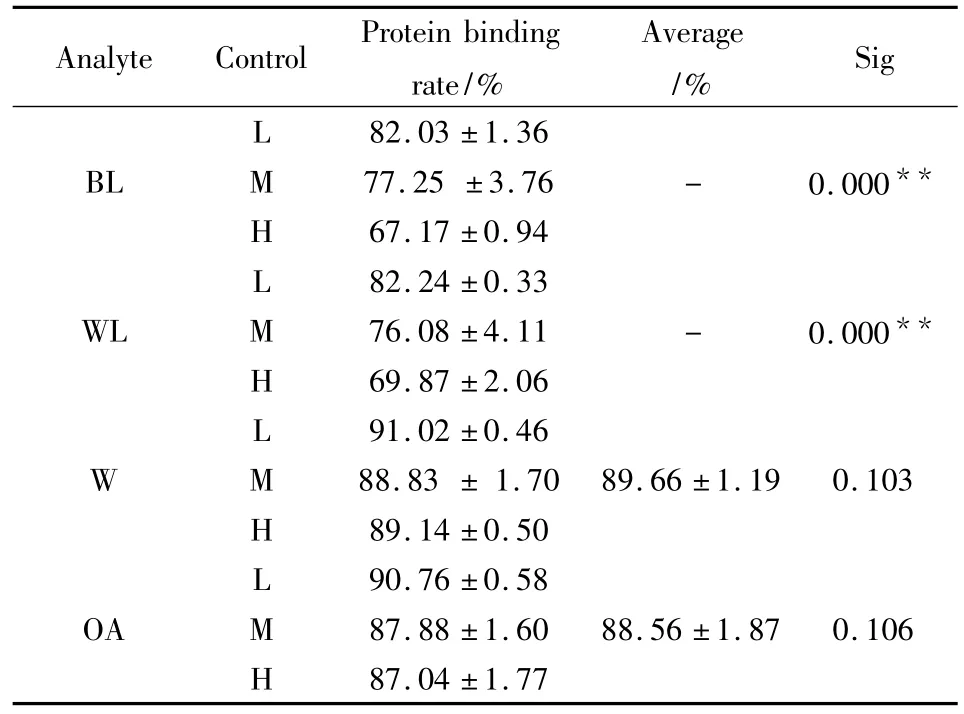
Tab 3 Protein binding rates of 4 compounds in plasma of rats(n=3)
3 讨论
平衡透析法原理简单,操作方便,是经典和常用的测定方法[6-7],但由于平衡透析时间长,须考察药物的稳定性。因此,对黄芩苷稳定性因素的考虑是方法建立的关键。本研究表明,黄芩苷在透析液中的降解速率,提取物给药比单体给药明显降低,且呈现温度依赖性,在4℃条件下可稳定36 h。操作中为防止样品在处理过程中降解,所有样品均在冰浴上处理,低温涡旋、离心、测定(4℃),所用样品管预先置于-20℃,试剂于4℃冰箱中保存备用。
本研究发现,黄芩提取物中,黄芩苷、汉黄芩苷、汉黄芩素、千层纸素A 4个成分与大鼠血浆有较高的结合率(>80%)。其中,黄酮苷类成分(黄芩苷和汉黄芩苷)随着药物浓度的增加,蛋白结合率呈下降趋势,推测其可能随给药剂量的不同有较大差异,而黄酮苷元(汉黄芩素和千层纸素A)则是非呈现浓度依赖性,提示黄酮苷和苷元由于结构和极性不同,其蛋白结合率亦有较大差异。
药物经吸收进入血液后部分呈游离的分子状态,部分则与血浆蛋白质可逆性结合,只有游离的药物可以发挥药效。当游离的药物从组织或血液中清除后,部分结合药物可与血浆蛋白质解离,从而弥补游离药物。药物与血浆蛋白质的可逆性结合不仅影响其代谢动力学、作用强度与作用时间,而且往往与药物的作用机制、药物相互作用等密切相关,因此,本研究可为含黄芩的复方及其组分(群)配伍研究提供基础数据。
[1] 国家药典委员会.《中国药典》Ⅰ部[S].北京:化学工业出版社,2010:282-3.
[1] Chinese PharmacopoeiaCommission.Chinese pharmacopoeia,Volume Ι[S].Beijing:Chinese Medical Science and Technology Press,2010:282-3.
[2] 王 娜.中药黄芪、黄芩有效成分的体外抑菌作用研究[D].燕山大学,2009.
[2] Wang N.Experimental study on antimicrobial effects of active principle from Chinese traditional medicine astragalus membranaceus bge and scutellaria in vitro[D].Yanshan Univ,2009.
[3] 周 玲,居文政,刘子修,等.灯盏细辛注射液多成分血浆蛋白结合率测定[J].中国药理学通报,2011,27(5):719-22.
[3] Zhou L,Ju W Z,Liu Z X,et al.Determination of plasma protein binding rate of multicomponent in Dengzhanxixin injection[J].Chin Pharmacol Bull,2011,27(5):719-22.
[4] 王 弘,陈济民,张清民.用高效液相色谱法测定人血浆中黄芩苷与血浆蛋白的结合率[J].沈阳药科大学学报,2000,17(9):107-9.
[4] Wang H,Chen J M,Zhang Q M.High-performance liquid chromatographic determination of baicalin in human plasma[J].J Shenyang Pharm Univ,2000,17(9):107-9.
[5] 陈 莹,李 月.超滤法测定黄芩苷的血浆蛋白结合率[J].山西医药杂志,2010,39(7):677-8.
[5] Chen Y,Li Y.Determination of plasma protein binding rate of baicalin by ultrafiltration[J].Shanxi Med J,2010,39(7):677-8.
[6] Hage D S,Tweed S A.Recent advances in chromatographic and electrophoretic methods for the study of drug-protein interactions[J].J Chromatogr B Biomed Sci Appl,1997,699(1-2):499-525.
[7] Oravcová J,Böhs B,Lindner W.Drug-protein binding sites.New trends in analytical and experimental methodology[J].J Chromatogr B Biomed Appl,1996,677(1):1-28.
