重组人促红细胞生成素对对比剂诱导的大鼠急性肾损伤的保护作用
2012-07-28王文杰吕昌云
王文杰 戴 春 吕昌云
1.徐州医学院研究生学院,江苏 徐州 221002;2.徐州医学院附属医院肾内科,江苏 徐州 221002;3.总参军训和兵种部徐州干休所,江苏 徐州 221002
随着放射诊断技术的不断发展和介入治疗的广泛应用,对比剂肾病(contrast-induced nephrology,CIN)开始引起了人们的关注。研究表明,在4622例住院患者中,肾功能不全发生率为7.2%,其中CIN是仅次于肾灌注不足和肾毒性药物引起肾衰竭的第三大常见原因[1-2]。因此研究如何有效地预防或减少造影剂的肾毒性具有重要的现实意义。
临床上用于改善贫血状态的重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)具有抗氧化、抑制细胞凋亡、抑制炎症反应、免疫调节、血管修复、抗纤维化及促进肾小管上皮细胞再生等作用[3-8]。但rhEPO是否对对比剂肾损害有保护作用,目前国内尚缺乏充分的研究及报道。本实验拟通过对不同剂量rhEPO的研究,探讨其对大鼠CIN的保护作用,为临床应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 动物 健康雄性SD大鼠40只,体重180~240 g,由徐州医学院实验动物中心提供。
1.1.2 药品与试剂 rhEPO(益比奥,沈阳三生制药有限责任公司),吲哚美辛(美国Sigma公司),N-硝基-L-精氨酸甲酯(美国Sigma公司),泛影葡胺(上海旭东海普药业有限公司)。
1.2 实验方法
1.2.1 CIN动物模型建立 大鼠禁食、水12 h,水合氯醛腹腔麻醉后,分离左股静脉埋入留置针,依次注射预先配置的吲哚美辛10 mg/kg,15 min后注射左旋硝基精氨酸甲酯(L-NAME)10 mg/kg;15 min 后注射泛影葡胺 10 mL/kg[9]。
1.2.2 实验步骤 将所有大鼠编号,随机分成5组,每组8只,全部大鼠适应性喂养7 d。①空白对照组:造模前3天腹腔注射生理盐水1.5 mL/d,造模当天股静脉每隔15分钟注射生理盐水1.5 mL,共3次。②实验对照组:造模前3天腹腔注射生理盐水1.5 mL/d,造模当天每隔15 min分别注射吲哚美辛10 mg/kg、N-硝基-L-精氨酸甲酯 10 mg/kg、生理盐水 1.5 mL。 ③模型组:造模前3天腹腔注射生理盐水1.5 mL/d,造模当天每隔15分钟分别注射吲哚美辛10 mg/kg、N-硝基-L-精氨酸甲酯10 mg/kg、泛影葡胺10 mL/kg。④rhEPO 1组:造模前3天腹腔注射rhEPO 3000 IU/(kg·d),造模当天同模型组。⑤rhEPO 2组: 造模前 3天腹腔注射 rhEPO 600 IU/(kg·d),造模当天同模型组。每组大鼠分别于造模前、造模后48、72 h时内眦取血测血肌酐(Scr)、尿素氮(BUN),造模后 72 h处死大鼠后迅速取肾,去除肾包膜,于10%甲醛缓冲溶液内固定备作肾组织病理检查(以上均在冰台上操作)。
1.3 肾脏病理及肾小管评分
切片常规脱蜡,HE染色,光镜观察。肾小管评分采用Paller法[10]评分,即根据肾小管扩张程度、肾小管萎缩程度、肾小管上皮细胞空泡变性程度、肾小管上皮细胞坏死程度、间质纤维化程度及肾间质炎症细胞浸润程度的无、轻、中、重分别计0、1、2、3分。每张切片连续观察10个不重叠的高倍视野,并计算平均得分。
1.4 统计学方法
应用SPSS 16.0统计软件进行数据分析,计量资料数据以均数±标准差()表示,各组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾功能指标变化
各组实验前 Scr、BUN无明显差异(P>0.05);空白对照组与实验对照组之间各时间点Scr、BUN无明显差异 (P>0.05);与空白对照组比较,模型组造影后48、72 h Scr较实验前上升>25%,提示造模成功。与空白对照组比较,模型组、rhEPO 1、2 组造影后 48、72 h Scr、BUN 均有明显上升 (P<0.05);与模型组比较,rhEPO1、2 组造影后48、72 h Scr、BUN均有明显下降(P<0.05)。rhEPO 1 组(3000 IU/kg)明显优于小剂量 rhEPO 2 组(600 IU/kg)(P<0.05)。 见表 1、2。
表1 各组大鼠 Scr水平比较(,μmol/L,n=8)
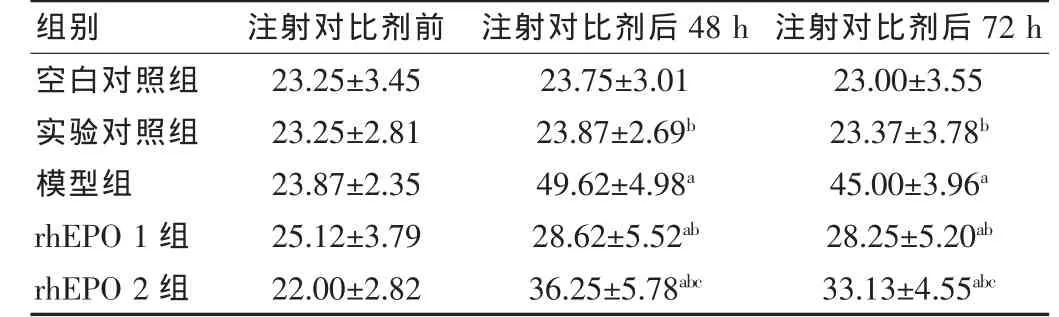
表1 各组大鼠 Scr水平比较(,μmol/L,n=8)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与rhEPO 1组比较,cP<0.05
2.2 HE染色检测肾小管损伤程度
空白对照组可见肾小管上皮细胞无明显损伤,偶见单个肾小管上皮细胞脱落、再生现象,肾小管结构正常(图1)。实验对照组可见肾小球系膜细胞和基质轻度增生,毛细血管袢管腔无压迫,肾小管上皮肿胀(图2)。模型组可见大量肾小管上皮细胞刷状缘脱落、空泡变性、细胞脱落至小管腔,部分肾小管结构破坏,肾小球内皮细胞、上皮细胞肿胀、变性,系膜基质轻度增多,肾间质灶性水肿、炎性细胞浸润(图3),较空白对照组大鼠肾小管上皮细胞损伤评分显著增加 (P<0.05),见表3。rhEPO 1组可见肾小管上皮细胞轻度肿胀,部分空泡变性,肾间质少量炎性细胞浸润,较模型组肾小管上皮细胞损伤明显减轻 (图4),rhEPO 2组可见肾小球系膜细胞和基质中度增生,毛细血管袢管腔无压迫(图5),较模型组肾小管上皮细胞损伤有所减轻,两组与模型组肾小管损伤评分的差异均有统计学意义(P<0.05),rhEPO 1和2组之间肾小管上皮细胞损伤评分差异无统计学意义 (P>0.05),见表3。
表2 各组大鼠BUN水平比较(,mmol/L,n=8)
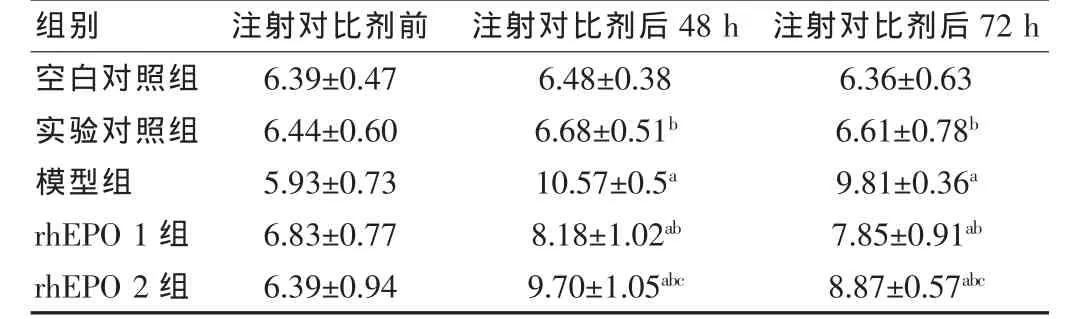
表2 各组大鼠BUN水平比较(,mmol/L,n=8)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与rhEPO 1组比较,cP<0.05
表3 各组大鼠肾小管损伤评分比较(,分)

表3 各组大鼠肾小管损伤评分比较(,分)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05
?
3 讨论
近年来,尽管对比剂不断改良:由离子型到非离子型,由高渗型到等渗型,但由于长期以来依赖碘对比剂的诊治项目不断上升,CIN病例数还在不断增长。对比剂肾病是以使用对比剂后3 d内,发生无其他原因可解释的急性肾减退,通常以血清肌酐上升超过44 μmol/L或较基础值上升 >25%作为诊断标准[11]。
对比剂肾病的发病机制目前尚未完全阐明,综合现阶段的研究成果,主要有肾缺血[12]、肾小管细胞毒性损伤[13]、氧自由基损伤[14]、肾小管阻塞[15]及细胞凋亡。另有学者提出对比剂作为一种过敏原,可能通过刺激血管内皮细胞而激活补体,引起全身过敏反应以及肾脏的免疫反应并最终导致CIN的发生[16-17]。目前有多个药物用于预防CIN,其中,已被证实具有CIN预防作用的药物包括茶碱、维生素C和前列腺E1等,而rhEPO对对比剂肾病的预防作用尚未见报道。
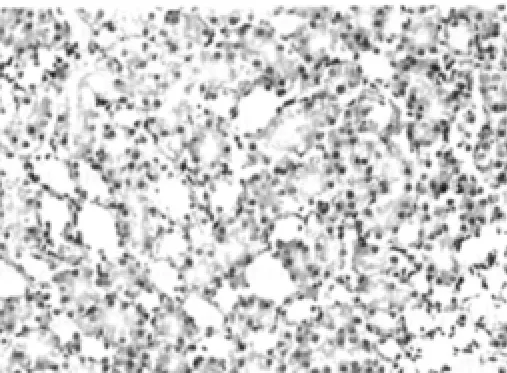
图1 空白对照组大鼠肾脏组织结构(HE,×400)

图2 实验对照组大鼠肾脏组织结构(HE,×400)
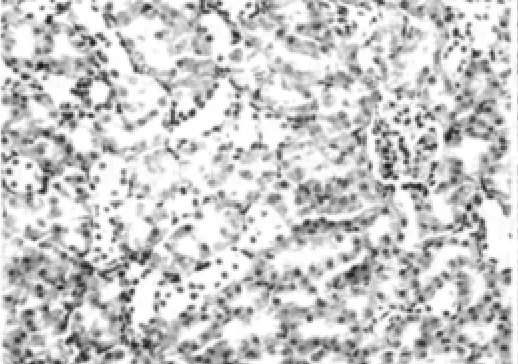
图3 模型组大鼠肾脏组织结构(HE,×400)
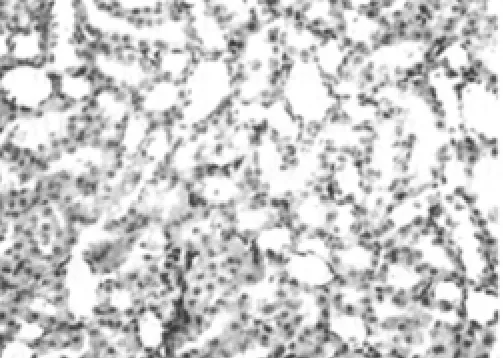
图4 rhEPO 1组大鼠肾脏组织结构(HE,×400)
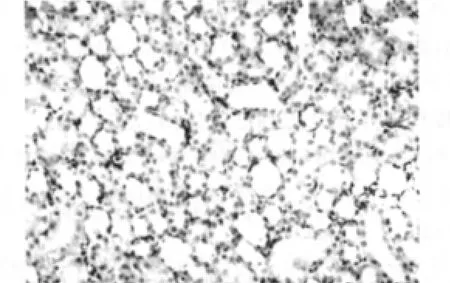
图5 rhEPO2组大鼠肾脏组织结构(HE,×400)
现已发现,EPO不仅具有促进机体生成红细胞的作用,而且还具有多种非造血功能。Li等[17]发现EPO可以降低凋亡蛋白(Bad、Bax)活性,增加抗凋亡蛋白(Bcl-2,Bcl-xL)活性,诱导X染色体相关的凋亡蛋白抑制剂 (XIAP)表达,灭活caspases,保持线粒体膜电位,抑制细胞色素C释放,发挥促细胞生存和抗细胞凋亡效应;Dang等[18]通过动物实验证实给予糖尿病大鼠EPO,可以显著降低肾脏还原型辅酶Ⅱ(NADPH)氧化酶的活性及其p47phox亚基的mRNA水平,发挥抗氧化作用。Shurtz等[19]报道EPO可抑制持续不卧床腹膜透析患者的炎症反应,表现为减少外周血中性粒细胞计数,抑制中性粒细胞激活,减少炎症细胞因子的产生等;Ribatti等[20]发现,EPO能通过抑制缺氧引起的血管内皮细胞凋亡,通过维持和重建血供,促血管生成进而修复组织损伤。Lin等[8]的研究还发现,EPO能通过促进骨髓内Lin-/Sca-T+干细胞增生而促进再灌注损伤后近端肾小管上皮细胞的再生。以上均表明EPO可能是肾小管损伤疾病潜在治疗药物。CIN既存在明显的肾组织缺血缺氧、又有对比剂对肾小管细胞的直接毒性作用,EPO对这种对比剂肾病动物模型是否具有保护作用,目前国内尚未见报道。
本实验参考Agmon等[9]的方法,预先应用吲哚美辛和硝基左旋精氨酸甲酯(L-NAME)阻断前列腺素和一氧化氮合酶,然后注射造影剂,成功建立了对比剂肾病大鼠模型。为排除吲哚美辛和L-NAME对大鼠肾功能是否有影响,笔者专门设置了实验对照组,结果显示,实验对照组Scr、BUN水平及肾损伤评分均与空白对照组无明显差异(P>0.05),提示在本实验条件下吲哚美辛和L-NAME对大鼠肾功能未造成损伤。造模组造影后48、72 h Scr较实验前上升 >25%,肾组织病理切片HE染色可见大量肾小管上皮细胞刷状缘脱落、空泡变性、细胞脱落至小管腔,部分肾小管结构破坏,肾小球内皮细胞、上皮细胞肿胀、变性,系膜基质轻度增多,肾间质灶性水肿、炎性细胞浸润等,提示对比剂肾病大鼠模型是成功的。
在本研究中,各组大鼠(空白对照组除外)肾脏的病理切片中肾小球内的细胞和基质均表现出不同程度的增生,考虑可能与注射吲哚美辛和L-硝基-N-精氨酸甲酯有关,可能机制为:①吲哚美辛可抑制环氧化酶-1(cyclooxygenase-1,COX-1)表达,导致前列腺素(PGs)生成减少[21],而 PGs中的前列腺素 E1(prostaglandin E1,PGE1)可通过抑制血小板的聚集,降低血栓素 A2(thromboxane A2,TXA2)水平,减轻血管内皮的损伤,使血浆内皮素(entholia,ET)水平下降[22]。由于PGs减少导致ET生成增多。②L-NAME可以抑制NO的产生和释放[23],NO不仅能对抗ET的生物学效应,而且负反馈抑制ET的释放[24]。NO减少导致ET分泌增加[25]。而ET又通过自分泌和旁分泌的方式介导多种细胞因子,促进肾小球系膜细胞的增生和细胞外基质的形成[26]。
国内有学者研究了不同剂量EPO对大鼠肾脏缺血再灌注损伤后的保护作用[27],以此为参照,本实验最大剂量采用3000 IU/kg。既往对中风的啮齿类动物模型研究表明,EPO起组织保护作用的最小剂量为500 IU/kg,由于其他组织细胞EPO受体亲和力小于骨髓造血细胞[29],因此本实验最小剂量采用600 IU/kg。
本实验结果显示,在注射造影剂前预先给予rhEPO可明显改善肾功能、减轻肾脏组织病理损伤,这表明rhEPO可有效减轻造影剂所诱导的大鼠急性肾损伤。实验表明,不同剂量rhEPO给药干预均能使大鼠肾功能得到明显的保护,但通过对肾功能和组织形态学的比较发现,大剂量给药组效果优于小剂量给药组,但是rhEPO各干预组之间肾小管损伤评分并没有明显差异,分析可能是由于病理切片的选材、切片制作及实验样本量较小的原因。
综上所述,在本实验条件下,rhEPO对造影剂诱导的大鼠急性肾损伤有保护作用,无论是从生化检测还是从组织形态学方面都得到了证实,且大剂量干预组优于小剂量干预组。这种作用可能是通过抗凋亡、抗氧自由基、减轻炎症反应、血管修复及促进肾小管细胞再生的协同机制来实现的,相信更多的依据将在以后的实验中证实。鉴于rhEPO在治疗肾性贫血中已得到广泛应用,且副作用较小,应用方便,故应用于预防CIN的前景良好。但随着rhEPO应用剂量的增加,其带来的副作用也随之增加,诸如血栓形成、高血压等,因此临床上用于预防CIN的最佳合理剂量尚需更多的临床研究加以评价。
[1]Nash K,Hafeez A,Hou S.Hospital-acquired renal insufficiency[J].Am J Kidney Dis,2002,39:930-936.
[2]Mccullough PA,Wolyn R,Rocher LL,et al.Acute renal failure after coronary intervention:incidence,risk factors,and relationship to mortality[J].Am J Med,1997,103:368-375.
[3]Toba H,Sawai N,Morishita M,et al.Chronic treatment with recombinant human erythropoietin exerts reno protective effects beyond hemato poiesis in streptozotocin-induced diabetic rat[J].Eur J Pharmacol,2009,612(1-3):106-114.
[4]Brines M,Cerami A.Erythropoietin mediated tissue protection: reducing collateral damage from the primary injury response[J].J Intern Med,2008,264(5):405-432.
[5]Gorio A,Gokmen N,Erbayraktar S,et al.Recombinant human erythro-poietin counteracts secondary injury and markedly enhances neurological recovery from experimental spinal cord trauma [J].Proc Natl Acad Sci USA,2002,99:9450-9455.
[6]Ribatti D,Presta M,Vacca A,et al.Human erythropoietin induces a poranrgiogenic phenotype in cultured endothelial cells and stimulates neovascularization in vivo[J].Blood,1999,93:2627.
[7]Toba H,Sawai N,Morishita M,et al.Chronic treatment with recombinant human erythropoietin exerts reno protective effects beyond hemato poiesis in streptozotocin-induced diabetic rat[J].Eur J Pharmacol,2009,612(1-3):106-114.
[8]Lin F,Cordes K,Li L,et al.Hematopoietic stem cells contribute to the regeneration of renal tubules after renal ischemia-reperfusion injury in mice[J].J Am Soc Nephrol,2003,14:1188-1199.
[9]Agmon Y,Peleg H,Greenfeld Z,et al.Nitric oxide and prostanoids protect the renal outer medulla from radiocontrast toxicity in the rat[J].J Clin Invest,1994,94(3):1069-1075.
[10]Paller MS,Hoidal JR,Ferris TF.Oxygen Free Radicals in ischemicacute renal failure in the rat[J].J Clin Invest,1984,74:1156-1164.
[11]MorcosSK,Thomsen HS,Webb JA,et al.Contrast-media-induced nephrotoxicity:a consensus report[J].Eur Radiol,1999,9(8):1602-1613.
[12]Heyman SN,Brezis M,Epstein FH,et al.Early renal medullar hypoxic injury from radio contrast and indo methacin[J].Kidney Int,1995,40(3):632-642.
[13]Hoh Y,Yano T,Sendo T,et al.Involvement of denovo ceramide synthesis in radio contrast induced renal tubular cell injury E [J].Kidney Int,2006,69(2):288-297.
[14]Dounousi E,Papavasiliou E,Makedou A,et al.Oxidative stress is progressively enhanced with advancing stages of CKD [J].Am J Kidney Dis,2006,48(5):752-760.
[15]Persson PB,Tepel M.Contrast medium-induced nephropathy:the pathophysiology[J].Kidney Int,2006,(Suppl 1):8-10.
[16]Steven F,John D,Kevin M,et al.N-acetyl cysteine in the prevention of radio contrast-induced nephropathy[J].J Am Soc Nephrol,2004,15(2):251-259.
[17]Li F,Chong ZZ,Maiese K.Erythropoietin on a tightrope:Balancing neuronal and vascular protection between intrinsic and extrinsic pathways[J].Neurosignals,2004,13(6):265-289.
[18]Dang J,Jia R,Tu Y,et al.Erythropoietin prevents reactive oxygen species generation and renal tubular cell apoptosis at high glucose level[OL].http://dx.doi.Org/10.1016/j.biopha.2010-06-11.
[19]Shurtz SR,Kristal B,Shasha SM,et al.Interaction between erythropoietin and peripheral polymorphonuclear leukocytes in continuous ambulatory diaysis patients[J].Nephron,2002,91(4):759-761.
[20]Ribatti D,Presta M,Vacca A,et al.Human erythropoietin induces a poranrgiogenic phenotype in cultured endothelial cells and stimulates neovascularization in vivo[J].Blood,1999,93:2627.
[21]孔维信,顾勇,马骥.肾大部切除大鼠肾皮质环加氧酶2的表达及调节[J].复旦学报,2005,32(11):6-17.
[22]迟志波.前列腺素E1对糖尿病慢性并发症及血浆内皮素的影响[J].实用糖尿病杂志,2005,1(5):55-56.
[23]Sosnovtseva OV,Pavlov AN,Pavlova ON,et al.The effect of L-NAME on intra-and inter-nephron synchronization[J].Eur J Pharm Sci,2009,36(1):39-50.
[24]孙奥丽,孙永波,孙海峰.内皮舒张因子和内皮素之间调控关系动物实验研究[J].医学研究杂志,2007,36(3):61-63.
[25]唐玉琼,何小解.内皮素与一氧化氮对肾病大鼠系膜细胞增生的影响[J].中国现代医学杂志,2002,12(19):12-15.
[26]云鹰,曹广海.清热解毒、化瘀通络方对系膜增生性肾炎大鼠肾组织肿瘤坏死因子α、内皮素1的影响[J].中国中西医结合儿科学,2010,2(3):231-234.
[27]杨橙,胡林昆,赵天.重组人促红细胞生成素对大鼠肾脏缺血再灌注损伤的保护作用[J].复旦学报,2010,37(5):539-543.
