MMP-9及Hpa的表达与胃肠间质瘤的螺旋CT征象的相关性研究
2012-07-28许春苗张占东吕慧娟陈学军花亚伟黎海亮
许春苗 张占东 吕慧娟 陈学军 花亚伟▲ 黎海亮▲
1.河南省肿瘤医院放射科,河南 郑州 450008;2.河南省肿瘤医院普外科,河南 郑州 450008;3.河南省肿瘤医院内科,河南 郑州 450008
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一组主要发生于胃肠道的含有梭形细胞、上皮样细胞的肿瘤。GIST富于表达CD117,可能起源于 Cajal间质细胞[1-2],涵盖了绝大部分胃肠道原发性间叶源性肿瘤。影像学检查与病理学检查均是研究胃肠间质瘤的重要手段,胃肠间质瘤的影像学表现有其特定的病理学基础。随着影像技术的不断进步,将肿瘤的影像学表现和肿瘤分子生物学有机地结合起来共同评价肿瘤的各种特征已成为现实。本研究旨在探讨胃肠间质瘤的螺旋CT征象与MMP-9、Hpa在胃肠间质瘤中的表达以及彼此之间的关系,宏观结合微观,将有可能提高胃肠间质瘤侵袭、转移和预后的评估准确性。
1 材料与方法
1.1 组织标本
收集2005年1月~2008年4月河南省肿瘤医院收治的胃肠道及胃肠道外间质瘤54例。其中,男23例,女31例,年龄33~78岁,中位年龄49岁;按部位胃34例,小肠11例,直肠2例,肠系膜3例,腹膜后4例;术后均经病理诊断证实。所有病例术前均未进行任何化学和放射治疗,手术切除包括全部54例肿瘤组织和距肿瘤5 cm以上的正常组织,并且于离体30 min内取材。所有标本常规固定、包埋、连续4 μm厚度切片,备HE染色、免疫组化用。
1.2 方法
1.2.1 螺旋CT检查
1.2.1.1 螺旋CT检查方法 术前54例均行腹部和(或)盆腔螺旋CT平扫,均行双期增强扫描。采用GE Lightspeed Ultra多层螺旋CT扫描仪,一次可采集32层。禁食8 h,口服清水500~800 mL;取仰卧或俯卧位,先行常规平扫,再使用高压注射器以3.0~4.0 mL/s流率经肘静脉注入非离子对比剂(优维显或欧乃派克,300 mgI/mL)90~100 mL,注入对比剂后于35 s及65 s各扫描1次,分别获得动脉期、门静脉期图像。扫描参数:120 kV,200~260 mAs,层厚 5.0 mm。
1.2.1.2 CT诊断标准 根据文献[3-4],胃肠道间质瘤的CT诊断依据和确立诊断的过程可概括为:①CT检查发现的位于腹部实质器官外的肿块,倘其形态表现符合GIST3个类型之一,临床上无外伤史或相关的内分泌疾病症状的都应初步疑及此病;②如能检出该肿块长自胃肠壁且无腹腔的淋巴结转移的,可提出此病的初诊;③CT导向下作肿块穿刺活检,可争取得到术前确诊;良性者,肿瘤直径多≤5 cm,边界清楚,密度均匀,可见单个坏死灶。下列征象常提示恶性:肿块直径>5 cm;肿瘤边缘有分叶;瘤体内有多个片状坏死或大块坏死;肿瘤的溃疡大而深;肿瘤内可见点状、条状粗乱的肿瘤血管;瘤体内有散在分布的细小钙化点;周围组织侵犯或远处转移,常见肝脏及系膜转移,而淋巴结转移少见。
1.2.1.3 远处转移的标准 肝脏出现单发或多发环形晕样强化的相对低密度影则认为肝转移;腹水、腹膜增厚异常强化或腹壁结节均认为腹膜转移。
1.2.1.4 结果判定 采用双盲法,由三位高年资放射科医生分别阅片进行胃肠间质瘤的CT分期,并将结果与病理对照。详细记录肿瘤显示的层数及强化特点、浸润的深度及邻近脏器的侵犯、转移淋巴结的有无及其强化特点。
1.2.2 免疫组织化学染色
1.2.2.1 载玻片处理 载玻片肥皂水洗涤干净后晾干,硫酸清洁液浸泡24 h后自来水冲洗干净,晾干;95%酒精浸泡24 h后晾干;均匀涂抹APES,晾干,4℃冰箱保存。
1.2.2.2 标本准备 HE染色,镜下病理诊断、分型、分级、肿瘤组织定位,将定位后的切片与其蜡块相对应,只留3~4 mm直径的肿瘤组织区域,削去其余组织,重新包埋,连续切片,留作免疫组化染色用。所有切片置于4℃冰箱保存备用。
1.2.2.3 对照组设计 用已知MMP-9及Hpa阳性表达的切片做阳性对照,以PBS代替一抗为阴性对照。
1.2.2.4 阳性结果判断标准 MMP-9及Hpa的染色颗粒阳性表达定位于肿瘤细胞的胞浆,有时亦见于胞膜,细胞核偶见染色。免疫组化染色结构清晰,着色明显高于背景,在相应部位出现棕黄色颗粒者为阳性细胞,不着色或显色强度与背景无差别者为阴性细胞。
1.3 统计学方法
所有数据均采用SPSS 11.0统计学软件处理,阳性率之间的比较采用χ2检验。两变量之间的关系分析采用Spearman等级相关分析表示。以P<0.05为差异有统计学意义。
2 结果
2.1 螺旋CT结果
主要观察其大小、形态、密度边缘、中心坏死和有无转移。肿块绝大多数呈类圆形或椭圆形,最大径3~20 cm,平均11.5 cm。肿块>5 cm者17例,其中15例为恶性。位于消化道23例中,腔外生长为主者19例,腔内生长者4例。6例肿块腔面见明显凹凸不平,表现为黏膜溃疡,增强后显示溃疡周围黏膜完整,与发生于黏膜的癌弥漫侵犯黏膜明显不同,在双期增强扫描中,肿瘤呈中度至明显强化,绝大多数实质部分呈明显强化,坏死不强化,多数表现为多灶性不规则坏死或溃疡19例。坏死灶通常较大,一般在1.0~3.0 cm。肿瘤实质部分动脉期CT值为42~105 Hu(平均62.3 Hu);静脉期CT值为64~138 Hu(平均82.5 Hu),表现为静脉期强化明显。3例瘤体内见动脉期出现点、条状强化的肿瘤血管影。螺旋CT和术后病理相比较,对胃肠间质瘤恶性程度的符合率为85%;对有无转移的诊断符合率为93%。
2.2 免疫组化结果
2.2.1 胃肠间质瘤中MMP-9及Hpa表达与CT征象间关系
本组结果显示MMP-9及Hpa在胃肠间质瘤中的表达在患者年龄(<50岁和≥50岁)、肿块形态中(圆、椭圆形和分叶状)均无统计学意义。在恶性程度、肿块大小(<5cm和≥5cm)、肿块边界(清楚和不清楚)、中心有无坏死、有无转移均有统计学意义(均P<0.05)。见表1。
2.2.2 胃肠间质瘤中MMP-9和Hpa表达的相关性
39例MMP-9阳性表达的胃肠间质瘤中36例Hpa呈阳性表达,13例MMP-9阴性表达的胃肠间质瘤中8例Hpa亦呈阴性表达,二者在胃肠间质瘤中的表达有明显的相关性(r=0.379,P<0.05),见表2。MMP-9阳性表达呈颗粒状,定位于胞浆(图1)。Hpa表达呈细砂粒状,表达较弱,异质性分布(图2)。
3 讨论
3.1 螺旋CT在GIST诊断中的作用
CT检查尤其是螺旋CT快速、方便易行、基本无创伤、密度分辨率最高,能直接显示肿瘤本身的大小、形态、密度、内部结构、边界,对邻近结构的侵犯也显示得相当清楚;同时还可以观察其他部位的转移灶,有利于肿瘤的诊断、分期及鉴别诊断,是GIST最有意义的检查方法之一,为手术方案的制定提供必要的影像信息,尤其是对向胃肠道外生长或同时向腔内外生长的GIST更有意义[5-6]。增强CT可见均匀等密度者多呈均匀中度或明显强化,螺旋CT尤其以静脉期显示明显。这种强化方式多CT平扫发现肿瘤多呈圆形或类圆形,少数呈不规则形。良性者肿瘤多小于5 cm,密度均匀,边缘清晰锐利。极少侵犯邻近器官,可以有钙化表现(见图3、4)。恶性者,大多数肿瘤大于6 cm,边界不清,与邻近器官粘连,可呈分叶状,密度不均匀,中央极易出现坏死、囊变和出血(见图5)。坏死、囊变者常表现肿瘤周边实体强化明显[7]。肿块侵犯周围脏器是不宜手术的标志之一,Takao等[9]总结胃肠道恶性肿瘤浸润深度的螺旋CT的表现,认为当肿瘤及邻近器官时,肿块与周围脏器之间脂肪层消失是最重要的征象之一。Lee等[8]也认为CT检查GIST等同或优于钡餐和内镜检查,也有学者螺旋CT对邻近脏器有无侵犯,仍难区分,尤其是脏器周围脂肪层明显减少的消瘦者,更为困难,造成螺旋CT术前肿瘤可否切除的过估[9]。本组螺旋(增强)CT和术后病理相比较,对胃肠间质瘤恶性程度(良性或交界性、恶性)的符合率为85%;对有无转移的诊断符合率为93%。通过对上述肿瘤特征的分析可初步判断GISTs的恶性程度及预后,所以笔者认为MSCT对GISTs影像特征、恶性GISTs转移、播散模式研究有重要诊断价值

表1 胃肠间质瘤中MMP-9及Hpa的表达与其CT征象间关系

表2 胃肠间质瘤中MMP-9和Hpa表达的相关性(例)
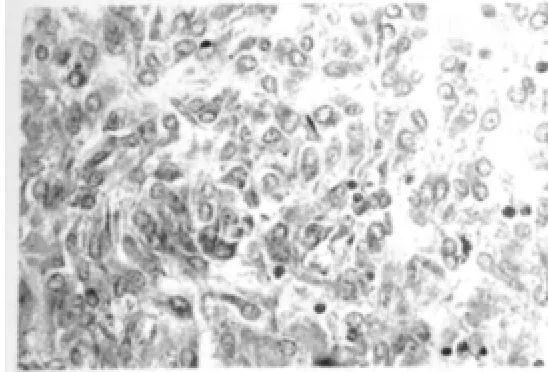
图1 肿瘤细胞中MMP-9阳性表达(SP 法,400×)

图2 肿瘤细胞中HPA蛋白阳性表达(SP 法,400×)
3.2 螺旋CT与胃肠间质瘤分子生物学的关系

图3 胃底内生型软组织肿块(内可见钙化,术后病理为胃底内生型良性间质瘤)
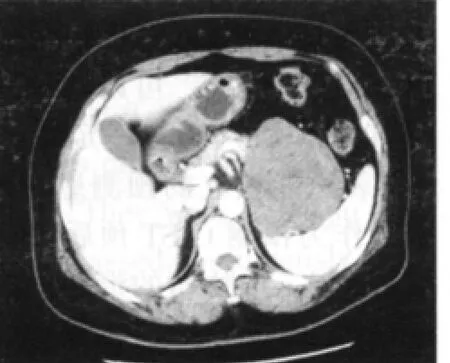
图4 胰尾区软组织肿块(边界清晰,内见少许囊变区,术后病理为胃底外生型良性间质瘤)
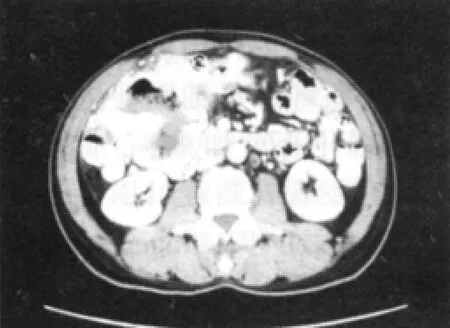
图5 腹腔内囊实性肿块(内可见液气平,与相邻肠管无明确分界)
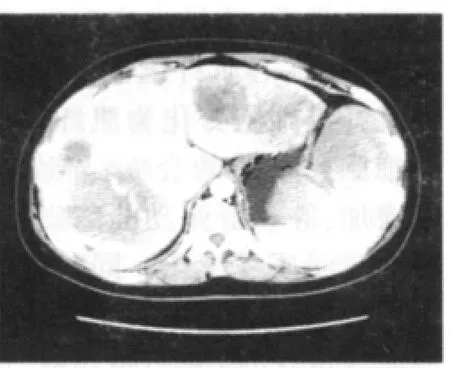
图6 肝脾多发转移(术后病理为小肠恶性间质瘤)
螺旋CT图像能够较为可靠的反映胃肠间质瘤的病理学特性,例如肿瘤的大小、厚度、强化方式、浸润生长的程度、远处转移(图6)及淋巴结转移等,因此胃肠间质瘤的螺旋CT表现与病理学特性有着密切关系,是肿瘤组织病理特点的比较直接、客观的反映。随着现代分子生物学技术的发展,对胃肠间质瘤的认识已更加深入,从而能够使解释胃肠间质瘤的发生、发展、浸润转移成为可能,并有助于解释胃肠间质瘤影像学表现的多样性和复杂性。分子影像学广义上定义是在体内,从细胞和分子水平,对生物过程进行特征性地描述和测量。与传统影像学不同,它不是以异常分子改变的结果为对象,而是以异常的分子改变为对象[10]。
MMP-9是降解Ⅳ型胶原的重要蛋白酶;在肿瘤细胞对细胞外基质的降解、对周边组织的侵袭过程中发挥着重要的作用,同时作为血管发生启动系统的一名成员影响肿瘤新生血管的生成[11]。国外研究发现,在恶性黑色素瘤、子宫内膜癌、前列腺癌和原发性脑肿瘤等不同肿瘤中,MMP-9的激活和(或)表达与肿瘤恶性程度和(或)转移有很好的相关性[12],在GIST中报道尚少。本研究结果表明MMP-9表达与GIST恶性程度相关。在良性和交界性、恶性GIST之间MMP-9的表达阳性率分别为51.4%和84.2%,其差异有统计学意义(P<0.05)。MMP-9阳性表达在肿瘤边界、肿块大小、肿瘤中心有无坏死、有无转移中差异有统计学意义(P<0.05)。结果提示MMP-9的过度表达可以降解细胞外基质及基底膜,水解血管基底膜,使血管通透性增高,导致肿瘤的局部浸润和远处转移。
乙酰肝素酶 (heparanase,Hpa)是一种裂解糖氨聚糖中HS链的内切糖苷酶,在细胞侵袭中起着极其重要的作用。但在GIST中报道尚少。本研究结果表明,随着高恶性程度的GIST Hpa表达增加。在良性和交界、恶性GIST之间Hpa的表达阳性率分别为48.6%和78.9%,其差异有统计学意义(P<0.05)。Hpa阳性表达在肿瘤边界、肿块大小、肿瘤中心有无坏死、有无转移中差异有统计学意义(P<0.05)。结果提示Hpa的过度表达参与了GIST的局部浸润和远处转移。
本研究结果显示,在GIST中HPA与MMP-9的表达呈正相关(P<0.01),提示两者在GIST的发生发展过程中的作用密切相关,可能通过协同作用促进肿瘤的发生、肿瘤细胞外基质的降解和肿瘤细胞的侵袭转移。HPA、MMP-9的阳性表达患者与阴性表达患者的5年生存率差异有高度统计学意义(P<0.01)。 可以认为,HPA、MMP-9对以浸润、转移的GIST的预后判断有一定意义,多因素分析表明,HPA、MMP-9共表达能独立的预测患者5年生存率。因此,HPA、MMP-9可以作为预测GIST预后较好的客观指标。
总之,对肿瘤的形态、定性及远处转移诊断,螺旋CT和病理检查有很好的一致性,说明螺旋CT的诊断结果准确可信;螺旋CT征象与分子生物学相结合,宏观结合微观,将有可能提高GIST侵袭、转移和预后评估的准确性。
[1]Paul PC,Chakraborty J,Kundu D,et al.Gastrointestinal stromal tumourrole of CD117 in diagnosis and management[J].Indian J Pathol Microbiol,2007,50(2):279-283.
[2]Kitamura Y.Gastrointestinal stromal tumors:past,present,and future[J].Gastrointestinal,2008,43(7):499-508.
[3]Orlichenko LS,Radisky DC.Matrix metalloproteinases stimulate epithelial-mesenchymal transition during tumor development[J].Clin Exp Metastasis,2008,25(6):593-600.
[4]Castiglioni T,Merino MJ,Elsner B,et al.Immunohistochemical analysis of cathepsinsD,B,andLinhumanbreastcancer[J].HumPathol,1994,25:857.
[5]张贺香,王成林,邹立秋,等.胃肠道间质瘤的病理特点及CT表现对照研究[J].罕少疾病杂志,2007,14(5):44-46.
[6]延宏,单裕清.螺旋CT扫描对胃肠道间质瘤的诊断及其病理诊断[J].中国 CT 和 MRI杂志,2006,4:28-29.
[7]Levy AD,Remotti HE,Thompson WM,et al.From the archieves of the AFIP gastrointestinal stromal tumors:radiologic feature with pathologic correlation[J].Radio Graphics,2003,23:283-304.
[8]Lee MW,Kim SH,Kim YJ,et al.Gastrointestinal stromal tumor of the stomach:preliminary results of preoperative evaluation with CT gastrography[J].Abdom Imaging,2008,33(3):255-261.
[9]Takao H,Yamahirak,Doi I,et al.Gastrointestinal stromal tumor of the retroperitoneum:CT and MR findings [J].Eur Radiol,2004,14:1926-1929.
[10]Weissleder R,Mahmood U.Molecular imaging[J].Radiolog,2001,219:316-333.
[11]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[12]Shojaku H,Futatsuya R,Seto H,et al.Malignant gastrointestinal stromal tumor of the small intestine:radiologic-pathologic correlation[J].Radiat Med,1997,15(3):189-192.
