冠状动脉介入治疗对冠心病患者血浆白细胞介素-6和肿瘤坏死因子α水平的影响
2012-07-28刘丽军信栓力马燕霞邵丽莉张兰华齐秀芳牛丽杰李书香
刘丽军 信栓力 常 超 马燕霞 邵丽莉 张兰华 齐秀芳 牛丽杰 李书香 刘 镜
1.河北省邯郸市第一医院心内科,河北 邯郸 056002;2.河北省邯郸市峰峰矿区中医院外科,河北 邯郸 056200;3.冀中能源邯郸矿业集团聚隆矿业有限公司医务室,河北 邯郸 056305
在我国,冠心病是最常见的心脏病,且其致残率、致死率日趋增高,并向低龄化方向发展。经皮冠状动脉介入治疗已成为冠心病治疗的主要手段,但与此同时,冠脉支架内再狭窄也成为新的难点和焦点,其确切机制尚不完全清楚。大量研究表明,慢性炎症是动脉粥样硬化的病原学特点,动脉粥样硬化是由血管紧张素Ⅱ,炎性细胞因子和游离脂肪酸等物质介导形成,这些物质促进血管内皮细胞和平滑肌细胞产生活性氧自由基,进而通过几种途径造成内皮损伤,使内皮功能失调,脂质沉积和血小板黏附、聚集形成粥样斑块[1-2]。白细胞介素-6(interlekin-6,IL-6)是一种具有多种生物活性的细胞因子,是炎症反应的重要递质,在冠心病发病的炎症反应中起着重要作用[3]。肿瘤坏死因子α(tumor necrosis factor a,TNF-α)是一种关键性的炎症介质,主要由活化的巨噬细胞产生的细胞因子,直接损伤血管内皮细胞,使内皮细胞通透性增高,使血浆胆固醇易穿透内膜在管壁内沉积形成动脉粥样斑块,在冠心病发病的炎症反应中起着重要的作用[4]。本研究通过测定冠心病患者行冠状动脉介入治疗前后IL-6及TNF-α血浆水平,分析冠状动脉支架术对冠心病患者炎症指标的影响。
1 资料与方法
1.1 一般资料
选择2011年3~11月我院心内科接受冠状介入治疗单支病变的冠心病患者70例为冠脉介入组,其中男42例,女28 例;年龄 49~70 岁,平均(60.0±3.8)岁。同时选择 30 例冠状动脉造影正常者作为对照组,其中男18例,女12例,年龄48~71 岁,平均(59.0±3.1)岁,患者及家属对治疗知情同意,并经医院伦理委员会批准。各组性别、年龄等一般资料差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
对每例入选者进行冠心病危险因素调查,包括吸烟、高血压、糖尿病、血三酰甘油(TG)、总胆固醇(TC)等。排除标准:有冠脉旁路移植和准备行冠脉旁路移植者、风湿性心脏瓣膜病、急慢性感染、严重肝肾功能不全、恶性肿瘤、自身免疫性疾病、脑血管、外周血管疾病、服用维生素类药物、雌激素缺乏者均不纳入研究范围。入选冠心病患者近1月内均服用他汀类药物(阿托伐他汀20 mg,晚上口服1次)和血管紧张素转化酶抑制剂(ACEI)类药物(苯那普利10 mg,每日口服1次)及拜阿司匹林、波立维等其他常规用药。
1.3 标本采集
所有入选者于入院第1天采集外周空腹静脉血10 mL,常温离心取血浆置-70℃冰箱保存,3个月内同批检测。
1.4 血浆IL-6和TNF-α测定
采用酶联免疫吸附(ELISA)法检测血浆IL-6和TNF-α(药盒购自深圳晶美公司),用抗人单克隆抗体预包被酶联板,加入待测样品及样标品,再加酶标抗体,催化显色,使用美国Bio-Rad公司生产MODEL全自动酶联检测仪测光密度值,根据标准曲线测得待样品浓度(单位为pg/L或ng/mL)。
1.5 统计学方法
采用统计软件SPSS 13.5对实验数据进行分析,计量资料数据以均数±标准差()表示,采用方差分析,两两比较采用t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者冠心病危险因素比较
入选两组间冠心病危险因素糖尿病、高血压、吸烟、TG、TC方面差异均有统计学意义(P<0.05或P<0.01),见表1。
2.2 两组患者血浆IL-6和TNF-α水平比较
冠脉介入组术后血浆IL-6、TNF-α水平和术前比较,差异均有高度统计学意义(均P<0.01);对照组术前IL-6、TNF-α水平和术后比较差异无统计学意义 (P>0.05),见表2。
表1 两组冠心病危险因素比较(,mmol/L)
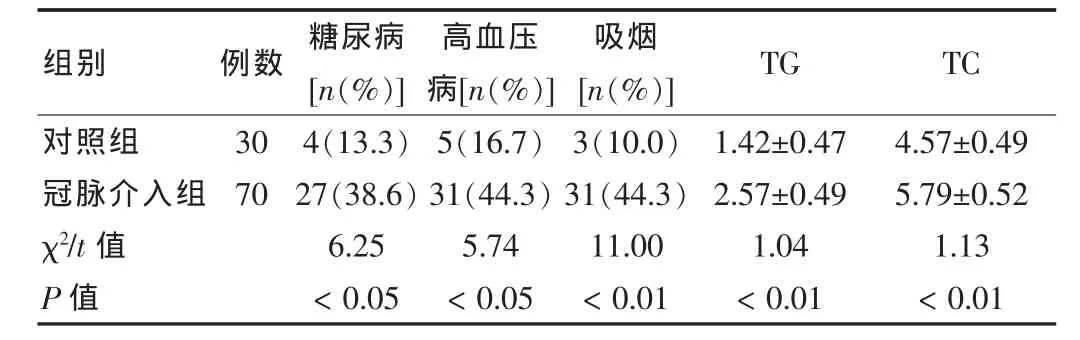
表1 两组冠心病危险因素比较(,mmol/L)
组别 例数 糖尿病[n(%)]高血压病[n(%)]吸烟[n(%)] TG TC对照组冠脉介入组χ2/t值P值30704(13.3)27(38.6)6.25<0.055(16.7)31(44.3)5.74<0.053(10.0)31(44.3)11.00<0.011.42±0.472.57±0.491.04<0.014.57±0.495.79±0.521.13<0.01
表2 两组血浆IL-6和TNF-α水平比较()

表2 两组血浆IL-6和TNF-α水平比较()
注:与同组术前比较,aP<0.01
组别 IL-6(pg/L)术前 术后TNF-α(ng/mL)术前 术后冠脉介入组(n=70)对照组(n=30)18.35±4.4112.14±3.9821.49±4.45a 13.07±4.1212.56±4.1310.45±3.7515.67±4.25a 11.23±3.87
3 讨论
IL-6是一种具有多种生物活性的细胞因子,是炎症反应的重要递质,在冠心病发病的炎症反应中起着重要的作用[5]。研究同时发现前炎症介质IL-6促使肝脏合成急性期蛋白超敏C反应蛋白,增加血液中急性期蛋白浓度,使炎症效应进一步扩大[1]。Verma等[6]也发现,IL-6可以诱导超敏C反应蛋白在内皮细胞上表达增加,而超敏C反应蛋白的表达过程也可以被特异性的IL-6抑制剂终止,超敏C反应蛋白与冠心病斑块的不稳定关系密切,超敏C反应蛋白聚集后结合低密度脂蛋白,使补体激活,同时超敏C反应蛋白和单核细胞的C反应蛋白受体结合,共同造成血管内皮损伤,诱导血小板聚集,形成不稳定斑块[7]。Wassmann等[8]发现IL-6促进巨噬细胞表面低密度脂蛋白受体合成及巨噬细胞对低密度脂蛋白摄取,加速脂质沉积,因此IL-6和不稳定斑块密切相关,同时IL-6可激活巨噬细胞分泌单核细胞趋化蛋白,诱导单核细胞突破血管内皮细胞,参与不稳定斑块形成,加速动脉硬化。本实验结果提示冠脉介入组IL-6术后与术前相比,有明显增高,差异有高度统计学意义(P<0.01),而对照组造影术后与术前比较,IL-6没有明显变化(P>0.05),探其原因可能与球囊扩张、支架植入对冠脉内皮的损伤密切相关,是否与支架内再狭窄有关尚需进一步验证。
TNF-α是机体一种具有多种功能的炎症细胞因子,可导致炎症、细胞坏死和新血管的形成,并促进内皮素产生而导致血管壁的损伤,因而具有促动脉粥样硬化作用[9]。也有研究表明TNF-α破坏血管内皮细胞结构的完整性,诱导单核细胞趋化因子等炎性介质表达,引导血小板附着,促进血栓形成,同时参与平滑肌细胞增殖、分化以及调控,最终导致斑块不稳定,促进动脉粥样硬化形成[10]。笔者观察到冠脉介入组术后TNF-α较术前增高,差异有高度统计学意义 (P<0.01),而对照组造影术后TNF-α与术前比较,差异无统计学意义(P>0.05)。笔者认为支架机械性扩张会一定程度地损伤血管内膜,使斑块破裂、内皮细胞受损,球囊的扩张,增加了病变夹层和栓塞的可能性,因此减少球囊扩张的次数,也就减轻了对血管壁的损伤,缩短了心肌缺血时间及对心肌的损伤,同时加服他汀类药物,能否减少支架内再狭窄尚待进一步观察。
目前已有大量研究表明,炎症可能在动脉粥样硬化的始发和发展过程中扮演重要角色,也强烈提示冠脉粥样硬化是一种炎症性疾病。冠脉支架介入治疗后再狭窄的具体机制目前尚未完全了解,但很多资料提示炎症通路在冠心病的不同阶段都发挥着重要作用,同样炎症介质表达在支架内再狭窄的发生中也发挥重要作用,既然炎症通过内膜增殖在支架内再狭窄过程中起着关键作用,使用抗炎药物、抗增殖及抗氧化剂的药物在降低支架内再狭窄及抗动脉粥样硬化方面可能发挥重要作用。
[1]Ross R.Atherosclerosis-an inflammatory disease [J].N Eng J Med,1999,340(2):115-126.
[2]Rodondi N,Marques VP,Butler J,et al.Markers of atherosclerosis and inflammation for prediction of coronary heart disease in older adults[J].Am J Epidemiol,2010,171(5):540-549.
[3]Noto D,Cotton S,Baldassare CA,et al.Interleukin 6plasma levels predict with high sensitivity and specificity coronary stenosis detected by coronary angiography[J].Thromb Haemost,2007,98(6):1362-1367.
[4]Baseman Y,Bassmn MM,Babacank F,et al.Serum tumor necrosis factor levels in acute myocardial infarction and unstable angina pectoris[J].Angiology,1993,44(4):332-337.
[5]Lai CL,Ji YR,Liu XH,et al.Relationship between coronary atherosclerosis plaque characteristics and high sensitivity C-reactive proteins,interleukin-6[J].Chin Med J,2011,124(16):2452-2456.
[6]Verma S,Li SH,Badiwala MV,et al.Endothelin antagonism and interleukin-6 inhibition attenuate the proatherogenic effects of C-reactive protein[J].Circulation,2002,105(16):1890-1896.
[7]Venugopal SK,Devaraj S,Jialal I.Efect of C-reactive protein on vascular cells:evidence for a proinflammatory,proatherogenic role [J].Curr Opin Ncphrol Hypertens,2005,14(1):33-37.
[8]Wassmann S,Stumpf M,Strehlow K,et al.Interleukin-6 induces oxidative stress and endothelial dysfunction by overexpression of the angiotensin Ⅱ type l receptor[J].Cite Res,2004,94(4):534-541.
[9]Kempf K,Haltern G,Futh R,et al.Increased TNF-alpha and decreased TGF-beta expression in peripheral blood leukocytes after acute myocardial infarction[J].Horm Metab Res,2006,38(5):346-351.
[10]Chu H,Yang J,Mi S,et al.Tumor necrosis factor-alpha G-308 A polymorphism and risk of coronary heart disease and myocardial infarction:A case-control study and meta-analysis[J].J Cardiovasc Dis Res,2012,3(2):84-90.
