多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致大鼠肾脏系膜细胞细胞外基质沉积中的作用
2012-07-28朱恒梅祝胜郎陈结慧李向阳
朱恒梅 祝胜郎 陈结慧 叶 玲 蒋 莹 李向阳
广东省深圳市第六人民医院肾内科,广东 深圳 510082
高血糖作为糖尿病的最基本生化特性,通过多种机制引起糖尿病肾病(diabetic nephropathy,DN),其中氧化应激是一个重要损伤机制。而有研究发现高血糖介导的ROS可以激活多聚 ADP 核糖聚合酶 [poly (ADP-ribose)polymerase,PARP][1]。PARP是一种存在于除酵母外所有真核细胞核内对DNA断裂敏感的蛋白酶,目前其在DN发病机制中的作用尚未完全阐明。DN时,肾小球系膜细胞是多种致病因子作用的主要靶细胞,主要表现为肾小球的肥大、细胞外基质的堆积、肾小球基底膜的增厚和肾小球滤过屏障功能的异常,其中肾脏细胞外基质(extracellular matrix,ECM)的蓄积引起的肾小球硬化与间质纤维化是DN发展至终末期肾功能衰竭的主要病理表现[2]。因此本实验以大鼠肾脏系膜细胞作为研究对象,探讨多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致外细胞基质沉积中的作用,以探讨PARP在DN发生发展中的作用。
1 材料与方法
1.1 材料
D-Glucose购自Sigma公司,PJ34购自默克公司;细胞培养用RPMI 1640,胎牛血清购自Gibco公司;Trizol溶液购自美国Invitrogen公司;胰岛素购自甘李药物公司,Trizol Reagent购自Invitrogen公司;细胞裂解液、HRP标记的兔抗大鼠Ⅱ抗、小鼠抗大鼠Ⅱ抗购自Cell signaling公司,小鼠抗大鼠COLⅣ、FN一抗,兔抗大鼠PARP-1一抗购自CHEMICON公司;PARP/Apoptosis检测试剂盒购自trevigen公司;RevertAidTM FirstStrand cDNA逆转录试剂盒购自Fermentas公司,Taq DNA聚合酶购自Takaka公司。其余化学试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养及分组 大鼠肾脏系膜细胞株 (MCs 1097,购自美国ATCC公司)培养于含有15%胎牛血清及0.6 U/mL胰岛素的RPMI 1640培养基中。细胞培养至85%融合后,换用无血清培养基培养24 h,后换用新鲜无血清的DMEM低糖(5 mmol/L)培养基,分别加入药物刺激干预:高糖刺激组中高糖浓度为25 mmol/L,刺激时间为24 h。PJ34干预组先给予3×10-6mol/L PJ34孵育1 h后,加入高糖刺激24 h。单纯使用PJ34组作为对照。
1.2.2 细胞总蛋白提取 细胞用PBS清洗后加入细胞裂解液,冰上放置5 min。用细胞刮刮取细胞,收集至1.5 mL Eppendorf管中,放置于冰上。用超声粉碎仪在冰上进行超声粉碎,500 W、1 s×15次,以剪切 DNA,降低黏稠度。4℃,12000 r/min离心10 min,留取上清。取10 μL上清测定浓度,余储存于-80℃备用。细胞总蛋白提取物做Western blot分析高糖对于大鼠肾脏系膜细胞PARP-1表达的影响。
1.2.3 RT-PCR大鼠肾脏系膜细胞总RNA的提取按照Trizol说明书操作。RT-PCR引物购自美国INVITROGEN公司上海分部。逆转录反应及RT-PCR反应:取1.0 μg的总RNA采用 RevertAidTM First Strand cDNA Synthesis Kit,以 Oligo(dT)18为引物合成第一链cDNA(按试剂盒说明书进行);②PCR:采用Takaka公司试剂盒 PCR反应扩增。引物序列见表1。产物储存于-20℃。取8 μL PCR产物在含有0.5 μg/mL溴化乙锭(EB)的1.5%琼脂糖凝胶中以85 V恒压电泳30 min,紫外检测仪上观察,用凝胶图像成像系统成像及进行扫描定量分析DNA带的含量,以所测得积分吸光度与内参照β-actin积分吸光度的比值代表半定量值。PARP-1、COLⅣ、FN、β-actin引物序列及反应条件见表1。
1.2.4 PARP活性检测 细胞 PARP活性检测按照 PARP/Apoptosis检测试剂盒(trevigen公司)说明书进行。
1.3 统计学方法
采用SPSS 13.0进行统计分析,计量资料采用均数±标准差()表示,各组数据之间差异显著性用多个样本均数比较及ANOVA方差分析检验。以P<0.05为差异有统计学意义。
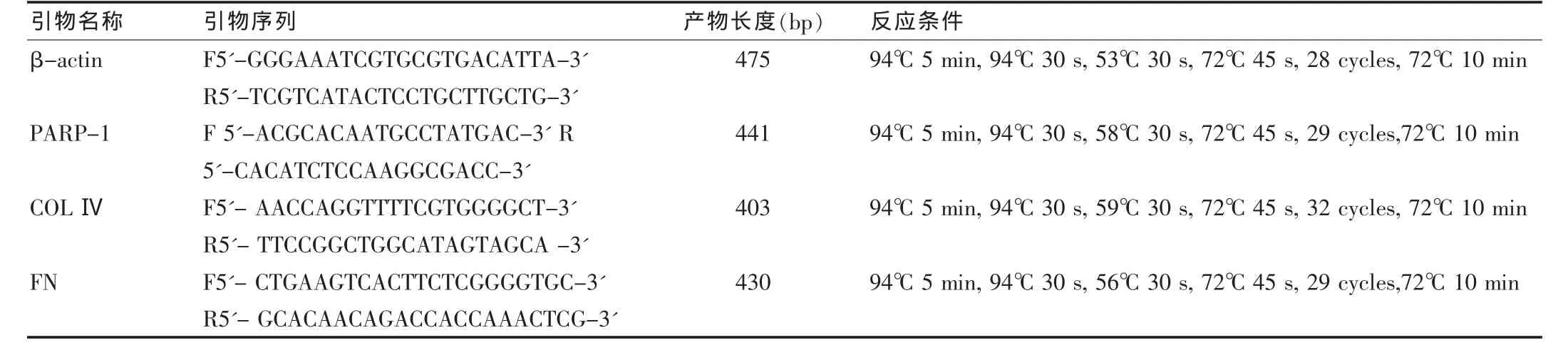
表1 PCR引物合成序列
2 结果
2.1 PJ34抑制高糖诱导大鼠肾脏系膜细胞PARP-1的过表达
应用高糖刺激大鼠肾脏系膜细胞,高糖组系膜细胞PARP-1 mRNA和蛋白的表达较较低糖对照组明显增加,分别较低糖对照组增加72.3%和68.4%(P<0.05),PJ34组系膜细胞PARP-1 mRNA和蛋白的表达分别减少为高糖组的31.8% 和 55.5%(P<0.05)。见图1~4。单纯使用PJ34不影响系膜细胞PARP-1的表达。同时,高糖显著诱导大鼠肾脏系膜细胞PARP-1激活,高糖组为低糖对照组活性的1.77倍(P<0.05),给予PJ34预处理可显著抑制高糖诱导的PARP激活,活性降低为高糖组的67.8% (P<0.05)。见图5。
2.2 PJ34抑制高糖诱导大鼠肾脏系膜细胞FN及COLⅣ的过表达
应用高糖刺激大鼠肾脏系膜细胞,高糖组系膜细胞COLⅣ和FN mRNA的表达较低糖对照组分别增加57.9%和54.5%(P<0.05),PJ34显著抑制高糖所致系膜细胞COLⅣ和FN mRNA的表达,分别减少为高糖组的68.2%和54.7%(P<0.05)。见图6、7。单纯使用PJ34不影响系膜细胞COLⅣ和FN mRNA的表达。同时,高糖组系膜细胞COLⅣ和FN蛋白的表达较低糖对照组分别增加51.2%和36.9%(P<0.05),PJ34组系膜细胞COLⅣ和FN蛋白的表达分别减少为高糖组的54.0%和66.6%(P<0.05)。见图8、9。单纯使用PJ34不影响系膜细胞COLⅣ和FN的表达。
3 讨论
糖尿病肾病(DN)是糖尿病严重的并发症之一,也是发达国家终末期肾病的首要原因,我国近年来发病率也有不断上升的趋势。高血糖作为糖尿病的最基本生化特性,通过多种机制引起DN,其中氧化应激是一个重要损伤机制。血糖通过多种机制引起DN,其中代谢途径、糖基化终产物(AGEs)途径、蛋白激酶C途径以及己糖胺途径是公认的四个重要损伤机制[3]。DN研究表明,PARP和蛋白非酶糖基化、ROS生成异常、钙代谢紊乱密切相关,PARP和糖尿病并发症之间关联的研究进展成为人们关注的热点。
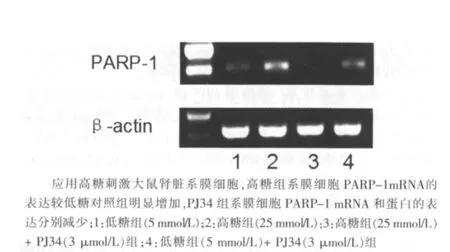
图1 高糖组(25 mmol/L)诱导PARP-1mRNA表达及PJ34的干预作用
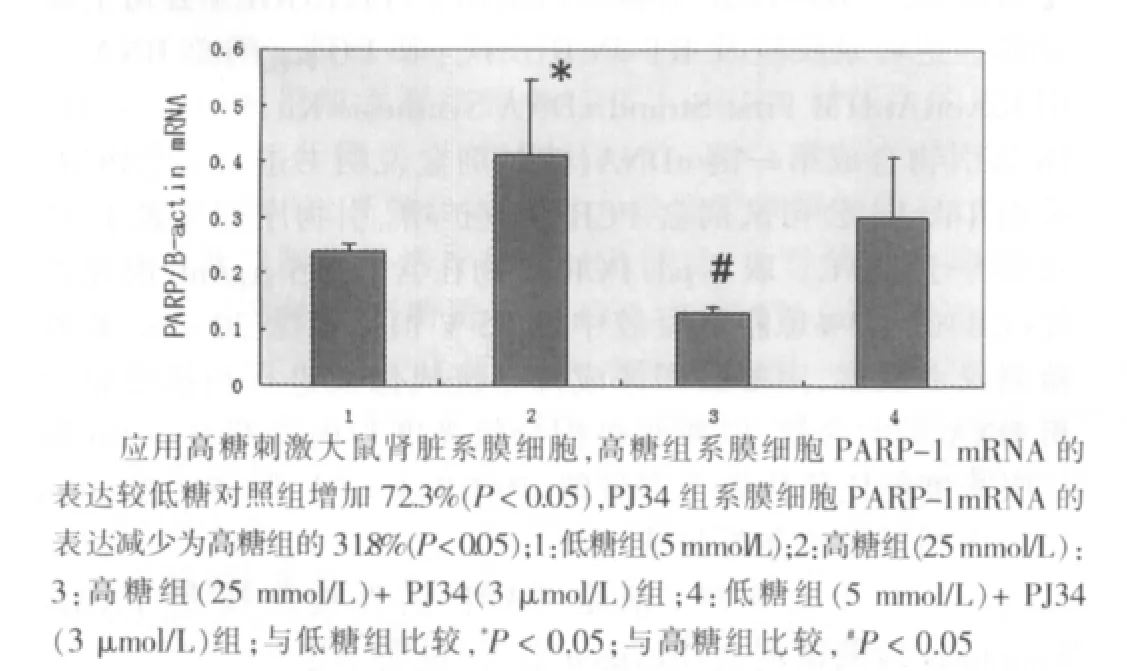
图2 高糖组(25 mmol/L)诱导PARP-1 mRNA表达及PJ34的干预作用的统计图(n=3)
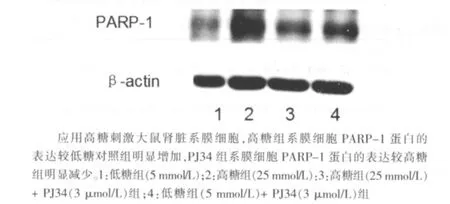
图3 高糖组(25 mmol/L)诱导PARP-1蛋白表达及PJ34的干预作用
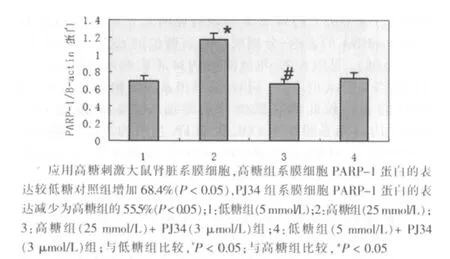
图4 高糖组(25 mmol/L)诱导PARP-1蛋白表达及PJ34的干预作用的统计图(n=3)

图5 高糖组(25 mmol/L)诱导PARP-1活性表达及PJ34的干预作用的统计图(n=3)

图6 高糖组(25 mmol/L)诱导COLⅣ和FN mRNA的表达及PJ34的干预作用
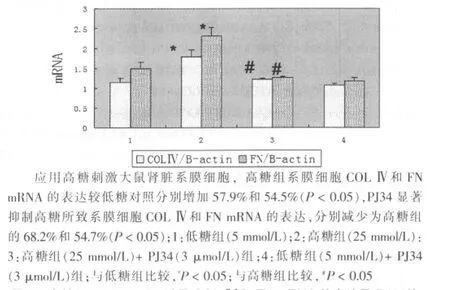
图7 高糖组(25 mmol/L)诱导COLⅣ和FN mRNA的表达及PJ34的干预作用的统计图(n=3)
PARP是一类存在于多数真核细胞中的蛋白质翻译后修饰酶。主要存在于细胞核内,少量存在于细胞浆内。它是能选择性识别并结合DNA缺口的DNA结合蛋白酶,主要通过修复DNA单链及双链断裂在维持基因组的完整性方面发挥作用[4]。在糖尿病时,增高的细胞内葡萄糖水平引起ROS大量释放,DNA链严重损伤,以致PARP过度激活,而消耗大量NAD+及ATP,引起细胞能量供应不足而坏死或凋亡,同时,NAD+及ATP的大量耗竭引起细胞抗氧化能力的严重削弱,引起氧化应激损伤和Ca2+内流的增加,导致细胞损伤。另外,PARP调控了转录因子的活性,活化的PARP上调了大量因子的表达(TNF-α、一氧化氮合酶、内皮素等),共同介导DN的发生。然而更为重要的是,PARP催化生成 ADPR,使GAPDH活性大大降低,因而激活上述四个重要损伤途径。因此,可以想象PARP在DN的发生发展中起着关键作用。只要能特异地、完全地抑制PARP的过度表达,就可以抑制其下游的所有的病理损伤过程,阻断高血糖对糖尿病肾组织细胞的损害,逆转DN的全过程。
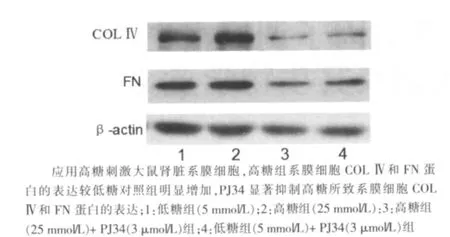
图8 高糖组(25 mmol/L)诱导COLⅣ和FN蛋白表达及PJ34的干预作用

图9 高糖组(25 mmol/L)诱导COLⅣ和FN蛋白表达及PJ34的干预作用的统计图(n=3)
ECM是细胞外大分子构成的网络,主要包括胶原(collagen,COL), 层粘连蛋白 (laminin,LN), 纤维连接蛋白(fibronectin,FN)等,它的过度堆积或降解减少均视为病理性重塑,是肾脏病变发生,发展的主要原因。在本研究中,笔者发现高糖刺激可以引起大鼠系膜细胞细胞内PARP激活,PARP-1表达升高,FN、COLⅣ蛋白和mRNA表达增加。再次证实了异常增高的高糖可导致肾脏系膜细胞分泌细胞外基质,引起细胞外基质的沉积。在此过程中,笔者同时观察到PARP-1基因及蛋白表达的增高,提示PARP-1可能参与了高糖引起的肾小球细胞外基质的沉积。笔者还发现应用PARP抑制剂PJ34干预后大鼠系膜细胞PARP-1表达降低,明显改善了高糖诱导的细胞外基质FN、COLⅣ蛋白和mRNA表达增加。PJ34是一种新研制的选择性PARP-1抑制剂,通过竞争性阻断PARP分子上NAD+结合位点而发挥作用,它的抑酶活性比以往的PARP抑制剂都强,是3-AB的1万倍[5]。PJ34 的分子式为 C17H17N3O2·HCl,属于菲啶酮类化合物,呈水溶性,口服和注射方式的生物利用度都高[6]。笔者的研究中运用PJ34干预处理后发现在抑制PARP-1表达的同时高糖诱导的指示细胞外基质沉积的指标也被显著抑制了,进一步提示PARP-1参与了高糖引起的肾小球细胞外基质的沉积。
既往有很多实验也证实了抑制PARP-1活性可以改善高糖或者糖尿病所致的一系列病理结局。Choi等[7]发现PARP特异性抑制剂可以改善糖尿病小鼠冠状动脉功能。同样,有研究表明抑制PARP活性可以中和糖尿病小鼠的肾小球肥大及外周神经病变[8]。在糖尿病神经病变及视网膜病变的诸多研究中也观察到抑制PARP可以改善上述病变[9-10]。笔者既往也发现抑制PARP可以显著改善高糖所致腹膜间皮细胞的转分化及纤维化[11]。对于糖尿病肾病,Szabo等[12]也发现在db/db糖尿病小鼠中,肾组织PARP活性增加,其特异性抑制剂可以减少小鼠尿蛋白、小球系膜增宽及足突细胞损伤。另外,其特异性抑制剂还可以抑制高糖刺激的体外培养的足突细胞的凋亡。笔者既往的研究也发现在下调PARP-1活性及表达能部分逆转高糖诱导的大鼠肾脏系膜细胞细胞外基质积聚[13]。因此,研究和开发PARP抑制剂,将为临床治疗氧化应激相关性疾病提供新策略和新方法,为DN的治疗提供一个新的思路。
[1]Luo X,Kraus WL.On PAR with PARP:cellular stress signaling through poly(ADP-ribose)and PARP-1[J].Genes Dev,2012,26(5):417-432.
[2]Chang SY,Chen YW,Chenier I,et al.Angiotensin II type II receptor deficiency accelerates the development of nephropathy in type I diabetes via oxidative stress and ACE2[J].Exp Diabetes Res,2011:521-576.
[3]Rolo,Anabela P,Carlos M.Diabetes and mitochondrial function: Role of hyperglycemia and oxidative stress[J].Toxicology and Applied Pharmacology,2006,212:167-178.
[4]Javle M,Curtin NJ.The role of PARP in DNA repair and its therapeutic exploitation[J].Br J Cancer,2011,105(8):1114-1122.
[5]Suarez WL,Mabley JG,Power R,et al.Poly (ADP-ribose) polymerase inhibition prevents spontaneous and recurrent autoimmune diabetesinNOD mice by inducing apoptosis of islet-infiltrating leukocytes[J].Diabetes,2003,52(7):1683-1688.
[6]Wang S,Wang H,Davis BC,et al.PARP1 inhibitors attenuate AKT phosphorylationvia the upregulation of PHLPP1[J].Biochem Biophys Res Commun,2011,412(2):379-384.
[7]Choi SK,Galán M,Kassan M,et al.Poly (ADP-Ribose) polymerase 1 inhibition improves coronary arteriole function in type 2 diabetes mellitus[J].Hypertension,2012,59(5):1060-1068.
[8]Drel VR,Pacher P,Stavniichuk R,et al.Poly (ADP-ribose) polymerase inhibition counteracts renal hypertrophy and multiple manifestations of peripheral neuropathy in diabetic Akita mice[J].Int J Mol Med,2011,28(4):629-635.
[9]Xu B,Chiu J,Feng B,et al.PARP activation and the alteration of vasoactive factors and extracellular matrix protein in retina and kidney in diabetes[J].Diabetes Metab Res Rev,2008,24(5):404-412.
[10]Negi G,Kumar A,Sharma SS.Concurrent targeting of nitrosative stress-PARP pathway corrects functional,behavioral and biochemical deficits in experimental diabetic neuropathy [J].Biochem Biophys Res Commun,2010 ,391(1):102-106.
[11]Lei P,Jiang Z,Zhu H,et al.Poly (ADP-ribose) polymerase-1 in high glucose-induced epithelial-mesenchymal transition during peritoneal fibrosis[J].Int J Mol Med,2012,29(3):472-478.
[12]Szabó CC,Biser AA,Benko RR,et al.Poly (ADP-ribose) polymerase inhibitors ameliorate nephropathy of type 2 diabetic Leprdb/db mice[J].Diabetes,2006,55(11):3004-3012.
[13]Zhu H,Jiang Z,Lei P,et al.Role of Poly (ADP-ribose) Polymerase-1 activation in angiotensin II–induced extracellular matrix accumulation in rat mesangial cells[J].Kidney Blood Press Res,2011,34(5):320-327.
