牙龈卟啉单胞菌对兔血管平滑肌细胞分泌 IL-1β、IL-6 的影响
2012-07-27赵瑜敏张明珠税艳青陈立忠崔平平雷雅燕
赵瑜敏,张明珠,税艳青,陈立忠,崔平平,雷雅燕
(云南 昆明:1.市口腔医院口腔内科,650600;2.昆明医学院附属口腔医院,650031)
动脉粥样硬化(atherosclerosis,AS)是严重威胁人类健康的疾病,斑块一旦破裂可触发急性冠状动脉硬化(acute coronary sclerosis,ACS)的发生,表现为不稳定心绞痛、急性心肌梗塞和猝死。目前已认识到,AS的发生不仅有血脂参与,且有炎症参与[1]。牙周炎是由牙周致病菌导致的一种炎症性疾病,临床流行病学研究显示,牙周炎与动脉粥样硬化之间存在着明显的相关性;临床实验和动物实验均发现在动脉粥样斑块中存在牙周致病菌感染,因此,牙周炎已被认为是心血管疾病独立的危险因素之一[2]。关于AS与牙周炎的关系,目前的研究多集中在两种疾病在炎症因子方面的规律,认为炎症因子可能为二者之间相关性的中介和桥梁。AS形成及血管成形术(angioplasty)后再狭窄(restenosis,RS)是多细胞,多因子参与的以血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增生为主要病理改变的动脉壁病变。VSMCs是构成大、中动脉血管中膜的重要细胞,其增殖,迁移和分泌细胞外基质等功能在AS发生发展过程中发挥着重要的作用,但关于牙周炎致病因子如内毒素等影响VSMCs分泌炎性细胞因子的作用机制的研究较少,因此,研究 Pg等牙周致病菌的致病因子对VSMCs分泌炎性细胞因子的影响对阐明牙周炎与动脉粥样硬化的关系有着重要的意义。
1 材料和方法
1.1 试剂和仪器
牙龈卟啉单胞菌ATCC 33277株(四川大学华西口腔医院国家重点实验室);抗人肌动蛋白Actin免疫组化单克隆抗体(福建迈新);Rabbit IL-1β ELISA KIT、Rabbit IL-6 ELISA KIT(R&D 公司,美国);高纯总 RNA快速提取试剂盒(离心柱型,北京远泰生物技术有限公司);TaKaRa PrimeScript One Step RT-PCR Kit Ver.2(TaKaRa 公司);兔 βactin、IL-1β,IL-6 引物(大连宝生物公司)。
1.2 Pg的培养及上清的提取
Pg标准菌株常规复苏后,接种于加有羊血和Vit K1的 CDC培养板上,37℃,厌氧 (50 mL/L CO2)培养72 h。形态学检查后,挑取菌落在BHI液体培养基中增菌24 h,取100 μL菌液在FT中以1/10的比例倍比稀释至原始浓度的10-7,取10-5、10-6、10-7三个浓度的稀释液各 100 μL 分别在CDC培养板上涂板,培养48 h后计数菌落数,推算出原始菌液的浓度。其余增菌菌液8000 r/mim,4℃离心15 min,离心后取Pg上清过滤后分装入1.5 mL EP管,-80℃保存备用。
1.3 VSMCs的原代培养和鉴定
取体质量2~3 kg的雄性日本大耳白兔,麻醉后耳缘静脉注射空气栓塞处死,剖腹,切取5 cm的腹主动脉,PBS洗净后剥去血管外膜,在2.5 g/L胰酶溶液中将其剪成1 mm×1 mm的组织块,加入约3 mL含200 mL/L FBS的DMEM-F12培养液,1.5 h 后加入 2.0 mL DMEM-F12 培养基(含200 mL/L FBS,1%双抗),在 37 ℃,50 mL/L CO2条件下培养。5 d换液,直至细胞游出形成单层,2.5 g/L胰酶-EDTA消化后传代。取第3代细胞进行抗α-Actin蛋白免疫组化染色和透射电镜观察鉴定细胞来源。第3~第8代细胞用于实验。
1.4 Pg 对 VSMCs分泌 IL-1β、IL-6 的影响
取VSWCs以5×105/mL的密度接种于96孔板,每孔 100 μL。37 ℃,50 mL/L CO2培养 24 h。弃原培养基,设12、24、48 h三个时间段,每个时间段设实验组和对照组,每组复6孔。实验组加入用含50 mL/L FBS的 DMEM-F12培养基稀释至4.3 ×106CFU/mL 的 Pg 上清液 200 μL,对照组加入等量的含50 mL/L FBS的DMEM-F12培养液继续培养。分别于培养后12、24、48 h ELISA检测IL-1β和 IL-6 水平。
1.5 Pg 上清液对 VSMCs IL-1β、IL-6 基因表达的影响
取VSWCs消化后以2×104/mL的密度接种于25 cm2培养瓶,培养24 h后弃原来培养液,实验组加入用含50 mL/L FBS的DMEM-F12培养基稀释为4.3×106CFU/mL的Pg上清液5 mL,对照组加入等量的含50 mL/L FBS的DMEM-F12培养基继续培养。分别于培养后12、24、48 h提取细胞总RNA,用下列引物(表1)进行一步法RT-PCR反应。反应条件为:50℃ 30 min,94℃ 2 min,94℃ 30 s,59℃(IL-1β 及 β-actin)或65 ℃(IL-6)30 s,72℃ 1 min(上述三步进行30次),72℃ 7 min。反应产物在10 g/L琼脂糖凝胶中电泳60 min,计算机图像采集系统拍照,扫描反应产物条带的灰度值。
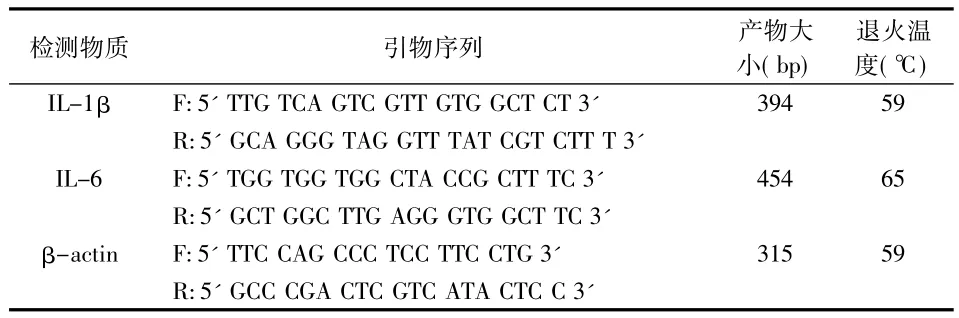
表1 IL-1、IL-6、β-actin 引物序列
1.6 统计学分析
用SPSS 16.0统计软件进行方差分析,两两比较用t检验,检验水准α=0.05。
2 结果
2.1 VSMCs形态观察和细胞鉴定
VSMCs原代培养5~7 d后组织块周围有细胞游出,为长梭形或多角形,继续培养可见细胞复层分布。约20 d后,细胞长满,可见细胞呈“峰谷样”生长(图1)。对第3代细胞进行α-Actin蛋白免疫组化鉴定及透射电镜观察显示,抗肌动蛋白α-Actin染色阳性(图2);透射电镜可见肌细胞特征性结构——密斑(图3)。
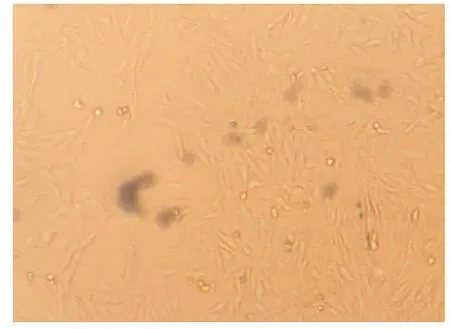
图1 原代细胞(×40)
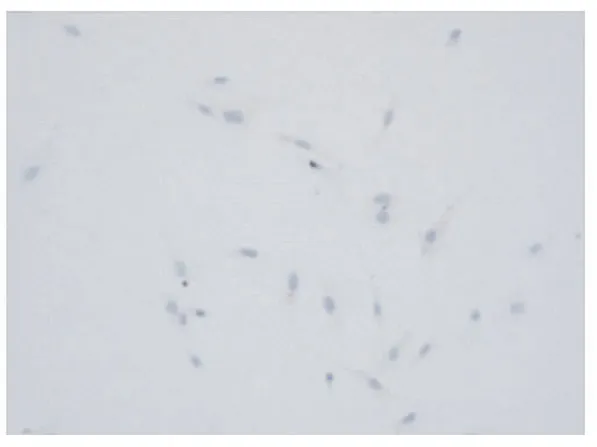
图2 抗肌动蛋白 α-Actin染色阳性,胞浆为棕色(×100)
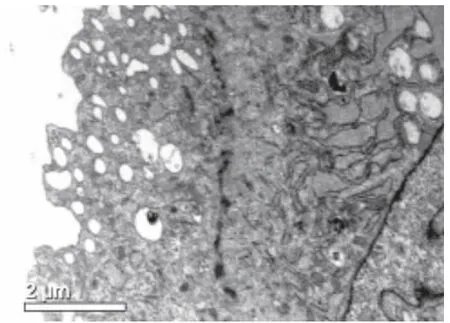
图3 胞浆内见密斑及肌胞丝,并可见平滑肌细胞的特征性结构—密斑(透射电镜×12000)
2.2 Pg 上清对VSMCs分泌IL-1β 和 IL-6的影响
2.2.1 各时间点IL-1β 水平比较(图4)
实验组与对照组相比,在培养12 h和48 h时,两者差异无统计学意义(P>0.05);而在培养24 h时,实验组明显低于对照组,差异有统计学意义(P<0.05)。实验组不同培养时间之间相比,以48 h时最高,12 h时次之,24 h时最低。24 h分别与12 h和48 h相比差异均有统计学意义;而12 h与48 h相比,差异无统计学意义(P>0.05)。
2.2.2 各时间点IL-6水平比较(图5)
实验组与对照组相比,除培养12 h时两者无显著性差异(P>0.05)外,在培养24 h和48 h两时间点,实验组均明显高于对照组,差异均有统计学意义(P<0.05)。实验组不同培养时间之间相比,以24 h最高,48 h次之,12 h最低,3时间点之间差异均有统计学意义(P<0.05)。
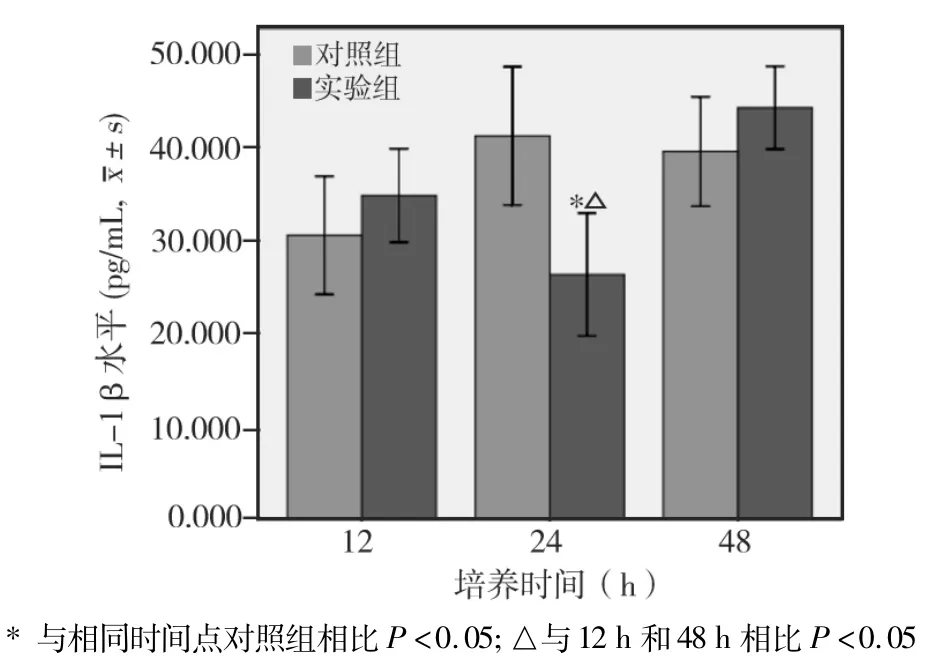
图4 Pg上清对VSMCs分泌IL-1β的影响
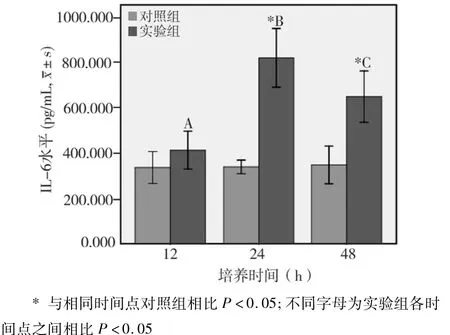
图5 Pg上清对VSMCs分泌IL-6的影响
2.3 Pg 上清液对VSMCs IL-1β、IL-6 基因表达的影响(图6)
用目的基因条带与内参β-actin条带的灰度值的比值作为目的基因表达强弱的指标,分别比较各组各时间点IL-1β和IL-6 mRNA表达水平。
2.3.1 各时间点IL-1β mRNA水平比较(图7)
实验组与对照组相比,在培养12 h和48 h时两者差异无统计学意义(P>0.05);而在培养24 h,实验组明显低于对照组,差异有统计学意义(P<0.05)。实验组不同培养时间相比,24 h时明显低于12 h和48 h,差异均有统计学意义(P<0.05);而其他两时间点之间相比无显著性差异(P>0.05)。

图6 RT-PCR 检测 IL-1β,IL-6 表达情况
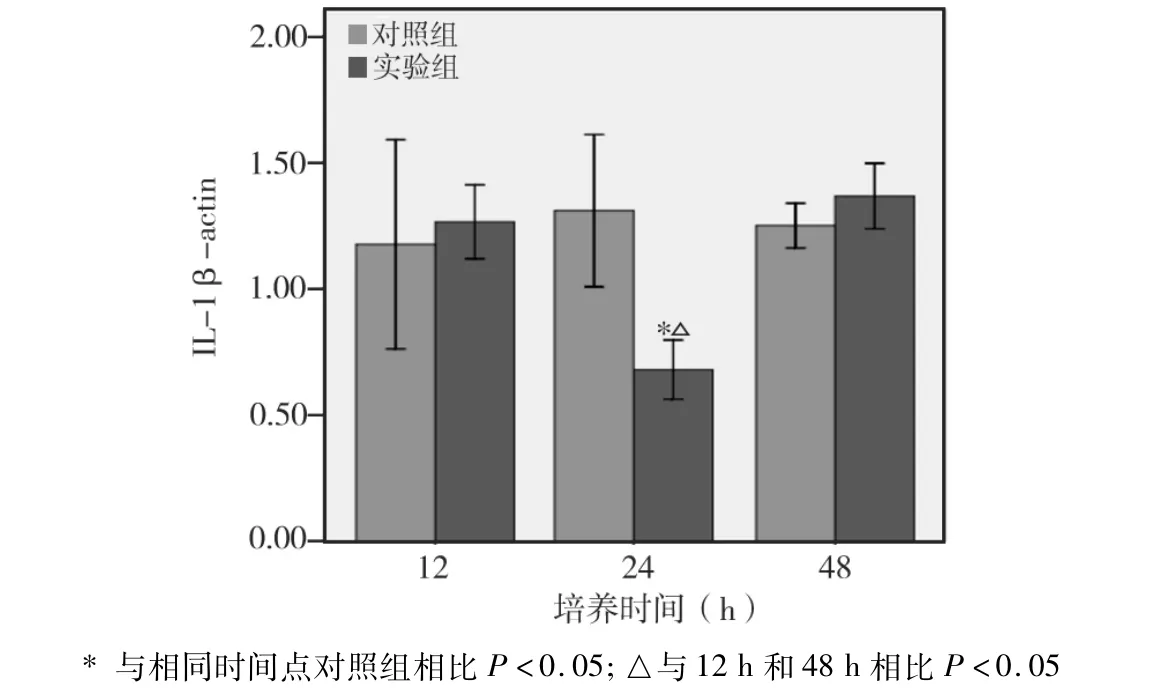
图7 IL-1β mRNA表达情况
2.3.2 各时间点IL-6 mRNA水平比较(图8)
实验组与对照组相比,在培养12 h和48 h时两者差异无统计学意义(P>0.05);而在培养24 h时,实验组明显高于对照组(P<0.05)。实验组不同培养时间相比,24 h明显高于12 h和48 h(P<0.05);而其他两时间之间相比无显著性差异(P>0.05)。
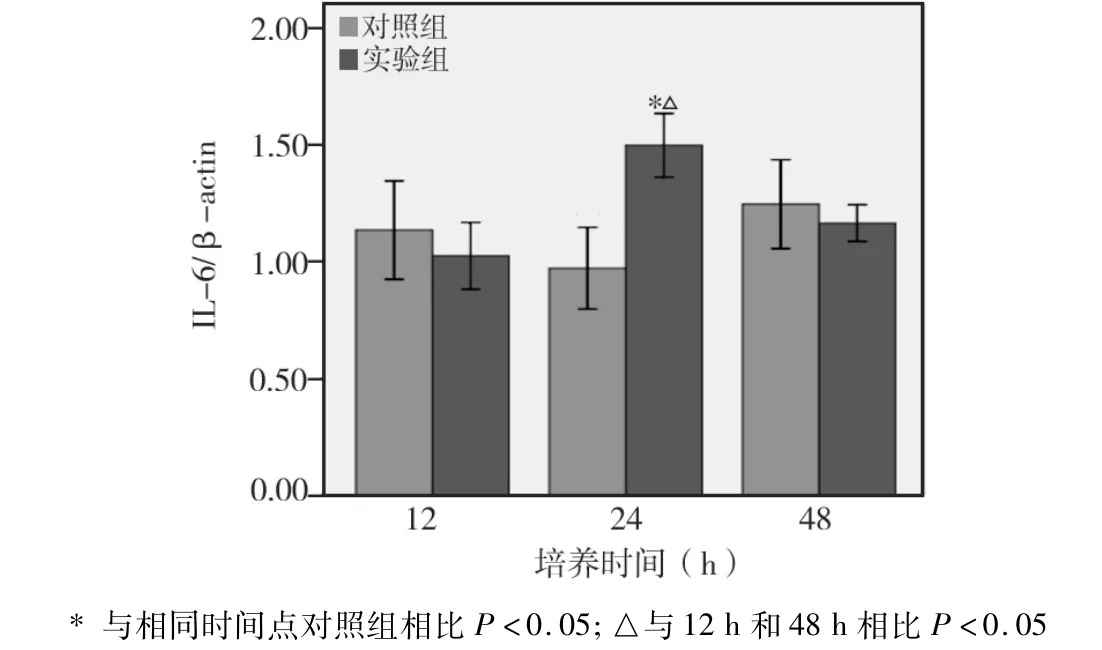
图8 IL-6 mRNA表达情况
3 讨论
AS是严重威胁人类健康的疾病之一,斑块一旦破裂可触发ACS发生,表现为不稳定心绞痛、急性心肌梗塞和猝死。VSMCs在众多趋化、活化因子的作用下发生迁移和表型转变,以自分泌、旁分泌的形式合成生长因子、细胞因子,促进氧化低密度脂蛋白(oxLDL)的产生和泡沫细胞形成,参与AS的发生与发展[3-5]。在促进 AS和 RS发生、发展的众多因素中,炎症和细胞因子是主要危险因素之一,其中以TNF-α、IL-1与AS的关系较为密切。血液炎性细胞和血管内皮细胞和VSMCs均能分泌TNF-α、IL-6、IL-8 和血小板活化因子(platelet activativc factor,PAF),这些因子之间具有复杂的交互作用[3]。
牙周炎是由牙周致病菌导致的一种炎症性疾病,Pg是目前公认的引起牙周炎的常见致病菌,表达多种潜在的毒力因子,鲁维希[6]等对Pg等牙周致病菌的BHI增菌液进行高速离心(15000 r/min,10 min)后,取其上清液用核磁共振代谢图谱法研究发现,Pg菌液的上清液内保留了其主要致病成分,所以,本研究选择Pg上清液与VSMCs共同培养,观察其对VSMCs合成和分泌IL-6和 IL-1β的影响。
有研究显示,IL-6是慢性炎症的关键分子,与AS的进展密切相关,在急性心肌梗死、RS冠脉病变部位的旋切标本中IL-6表达增加;AS脂质条纹、斑块的纤维帽、肩部的巨噬细胞以及VSMCs均表达IL-6[7]。IL-6可刺激基质降解酶的合成而侵蚀斑块内的基质,导致不稳定斑块破裂[8]。Seino等(1994)发现了IL-6在人动脉粥样硬化斑块中的表达,并认为IL-6作为自分泌递质参与了冠状动脉粥样硬化的形成,而且同斑块的稳定性有关,是 AS 一个独立的生物学标志[9]。Ikeda等[10]临床研究发现,在动脉粥样硬化斑块中有IL-6 mRNA的大量表达。Biasucci等[11]发现冠心病病人血浆内的IL-6水平明显增高。
楚玉峰等[12]报道,用LPS刺激大鼠胸主动脉血管平滑肌细胞3 h,即可使IL-6 mRNA和蛋白质表达明显增高,12 h达到高峰,24 h后虽有所降低但仍高于对照组。作者认为用LPS刺激VSMCs早期即可明显增强IL-6转录水平,并进一步导致IL-6的蛋白合成明显增加,而且该作用可延续至24 h 以上,与 Yang[13]、Son 等[14]的研究结论相一致。
本研究通过ELISA和RT-PCR检测发现,Pg上清刺激VSMCs 24 h时实验组的IL-6 mRNA表达水平较对照组明显增加,而到48 h时IL-6 mRNA表达水平又恢复到正常对照组水平,据此认为,Pg可以刺激VSMCs分泌产生IL-6,从而在AS发生发展过程中发挥重要作用。
IL-1β也是在AS发生发展中起重要作用的细胞因子。IL-1具有多种生物学功能,作用于血管内皮细胞、VSMCs、单核细胞和中性粒细胞等,诱导细胞粘附分子 -1、单核细胞趋化蛋白 -1、IL-1、TNF-α的表达,增加炎症细胞对VSMCs的粘附,促进 VSMCs增殖,参与 AS 的形成[15-17]。本研究结果显示,Pg上清刺激VSMCs 12 h时,实验组与对照组IL-1β水平无显著差异,而24 h时实验组IL-1β水平显著低于对照组,表明该时间段Pg上清能抑制VSMCs分泌IL-1β。同时进行RT-PCR半定量分析VSMCs IL-1β mRNA表达情况也显示,24 h时,实验组IL-1β mRNA水平明显低于同时间点的对照组,而且也明显低于12 h和48 h的实验组。提示Pg上清可能是通过影响IL-1β基因的表达而抑制VSMCs分泌IL-1β。
Pg上清刺激VSMCs 24 h时VSMCs合成和分泌IL-6显著增加,同期IL-1β的合成和分泌显著降低,提示这两种细胞因子之间可能存在着相互作用。IL-6等经gp130转录的细胞因子可抑制LPS诱导 IL-1 合成[18],这可能是本研究中 IL-1β 水平降低的原因之一。因此,可以认为Pg的致病物质可通过直接刺激血管平滑肌细胞使其分泌IL-6等细胞因子,产生炎症介质,在介导炎症反应等方面发挥一定作用。
[1]Babaev VR,Antonov AS,Domogatsky SP.Phenotype related changes of intimal smooth muscle cells from human aorta in primary culture[J].Atherosclerosisv,1992,96(2 -3):189 -202.
[2]Lee RT,Libby P.The unstable atheroma[J].Arterioscler Thromb Vasc Biol,1997,17(10):1859 -1867.
[3]吴兴利,王士雯,徐雅琴,等.银杏叶提取物对兔血管平滑肌细胞分泌细胞因子的影响[J].中国新药与临床杂志,2003,22(5):292 -295.
[4]Ross R.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,340(2):115 -126.
[5]Glass CK,Witztum JL.Atherosclerosis.the road ahead[J].Cell,2001,104(4):503 -516.
[6]鲁维希,吴亚菲,肖丽英,等.牙周可疑致病菌代谢组学鉴定的初步研究[J].华西口腔医学杂志,2009,27(3):310-312,316.
[7]Ito T,Ikeda U,Shimpo M,et al.Serotonin increases interleukin-6 synthesis in human vascular smooth muscle cells[J].Circulation,2000,102(20):2522 -2527.
[8]成士清,刘成玉.炎症标志物CRP、IL-6和ICAM-1与冠心病的关系[J].齐鲁医学杂志,2006,21(2):180 -182.
[9]Seino Y,Ikeda U,Ikeda M,et al.Interleukin 6 gene transcripts are expressed in human atherosclerotic lesions [J].Cytokine,1994,6(1):87 -91.
[10]Ikeda U,Ikeda M,Seino Y,et al.Interleukin 6 gene transcripts are expressed in atherosclerotic lesions of genetically hyperlipidemic rabbits [J].Atherosclerosis,1992,92(2 - 3):213-218.
[11]Biasucci LM,Vitelli A,Liuzzo G,et al.Elevated levels of interleukin-6 in unstable angina[J].Circulation,1996,94(5):874-877.
[12]楚玉峰,姜毅,张继承,等.脂多糖诱导血管平滑肌细胞分泌白细胞介素-6及p38丝裂原活化蛋白激酶的调控作用[J].中国危重病急救医学,2010,22(5):291 -294.
[13]Yang X,Coriolan D,Murthy V,et al.Proinflammatory phenotype of vascular smooth muscle cells:role of efficient Toll-like receptor 4 signaling [J].Am J Physiol Heart Circ Physiol,2005,289(3):H1069 -1076.
[14]Son YH,Jeong YT,Lee KA,et al.Roles of MAPK and NF-kappaB in interleukin-6 induction by lipopolysaccharide in vascular smooth muscle cells[J].J Cardiovasc Pharmacol,2008,51(1):71-77.
[15]Apostolakis S,Vogiatzi K,Krambovitis E,et al.IL-1 cytokines in cardiovascular disease:diagnostic,prognostic and therapeutic implications[J].Cardiovasc Hematol Agents Med Chem,2008,6(2):150-158.
[16]Packard RR,Libby P.Inflammation in atherosclerosis:from vascular biology to biomarker discovery and risk prediction[J].Clin Chem,2008,54(1):24 -38.
[17]Sasu S,Beasley D.Essential roles of IkappaB kinases alpha and beta in serum-and IL-1-induced human VSMCs proliferation[J].Am J Physiol Heart Circ Physiol,2000,278(6):H1823 -1831.
[18]Pauly RR,Bilato C,Sollott SJ,et al.Role of calcium/calmodulin-dependent protein kinase II in the regulation of vascular smooth muscle cell migration [J].Circulation,1995,91(4):1107-1115.
