黄芪、党参乙醇提取物抗菌活性研究
2012-07-26段琦梅梁宗锁杨东风刘文婷
段琦梅, 梁宗锁*, 杨东风, 刘文婷
(1.西北农林科技大学生命科学学院,陕西杨凌712100;2.陕西省中药指纹图谱与天然产物库研究中心,陕西杨凌712100)
我国拥有丰富的药用植物资源,其中很多药用植物的作用都是通过抑菌作用来表现的[1-2]。从天然植物资源中寻找和开发绿色药品既可以避免由于抗生素的广泛使用而带来的细菌耐药性问题和药物的不良反应,又可以避免化学合成药物的开发难度大及明显的毒副作用,因此就显得尤为重要,并且成为当前新药发展的一种趋势。目前,从天然物质中寻找抗菌活性的物质用于治疗疾病越来越引起人们的关注[3-4]。
黄芪是我国传统的补益用药[5]。具有抗氧化、抗衰老、抗应激、抗病毒、抗肿瘤的作用,对人体核酸代谢、细胞代谢、细菌及病毒感染等有显著作用,对内分泌系统、免疫系统等均有广泛的影响[5-6]。党参具有健脾益肺、补中益气的功能[7],具有抗氧化、抗衰老、免疫调节和抗肿瘤等作用[8-10]。黄芪和党参中都富含黄酮、多糖、萜类、酚酸类、多种皂苷以及微量元素、氨基酸、亚油酸、胆碱、生物碱等[11-13],其中许多化合物具有较强的生物活性。目前,关于黄芪、党参提取物抗菌活性的研究少有报道,为了探讨黄芪、党参乙醇提取物的生物活性,本研究对黄芪、党参药材的乙醇提取物进行抗菌试验研究,以期为充分利用黄芪、党参药材提供参考依据。
1 试验材料
1.1 供试材料 选用试验材料经西北农林科技大学生命学院张跃进教授鉴定为黄芪Astragalus membranaceus和党参Codonopsis pilosula。处理方法为:取清洗干净的黄芪、党参根部样品置于50℃烘箱中干燥、粉碎并过40目筛,保存于密封容器中备用。
1.2 试验菌株 所用的15种菌株分别为:金黄色葡萄球菌 (Staphylococcus aureus);绿脓假单胞菌 (Pseudomonas aeruginosa);大肠埃希氏菌(Escherichia coli);卡他布朗汉姆氏菌 (Branhamella catarrhalis);表皮葡萄球菌(Staphylococcus epidermdis);甲型溶血性链球菌 (Streptococcus hemolysis-α);乙型溶血性链球菌 (Streptococcus hemolysis-β);伤寒沙门氏菌 (Salmonella typhi);肺炎链球菌(Streptococcus pneumoniae);福氏志贺氏菌 (Shigella flexneri);肺炎克雷伯氏菌 (Klebsiella pneumoniae);变形杆菌(Proteus sp.);炭疽芽胞杆菌 (Bacillus anthracis);枯草芽胞杆菌(Bacillus subtilis);白色假丝酵母菌 (Candida albicans)。
以上15株试验菌株冻干菌种均由中国药品生物制品检定所中国医学细菌保藏中心提供。
1.3 主要试验仪器及试剂 电热恒温培养箱;压力蒸气灭菌器;生物安全柜;96孔细胞培养板;电子天平;LB培养基 (美国Sigma公司);二甲基亚砜 (DMSO),(西安化学试剂厂);营养琼脂培养基 (北京陆桥技术有限公司);无支原体新生牛血清 (杭州四季青生物工程材料有限公司)。
2 试验方法
2.1 样品的处理及样品液配制 分别精密称取3 g左右的黄芪、党参粉末置于锥形瓶中,加入95%乙醇20 mL,在超声波清洗器中超声提取30 min,过滤,保留滤液,并对滤渣同样处理后过滤,合并滤液,将提取液进行浓缩为干样,黄芪的提取得率为4.365%,党参的提取得率为1.984%。将黄芪、党参醇提物干样分别溶解于二甲基亚砜(DMSO)中,对应的黄芪相对提取物的质量浓度为0.1 g/mL,党参相对提取物的质量浓度为0.28 g/mL。
2.2 抗菌试验 本试验内容中的试验菌液配制、最小抑菌浓度、最小杀菌浓度的测定 参照《中华人民共和国卫生部药政局新药临床前研究指导原则》和《微生物学检验技术》中的相关章节,分别采用琼脂微孔扩散法、连续二倍梯度液体稀释法测定最小抑菌浓度 (Minimum inhibitory concentration,MIC),液体转染法测定最小杀菌浓度 (Minimum bactericidal concentration,MBC)并略有改进[14-15]。
3 试验结果
3.1 黄芪、党参乙醇提取物对试验菌的MIC
3.1.1 琼脂平板微孔扩散法抗菌试验 黄芪醇提物对卡他布朗汉姆氏菌、表皮葡萄球菌、甲型、乙型溶血性链球菌、枯草芽胞杆菌、炭疽芽胞杆菌、大肠埃希氏菌、金黄色葡萄球菌和肺炎克雷伯氏菌有抑制作用。其中,对乙型溶血性链球菌、炭疽杆菌、枯草杆菌和金黄色葡萄球菌的作用尤为明显。对每种菌的最小抑菌质量浓度分别为0.1、0.1、0.1、0.01、0.05、0.025、0.1、0.05、0.1 g/mL。
党参醇提物对卡他布朗汉姆氏菌、表皮葡萄球菌、甲型、乙型溶血性链球菌、枯草芽胞杆菌、炭疽芽胞杆菌、大肠埃希氏菌、金黄色葡萄球菌和肺炎克雷伯氏菌、伤寒沙门氏菌、变形杆菌有抑制作用。
3.1.2 液体稀释法抗菌试验 黄芪醇提物MIC测定结果可知,黄芪醇提物对乙型溶血性链球菌的 MIC达10 mg/mL,在0.625~20 mg/mL的质量浓度范围内显示对其余试验菌株无抑制作用。党参醇提物抗菌试验结果表明,在1.7~56 mg/mL的质量浓度范围内,党参醇提物对所用试验菌株均无抑制作用。
3.1.3 黄芪、党参醇提物对菌株的MIC 综合液体稀释法和琼脂平板微孔扩散法抗菌试验的结果,黄芪、党参醇提物对15株常见标准菌株的MIC结果见表1。
3.2 黄芪、党参醇提物对试验菌的MBC 试验结果表明,黄芪醇提物质量浓度为0.1 g/mL,党参醇提物质量浓度为0.28 g/mL时,对所有试验菌均无灭活作用。
3.3 常用化学消毒剂、有机溶剂的抗菌试验 为了使脂溶性的有效成分能够充分溶解,在抑菌试验中常采用有机溶剂助溶。为了研究采用有机溶剂在抗菌试验中对试验效果的影响,使试验数据更科学、更具有参考价值,本研究设计如下试验:选择常用的有机溶剂乙醇、二甲基亚砜,研究乙醇、二甲基亚砜这些常见的有机溶剂在抗菌试验中作为溶剂时,它们本身对细菌的抑制程度。
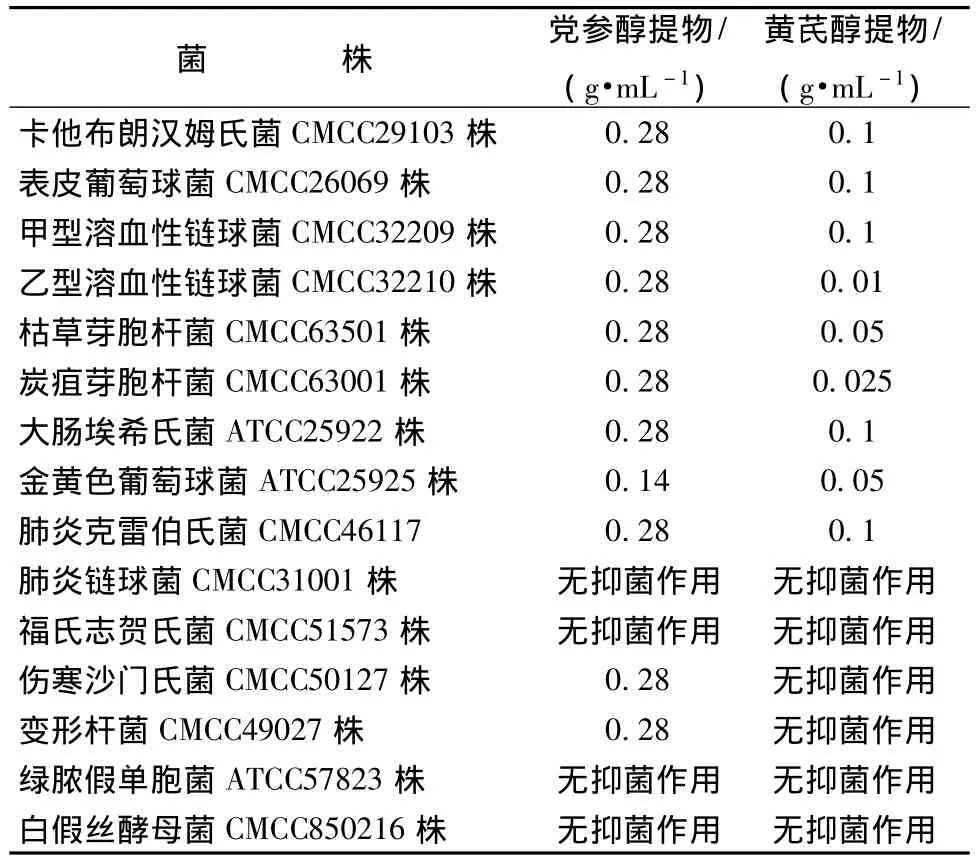
表1 黄芪、党参乙醇提取物对15株标准菌株的MIC
试验结果表明,高浓度乙醇对金黄色葡萄球菌和大肠埃希菌有明显的抑制作用。二甲基亚砜对细菌无抑制作用。
4 结论与讨论
关于黄芪、党参的抗菌活性曾有一些研究报道,其中,周建新等[16]对黄芪提取物作用于5种菌株进行研究;王俊淇等[17]对党参脂作用于3种菌的抗菌活性进行了研究。本研究在前人研究的基础上,采用体外抗菌试验来研究黄芪、党参乙醇提取物对常见15种细菌的抑菌活性,并且考虑试验中所用溶剂对抗菌活性的影响。黄芪、党参醇提物抗菌活性的试验结果表明:黄芪醇提物对卡他布朗汉姆氏菌、表皮葡萄球菌、甲型、乙型溶血性链球菌、枯草芽胞杆菌、炭疽芽胞杆菌、大肠埃希氏菌、金黄色葡萄球菌和肺炎克雷伯氏菌有抑制作用。其中,对乙型溶血性链球菌、炭疽杆菌、枯草杆菌和金黄色葡萄球菌的作用尤为明显。对每种菌的最小抑菌质量浓度分别为0.1、0.1、0.1、0.01、0.05、0.025、0.1、0.05、0.1 g/mL。党参醇提物不但对卡他布朗汉姆氏菌、表皮葡萄球菌、甲型、乙型溶血性链球菌、枯草芽胞杆菌、炭疽芽胞杆菌、大肠埃希氏菌、金黄色葡萄球菌和肺炎克雷伯氏菌有抑制作用,同时对变形杆菌、伤寒沙门氏菌有抑制作用。对应的最小抑菌质量浓度除了对金黄色葡萄球菌的为0.14 g/mL外,其余的都为0.28 g/mL。
对于体外抗菌试验的结果进行分析表明:黄芪提取物对试验中所选用的9个试验菌株有明显的抑制作用,尤其是对乙型溶血性链球菌、金黄色葡萄球菌、枯草杆菌和炭疽杆菌的作用较明显,抑制作用表现得更为显著。党参醇提物对11个试验菌株具有明显的抑制作用。黄芪、党参提取物中含有多种活性成分,包括有黄酮类、皂苷类等成分,有试验表明,黄酮类和皂苷类均具有较好的抗菌、抑菌活性[18-20]。由于具有这些活性成分作为物质基础,因此,黄芪、党参醇提物表现出具有一定的抑菌作用。由于黄芪、党参醇提物所含活性成分的复杂多样性,本研究中仅对黄芪、党参醇提物生物活性做了初步试验,要进一步研究其醇提物中哪些成分具有抑菌活性及其抑菌机理,还需进一步进行深入的研究和探讨。
以往对黄芪、党参提取物进行的研究报道中,选用乙醇作为溶剂,这对试验结果的准确性就有了一定的影响。为了让所选择的溶剂既能让被研究物溶解又不能对所使用细菌起到抑菌作用,给抑菌试验选择合适的有机溶剂提供依据,本研究中设计了常用有机溶剂的抗菌试验,试验结果验证了高浓度的乙醇具有较强抑菌及杀菌作用,其作用对象主要为革兰阳性菌及部分革兰阴性菌。75%乙醇在临床上经常单独使用于皮肤消毒或作为脱碘剂与碘酊联合。在抗菌试验的设计中,不应直接使用含有乙醇的样本用于抗菌试验,应考虑乙醇提取物中乙醇的因素,避免乙醇对抗菌活性结果的影响。在本试验中,将含乙醇的提取物样本进行浓缩和干燥,再用对细菌、细胞生长无影响的二甲基亚砜 (DMSO)作溶剂来溶解提取物干燥品,避免乙醇对试验结果的影响,使试验结果更加真实可信。
[1]Li H L,Zhang W D,Zhang C,et al.Bioavailabilty and pharmacokinetics of four active alkaloids of traditional Chinese medicine Yanhuanglian in rats following intravenous and oral administration[J]. J Pharma Biomed Anal, 2006,41(4):1342-1346.
[2]Li H B,Chen F.Isolation and purification of baicalein,wogonin and oroxylin A from the medicinal plant Scutellaria baicalensis by high-speed counter-current chromatography[J].J Chromatogr A,2005,1074(1-2):107-110.
[3]Yu Y,Yi Z B,Liang Y Z.Validate antibacterial mode and find main bioactive components of traditional Chinese medicine Aquilegia oxysepala[J].Bioorg Med Chem Lett,2007,17(7):1855-1859.
[4]Buwa L V,van Staden J.Antibacterial and antifungal activity of traditional medicinal plants used against venereal diseases in South Africa[J]. J Ethnopharmacol,2006,103(1):139-142.
[5]陈国辉,黄文凤.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(17):1482-1485.
[6]Wei X,Zhang J,Li J,et al.Astragalus mongholicus and Polygonum multiflorum's protective function against cyclophosphamide inhibitory effect on thymus[J].Am J Chin Med,2004,32(5):669-680.
[7]国家药典委员会.中华人民共和国药典:2005年版一部[S].北京:化学工业出版社,2005:199,212.
[8]张晓君,祝晨蔯,胡 黎,等.党参多糖对小鼠免疫和造血功能的影响[J].中药新药与临床药理,2005,14(3):174-176.
[9]许爱霞,张振明,葛 斌,等.党参多糖抗衰老作用机制的实验研究[J].中国现代应用药学杂志,2006,23(8):729-731.
[10]李黎星,康杰芳.中药党参的研究进展[J].现代生物医学进展,2009,9(12):2371-2373.
[11]马雪梅,吴朝峰.药用植物党参的研究进展[J].安徽农业科学,2009,37(15):6981-6983,6993.
[12]贺 庆,朱恩圆,王峥涛,等.党参化学成分的研究[J].中国药学杂志,2006,46(1):10-12.
[13]曾琦斐.中药党参中微量元素与氨基酸含量的测定[J].中国医药导报,2010,7(19):65-66.
[14]聂晓妮,梁宗锁,段琦梅,等.土荆芥挥发油的化学成分及抗菌活性研究[J].西北农林科技大学学报:自然科学版,2010(38):151-155.
[15]段琦梅.黄 芪、党参质量评价及其提取物活性研究[D].西北农林科技大学,2010.
[16]周建新,彭雪霁,姚明兰.黄芪提取物抗菌作用及其方式的研究[J].粮食与食品工业,2009,16(6):14-16.
[17]王俊淇,邸维霞,周国林,等.党参皂甙及党参脂抗肿瘤与抗菌实验研究[J].中兽医医药杂志,1999(1):11-12.
[18]张宏愿,阎 莉.黄酮类化合物抗微生物药理学研究进展[J].抗感染药学,2009,6(2):92-95.
[19]张存莉,朱 玮,李小明,等.黑刺菝葜根中甾体皂苷抗菌活性成分研究[J].林业科学,2006,42(9):69-73.
[20]鲁曼霞,黄可龙,施树云,等.兖州卷柏化学成分及体外抗菌活性研究[J].天然产物研究与开发,2009,21(6):973-975.
