HPLC-DAD-MS/MS用于养血清脑颗粒蒽醌类成分分析
2012-07-26郝晓霞靳元鹏张兰兰周水平郭治昕
郝晓霞, 靳元鹏, 轧 霁, 张兰兰, 周水平, 郭治昕*
(1.天津中医药大学,天津300193;2.天津天士力制药股份有限公司,天津300410)
养血清脑颗粒是由天津天士力制药股份有限公司生产的一种复方中药,以川芎、当归为君药,由十一味中药采用现代化制剂工艺精制而成。养血清脑颗粒可以改善软脑膜微循环,增加脑血流量,缓解血管痉挛与止痛,具有养血平肝、活血通络之功效[1]。决明子是养血清脑颗粒中的重要药味之一[2],根据文献报道,决明子中蒽醌类成分具有降血压、降血脂、抗动脉粥样硬化等功效[3-5]。我们对养血清脑颗粒中的蒽醌类成分进行富集,并对目标部位的化学成分进行分析与研究。以蒽醌部位为研究对象,与养血清脑颗粒整体为研究对象相比,可以更好的富集其中的起效成分,不仅为养血清脑颗粒治疗偏头痛与高血压提供了物质基础,而且为其质量控制提供了支持。
1 仪器与试药
Agilent 1200高效液相色谱仪及Agilent 1200 HPLC-6310 ION Trap Mass液相色谱-质谱联用系统(美国Agilent公司);Milli-Q超纯水系统(法国 Millipore公司);乙腈(色谱级,美国Merck公司)。
芦荟大黄素(批号:110795-200806)、大黄素(批号:110756-200110)、大 黄 酚 (批 号:110796-200615)、橙黄决明素(批号:111900-201001)对照品,均购自中国药品生物制品检定所。养血清脑颗粒浸膏由天津天士力制药股份有限公司提供(浸膏批号:20100907)。
2 方法与结果
2.1 色谱条件
液相条件:色谱柱为Phenomenex C18(250 mm×4.60 mm,Gemini 5 μm);流动相 A 为乙腈,流动相B为0.5%的甲酸-水,梯度洗脱见表1。体积流量为1.0 mL/min,检测波长为 254 nm,190 ~500 nm全波长扫描,柱温为30℃,进样量10 μL。
质谱条件:检测模式为电喷雾离子化(ESI)方式,检测离子为正、负离子,扫描范围100~1000 m/z,干燥气的流量为8 L/min,干燥气的温度为350℃,雾化气的压力为241 kPa。

表1 流动相梯度洗脱程序Tab.1 Procedure of gradient elution of mobile phase
2.2 对照品溶液的制备 精密称取上述对照品(橙黄决明素5.1 mg,芦荟大黄素 2.85 mg,大黄素5.01 mg,大黄酚 4.18 mg)置于 100 mL 量瓶中,用甲醇定容至刻度,摇匀,用0.22 μm微孔滤膜过滤,取续滤液既得对照品溶液[6]。
2.3 供试品溶液的制备 精密称取未加入辅料的养血清脑颗粒浸膏100 g,用20%的乙醇溶解,以D101大孔树脂柱层析分离,用20%乙醇(5 BV)、95%乙醇(5 BV)分别洗脱,收集95%乙醇洗脱液,将目标物富集。将95%乙醇洗脱液浓缩至糊状,用30%乙醇溶液溶解,以100~200目的聚酰胺柱层析分离,30%乙醇(5 BV)、95%乙醇(5 BV)分别洗脱。收集95%乙醇洗脱液即为目标蒽醌部位。
2.4 HPLC-DAD-MS/MS特征峰归属 通过液质联用技术,结合供试品与标准品的比较可以完成对物质的定性分析[7-9]。本实验以养血清脑颗粒为研究对象,对其中的蒽醌成分进行分析,结合质谱碎片信息及混合标准品的成分比较,对特征峰进行了归属指认。供试品与对照品比较图谱见图1,供试品溶液的液质联用图谱见图2,特征峰归属指认结果见表2,部分蒽醌类物质的结构式见表3。

图1 供试品(A)与对照品(B)HPLC比较图谱1.橙黄决明素 2.芦荟大黄素 3.大黄素 4.大黄酚Fig.1 HPLC chromatograms of sample(A)and mixed standard(B)1.aurantio-obtusin 2.aloeemodin 3.emodin 4.chrysophanol

图2 养血清脑颗粒蒽醌部位LC-MS/MS联用图谱Fig.2 LC-MS/MS chromatograms of anthraquinones in Yangxue Qingnao GranuleA.ESI(+MS)B.ESI(-MS)C.ESI(+MSn)D.ESI(-MSn)E.HPLC-UV
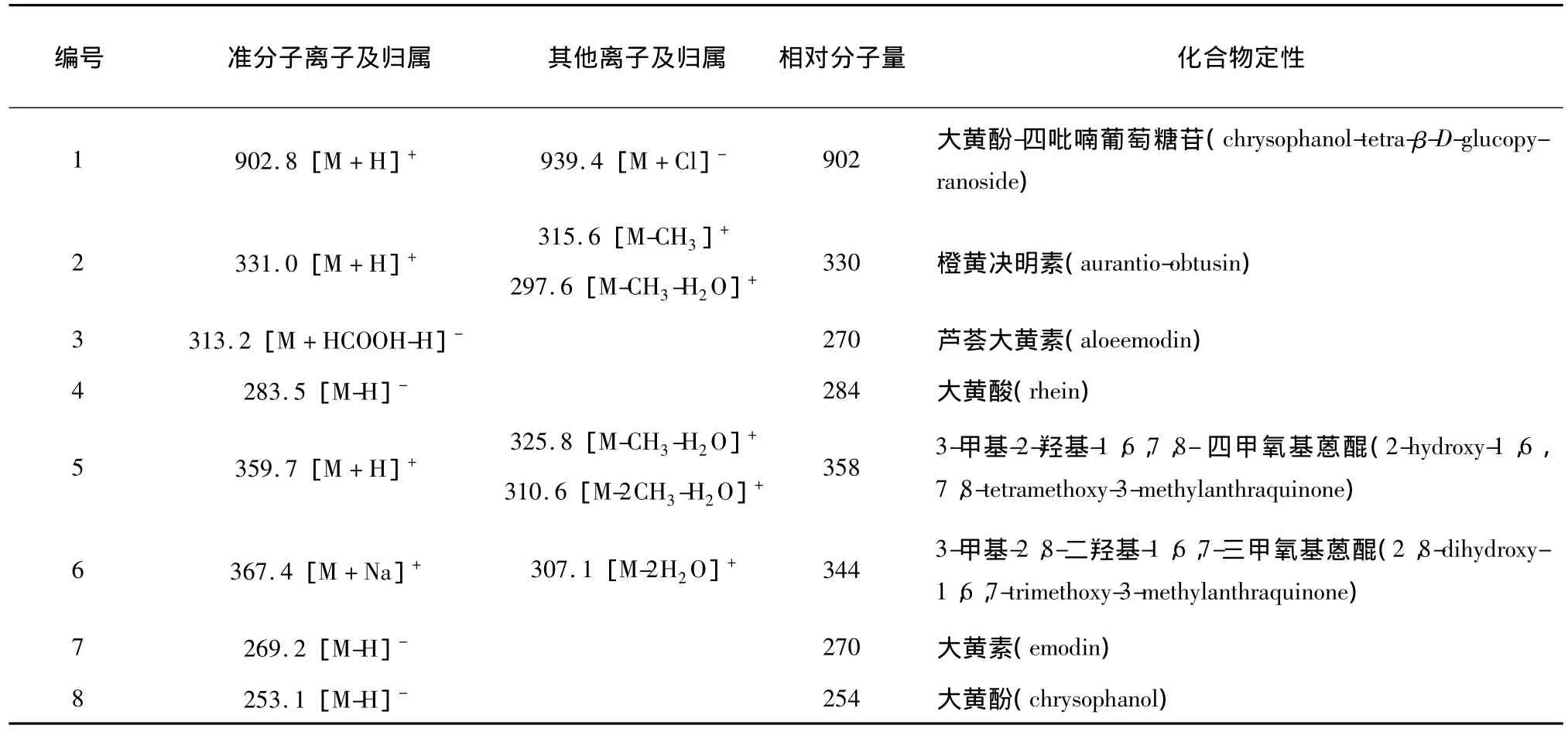
表2 养血清脑颗粒中蒽醌类成分特征峰归属Tab.2 Results of LC-MS/MS analysis of anthraquinones in Yangxue Qingnao Granule
色谱峰 1,通过 m/z 902.8[M+H]+及 939.4[M+Cl]-共同判断该物质分子量为902,结合文献报道[10]及药味归属,判断该物质可能为决明子药味中的大黄酚-四吡喃葡萄糖苷(chrysophanol-tetra-β-D-glucopyranoside)。色谱峰2,通过 m/z 331.0[M+H]+可推知该化合物的分子量为330,两个碎片离子峰 315.6 [M-CH3]+及 297.6[M-CH3-H2O]+可能通过如图3所示途径分裂而来。初步推测其可能为橙黄决明素(aurantio-obtusin)或 3-甲基-1,2,8-三羟基-6,7-二甲氧基蒽醌(1,2,8-trihydroxy-6,7-dimethoxy-3-methylanthraquinone)[2],这两种成分为同分异构体,难以通过质谱数据进行鉴别,而在相同的色谱条件下,橙黄决明素(aurantio-obtusin)标准品与供试品溶液中该物质保留时间相同,最终判断该物质可能为决明子药味中的橙黄决明素(aurantio-obtusin)[11]。色谱峰 5,通过 m/z 359.7 [M+H]+推测它的分子量为358,而其他质谱碎片离子峰325.8[M-CH3-H2O]+、310.6[M-2CH3-H2O]+的结构推导如图4。结合文献报道[10]及药味归属,该物质可能为决明子中的 3-甲基-2-羟基-1,6,7,8-四甲氧基蒽醌 (2-hydroxy-1,6,7,8-tetramethoxy-3-methylanthraquinone)。色谱峰6,通过m/z367.4[M+Na]+推测其分子量为344,307.1[M-2H2O]+可能为3-甲基-2,8-二羟基-1,6,7-三甲氧基蒽醌(2,8-dihydroxy-1,6,7-trimethoxy-3-methyl anthraquinone)脱掉两分子水所得,结合文献报道及药味归属,推测其可能为 3-甲基-2,8-二羟基-1,6,7-三甲氧基蒽醌(2,8-dihydroxy-1,6,7-trimethoxy-3-methylanthraquinone)[2]。芦荟大黄素 (aloeemodin)、大黄酸(rhein)、大黄素(emodin)、大黄酚(chrysophanol)[13]质谱碎片离子峰分析如表2,且供试品与混合标准品溶液在相同的色谱条件下对应物质保留时间一致,进一步验证了结构推测的准确性。
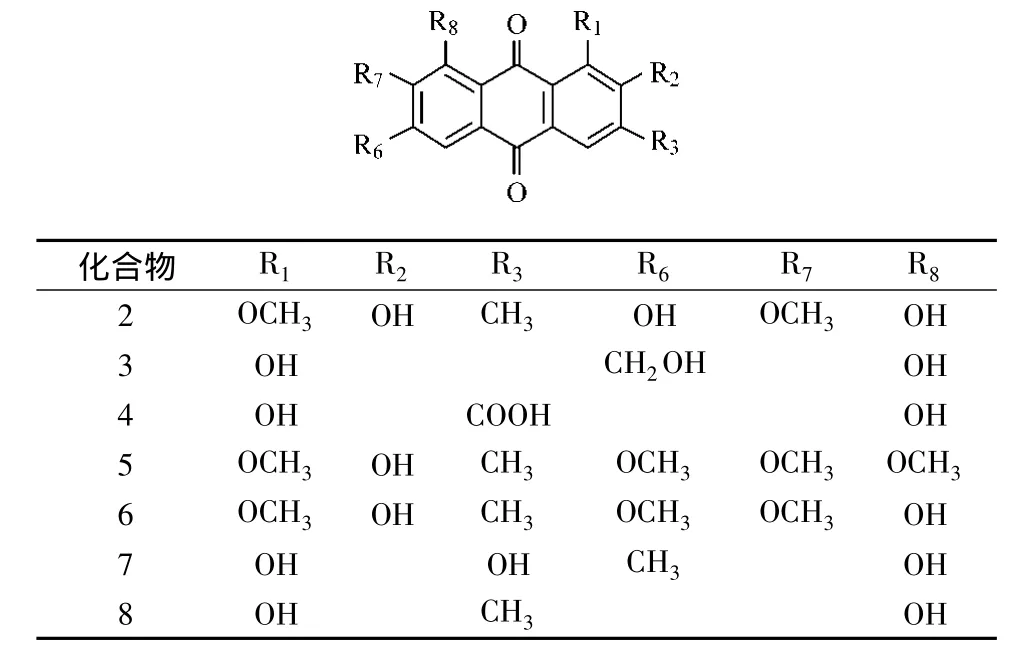
表3 部分蒽醌类物质的化学结构式Tab.3 Chemical structures of anthraquinones in Yangxue Qingnao Granule
2.5 特征成分的定量测定 已鉴定成分中,目前有标准品的物质为橙黄决明素、芦荟大黄素、大黄酸、大黄素及大黄酚,但是在目前的色谱条件下,大黄酸及大黄酚达不到定量测定分离度的要求,因此对已鉴定成分中的橙黄决明素、芦荟大黄素及大黄素3个物质定量测定。
2.5.1 线性关系考察 吸取适量2.2项的混合标准品溶液,以峰面积(A)为纵坐标,进样体积(μL)为横坐标进行线性回归分析。线性回归方程:橙黄决明素 Y=21.117X+1.4833,r2=0.9998,线性范围为0.05 ~ 0.5 μg;芦荟大黄素 Y=113.45X+9.6952,r2=0.9998,线性范围为 0.03 ~ 0.3 μg;大黄素 Y=128.77X+7.5976,r2=0.9999,线性范围为 0.05 ~0.5 μg。结果表明,橙黄决明素、芦荟大黄素及大黄素在一定的线性范围内均有良好的线性。

图3 化合物2(橙黄决明素)的主要碎裂途径Fig.3 Proposed fragmentation pathways of aurantio-obtusin

图4 化合物5(3-甲基-2-羟基-1,6,7,8-四甲氧基蒽醌)的主要碎裂途径Fig.4 Proposed fragmentation pathways of 3-methyl-2-hydroxyl-1,6,7,8-tetramethoxy-anthraquinone
2.5.2 样品测定 精密称取蒽醌部位720 mg,置于25 mL的量瓶中,甲醇溶解,定容至刻度,进样10 μL。以外标法计算目标蒽醌部位中的橙黄决明素、芦荟大黄素及大黄素的量,结果显示3种蒽醌的质量分数分别为:橙黄决明素15.76 mg/g,芦荟大黄素 0.40 mg/g,大黄素 1.37 mg/g。
2.5.3 加样回收率 精密称取蒽醌部位360 mg,分别加入相应量的对照品贮备液,测定回收率,平行6份。计算加样回收率,橙黄决明素、芦荟大黄素、大黄素的加样回收率分别为 98.6%,99.2%,102.5%,RSD 分别为 3.1%,2.6%,4.2%。
3 讨论
3.1 蒽醌部位制备方法的选择 养血清脑颗粒由十一味中药组方而成,成分复杂,而蒽醌类成分为养血中药决明子的主要药效成分。郝延军等[12]以决明子为研究对象,通过不同吸附树脂的比较,最终发现聚酰胺对决明子中的蒽醌物质富集效果最好,这种分离方法同时可以避免有毒有害有机试剂(如三氯甲烷等)的使用。养血清脑中蒽醌类成分极性较小,本实验先通过D101大孔树脂进行初步富集,除去大极性的干扰物质,而可能的药效成分则进一步通过聚酰胺柱层析得到,两种填料的结合使用可以更好的减少大极性物质的干扰,更加有效的富集蒽醌部位。
3.2 液相色谱条件的优化 选用了3根不同厂家的色谱柱进行实验,比较分离度、峰形与柱效,最终确定为Phenomenex C18(250 mm×4.60 mm,Gemini 5 μm)液相色谱柱。考察了不同的流动相系统,最终确定以乙腈-0.5%甲酸为流动相较为适宜。以获得最多的峰信息为基准考察,通过DAD选择最佳吸收波长,最终确定蒽醌部位最佳吸收波长为254 nm。
HPLC-DAD-MS/MS分析技术广泛应用于中药复方制剂分析,结合分子量与碎片离子的双重信息,可以对复方中的化学成分进行快速准确的鉴定。这种分析方法准确性较高,对某些同分异构体也可以得到很好的分析。本实验首先通过有效的分离手段把养血清脑颗粒中的目标蒽醌进行富集,然后对此目标部位进行分析,最终确定了养血清脑颗粒中的8个蒽醌类特征成分。
3.3 部分特征峰的指认 由HPLC-MS数据及文献报道[10],初步推测1号峰可能为大黄酚-四吡喃葡萄糖苷。实验中由于标准品的缺失,该特征峰的鉴定准确性有待于进一步验证。
决明子具有较好的降血脂、降血压、抗氧化、抗衰老等疗效[13],是养血清脑颗粒中非常重要的一味佐药。其中蒽醌类成分是决明子主要的药效成分[13],因而深入研究养血清脑颗粒中的蒽醌类成分对养血清脑颗粒的质量控制及药理药效研究均具有重大意义。本实验通过富集、分析养血清脑颗粒中的蒽醌类成分,推测养血清脑颗粒可能的药效成分,为进一步的药理实验提供物质基础。养血清脑颗粒中的蒽醌类及其他成分分析、对养血清脑颗粒治疗高血压与偏头痛的研究也正在开展中,深入工作将会在后续文章中报道。
[1]高 钧,孙玉侠,李 伟,等.HPLC法测定养血清脑颗粒中马兜铃酸 A[J].中草药,2005,36(6):851-852.
[2]李文博,韩建平,高 钧,等.养血清脑颗粒的高效液相色谱指纹图谱研究[J].分析化学研究简报,2011,39(3):387-391.
[3]郭 威,王少云.决明子鉴别及其主要有效成分含量测定的研究[D].山东大学,2008.
[4]张加雄,万 丽,胡轶娟,等.决明子降血脂有效部位的研究[J].时珍国医国药,2006,17(6):904-905.
[5]张 毅,黄小平,翁代群,等.HPLC测定不同产地决明子中蒽醌类成分[J].中国中药杂志,2008,33(23):2797-2798.
[6]张依倩,王 玉,黄芝娟,等.基于HPLC-DAD-MS的道地产区大黄药材质量评价研究[J].药物评价研究,2011,34(3):179-183.
[7]许重远,陈振德,张 焜,等.HPLC-MS-MS分析复方茵陈黄连汤中抗 HBV活性部位主要成分[J].中药材,2008,31(12):1839-1840.
[8]孙 慧,朱 超,章弘扬,等.大黄及其炮制品的液质联用分析及物质基础比较[J].中成药,2009,31(3):420-424.
[9]李文兰,代歧昌,季宇彬,等.HPLC-ESI/MS分析八珍汤化学成分及来源[J].中国药学杂志,2009,44(21):1622-1626.
[10]张开庆,谢 亚,梁 勇.高效液相色谱-电喷雾电离质谱联用研究决明子提取物中的化学成分[J].华南师范大学学报:自然科学版,2008,5(2):88-94.
[11]胡轶娟,朱 军,万 丽.决明子HPLC指纹图谱研究[J].中国中医药科技,2008,15(5):365-367.
[12]郝延军,赵余庆.决明子活性成分及总蒽醌提取工艺研究[D].辽宁中医学院,2001.
[13]刘 斌,巩鸿霞,肖学凤,等.决明子化学成分及药理作用研究进展[J].药物评价研究,2010,33(4):312-315.
