核磁共振成像控制的聚焦超声产生的骨骼高温:控制战略与给药技术
2012-07-24RobertStaruchBASc
Robert Staruch, BASc
Rajiv Chopra, PhD1,2
Kullervo Hynynen, PhD1,2
核磁共振成像控制的聚焦超声产生的骨骼高温:控制战略与给药技术
Robert Staruch, BASc1
Rajiv Chopra, PhD1,2
Kullervo Hynynen, PhD1,2
1. 新宁健康科学中心 图像引导治疗研究中心,加拿大 多伦多;2. 多伦多大学 医学生物物理学系,加拿大 多伦多
目的通过使用核磁共振(MR)成像控制的聚焦超声产生的高温以及温度敏感性脂质体,对成像引导的骨骼给药技术的可行性进行评估。材料与方法本文中实验均经动物保护制度委员会批准。研究人员通过使用核磁共振测温技术进行闭路温度控制,进而使用聚焦超声在9只兔子(受测对象)大腿骨骼与肌肉界面处直径10 mm的区域内获取加温效果。热敏脂质体包裹的阿霉素受到加热过程的影响而得到系统地释放。在本实验中,4只受测对象(兔子)的核磁温控图像中心点定位于距离骨骼10 mm处,另5只的图形则定位于骨骼上,对于所有的受测对象,研究人员均对加温过程的均一性和药物的定位载带进行了评估, 并模拟计算骨骼的温度变化。通过测量从骨髓和肌肉中提取的阿霉素荧光强度,研究人员得以量化测量给药效果,并通过单侧Wilcoxon符号秩次检验(Wilcoxon Signed-Rank Test)将处理过的与未经处理的对象部位进行对比。结果在超声聚焦-核磁共振温控面距离骨骼0 mm和10 mm的情况下,平均目标区域温度分别为43.1℃和 43.3℃;估测骨骼温度分别为46.8℃和78.1℃。10 mm测试组的对象体内观测到热烧蚀;估测骨骼肌肉界面的肌肉温度为66.1℃。阿霉素浓度在加热与未加热的骨髓(增加8.2倍, P =0 .002)和肌肉(增加16.8倍, P = 0.002)中均有显著差别,意味着骨骼局部给药可能伴随着高温和热烧蚀。结论通过使用核磁共振成像控制的聚焦超声和温度敏感型药物载体,可以通过骨骼局部高温而进行成像引导的定位给药。
大约 70% 乳腺癌和前列腺癌晚期患者[1]会发生骨转移。 患者的生命质量备受病理性骨折、脊髓压迫、高钙血症、虚弱无力等后遗症的损害。对于骨骼转移性肿瘤引发的局部疼痛,缓和放疗是常规治疗手段,但有 20%~30% 患者的痛苦并未得到充分缓解[2]。对某些患者来说,二磷酸盐疗法减缓骨骼并发症及其病痛[3-4]的发生,在打破肿瘤演化和破骨细胞介导的骨吸收的恶性循环方面显示了潜力。
因病痛过重而难以接受放疗和二磷酸盐疗法或系统化疗的患者,可以通过超声或CT成像引导的皮下穿刺射频烧灼术去除骨膜的神经末梢并减轻肿瘤负荷[5-6]以缓解疼痛。通过使用核磁共振成像引导的聚焦超声产生的热烧蚀证明了由于溶骨和成骨细胞的肿瘤骨转移加剧的疼痛可得到有效缓解,这些患者已深受其他所有治疗方法[7-9]的折磨。聚焦超声相对于高频烧蚀术有诸多优势,最重要的是不会造成更大的灼伤。
提高热疗功效的一种方式是温度控制与抗癌药物相结合。多种化疗药物在轻微加热的情况下结合使用时会产生更高的细胞毒性,并且被长循环纳米物质形成的微囊泡(例如聚乙二醇微脂囊)包被载带,这种载带效果也同样可以被微热[10]加强。热敏脂质体可以在被加热至 40℃后的 10~20 s[11]内释放其载带成分,在非致死程度的加热范围内[12]迅速产生细胞毒性。在最近的研究中,研究人员联用射频切除技术与热敏脂质体药物载体对肝癌进行治疗,并对其效果进行了评估[13]。在使用热敏脂质体的过程中,核磁共振成像引导的聚焦超声局部加热技术被用来实现药物定位释放[14]。
在深受骨转移瘤折磨的患者中,热缓痛结合局部药物释放会在治疗区域中杀死更多细胞,并减少达到治疗效果所需的能量,潜在地减少了治疗时间和正常组织损伤的风险。通过用超高热而不是高温热烧蚀引导的局部药物释放可以减少治疗中的疼痛并在不破坏骨骼稳定的情况下抑制局部肿瘤。这种非侵害性局部疗法的关键在于在给周围组织加热量最少的情况下维持目标区域的必要温度。
核磁共振温度测定法的闭路反馈控制下的聚焦超声技术已被应用于软组织[15-17]的非侵害性精确加热,核磁共振成像也被应用于目标定位和骨聚焦超声[18-19]效果的评估。核磁共振测温技术无法准确获取骨皮质的温度,这给控温过程增加了一定困难。在本研究中,研究人员开发了一种反馈控制系统,该系统包含核磁共振测温装置,以便在测量邻近软组织温度的基础上维持所期望的骨温。研究人员还评估了该系统为局部药物传输而形成骨骼局部超高温的能力。
本研究的目的是探讨利用核磁共振成像引导的聚焦超声产生的超高热和热敏性微脂囊药物载体完成成像引导的骨骼药物定位释放技术的可行性。
1 材料与方法
多柔比星脂质体(脂质体 ;Celsion,劳伦斯维尔,新泽西州)由制造商提供。数据的控制和提交出版的信息均由本文作者独立完成。
1.1 动物样品
本研究中的实验已获 Sunnybrook 研究院动物保护委员会批准。9 只 3~4 kg 的雄性新西兰白兔(Charles River Laboratories,舍布鲁克市,魁北克省,加拿大)肌肉被注射氯胺酮(50 mg/kg/h)和甲苯噻嗪(10 mg/kg/h)进行麻醉。被麻醉的兔子一只耳朵被插入导管,两条后腿经过脱毛处理,被置于核磁共振成像兼容的聚焦超声系统的脱气水槽的平台上(图 1)。过高热期间,研究人员通过使用光纤温度探针(3100;Luxtron, Santa Clara, 加州)来监控直肠温度,并通过手动调节动物身上水热毯和下面脱气蓄水池的温度来维持直肠温度。
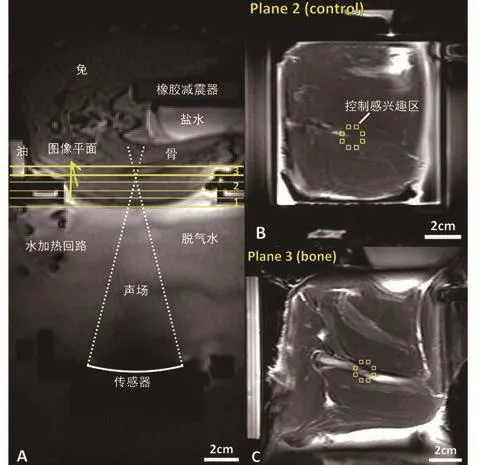
图1 核磁共振成像定位的聚焦超声加热骨骼的实验装置。A,沿超声声束路径的轴向定位器核磁共振成像展示了用于磁共振测温的3个冠状面(1,2,3)的位置,其中2个见B和C。B,骨界 面周边肌肉的冠状T2加权快速自旋回波磁共振成像(重复时间ms/回波时间ms,2000/75),依靠核磁共振测温控制升温过程。C,冠状T2加权骨纵切面核磁共振成像,磁共振测温用来探测邻近骨骼处的过度加热。
1.2 聚焦超声系统
研究人员通过背面通风的球状聚焦超声发射器(基本频率 :0.536 MHz ;曲率半径 :10 cm ;孔径 :5 cm)的连续声波法传输超声能量,该换能器是通过任意波形发生器(33250 A ;Agilent,米西索加,安大略省,加拿大)和射频放大器(NP2912 ;NP Technologies,纽波利公园,加州)在其第 5 谐波(2.787 MHz)下运作的。电能经过功率计(438 A ;Hewlett Packard,帕洛阿尔托,加州)和双向耦合器(C1373 ;Werlatone,布鲁斯特,纽约)测定。发射器经过被动耦合电路对放大器阻抗匹配。在基本频率下,用辐射技术测量得到的射频的声功率为实用电功率(向前传递的总量减去反射量)的 70%,该功率用于计算在声波中达到预期声功率所需的电功率。
本研究中,研究人员通过一个能与核磁共振成像系统兼容的固定装置(与 Chopra 等人[21]文章中介绍的系统功能类似)安装超声发射器,并将发射器的移动轨迹设定为直径 10 mm 的圆形轨迹,移动速率设为周 /s,以保证超声加热与核磁成像测温系统的同步性。除气水透过 25 μm的聚酰亚胺薄膜(Kapton ;DuPont,威明顿,特拉华州)孔与换能器耦合进入目标后腿区域。该腿被固定于某一位置,以便超声波能够近似垂直入射穿过表皮并聚焦于骨肉接面上。为避免对侧的后腿受到额外的加热,研究人员在兔子的两腿之间[22]放置了生理盐水袋和聚氨酯橡胶声学减 震 器(AptFlex F28; Precision Acoustics, 多 尔 切 斯 特,英格兰)。
1.3 核磁共振成像控制的聚焦超声过高热
研 究 人 员 利 用 临 床 在 用 的 1.5-T 磁 共 振 仪(Signa ;GE,沃基肖,威斯康星州)中安装的固定装置完成该实验。用核磁共振成像定位的聚焦超声对骨肉接面处直径 10 mm区域的大腿肌肉加热至 43℃达 20 min。通过优化温度的提升速度和加热时间,研究人员可以在大腿肌肉不导致大面积组织损伤[23]的情况下使热敏性微脂囊[11]中的药物得到充分释放。
一副带有 85 mm 方形孔的单回路接收线圈被置于动物下方聚酰亚胺薄膜孔周围,以改善加热区域的信噪比。在加热前,研究人员用目标清晰度和声学耦合确认的T1加权和 T2 加权(表 1)核磁共振成像技术获取了解剖学影像。加热后再次获取这些影像以对组织灌注和/或超声加热导致的组织损伤的变化进行评估,这些组织被钆强化圈鉴定为信号强度增强或减弱的区域。研究人员在对耳部血管静脉注射核磁共振成像造影剂(0.2 mmol/kg 钆双铵 ;GE,米西索加,安大略,加拿大)前和 1 min 后获取了声波法处理后的 T1加权影像。
在超声发射器的机械扫描期间,冠状快速导流梯度回波成像是在3个空间平面连续截取的:骨骼所在位置,骨下肌和靠近表皮的肌肉(图 1)。每获取一张新的图片后,一个实时获取界面程序[24-25]会将 K 空间数据转移至一台处理器,该处理器通过使用 Matlab(MathWorks, 纳蒂克,马萨诸塞州)编码的程序进行图像重建和空间温度分布的计算。研究人员通过治疗影像[26]和在加热前发射器移动时获取的 5 个基线影像的平均数之间的复合相位减法,计算出相位差图谱,通过核磁共振频移系数(每摄氏度下降百万分之 0.010)[26]获得了温度图谱,并加上光纤直肠探头测得的基线温度。上述信号减去透过矿物油参照物中 25~35 mm2影像的平均温度以

对于第 n 幅温度成像,温度 T1,…8(8 个预设的 1 mm2控制区域)与目标温度 Tgoal之间的差异,以及之前每一幅的温度成像 i与目标温度的差异,通过比例积分常数 KP和 KI加权之后,作为每个预设区域声功率的调整标准,P1,…P8。数据传送、重建和控制器更新的平均延迟时间不到 1 s。
研究人员研究了两种温度控制方案:第一种,将温度信号采集区域定位于距离骨骼界面 10 mm 处,采用的比例积分常数(K=4.5,K=0.03)[14]为之前研究中报道的肌肉
PI控温参数设定;第二种,将温度信号采集区域定位于骨骼界面上( 距 离 为 0 mm),采用的比例积分常数(KP=3.0,KI=0.0)(附录 E1[网上可见 ])通过计算机模拟聚焦超声加热实验获取。对上述两种方案,计算机模拟还被用来估算骨骼和骨髓的温度变化数据。
要评估时间和空间加热的一致性,每个采样区域,每个时间点上,需要测得以下 3 组温度数据 :平均温度、T90(90% 目标区域超过的温度)和 T10(10% 目标区域超过的温度)。当测量区域的温度变化达到预设变化值的95%之后,在所有观测区域,上述3组参数的稳态平均值和方差均需要实时观测记录。测量范围内的加热计量可以用 Sapareto和 Dewey 时间 - 温度方程式以 43℃下累积受热以分钟数为单位进行计算。
1.4 药物注入和组织采集
研究人员用等量溶解性阿霉素热敏脂质体稀释为 2.5 mg/kg的阿霉素溶液和5%的葡萄糖无菌溶液,在过加热操作过程中目标区域平均温度达到 43℃时,以 1.2 mL/min 的速度输入兔子的耳部血管。每只实验对象加热一条腿;另一条腿作为实验对照。其中4只兔子用来对照的聚焦和成像平面定位于距大腿骨 10 mm 处,另 5 只兔子定位于 0 mm 处。获取磁场中的信号偏移[26]。随后计算时长 30 s 的移动时间窗口的平均温度,该移动时间窗口在减少成像过程中[14]循环发射器的移动引发的周期敏感性相位偏移的影响的功效已得到验证。
研究人员利用沿扫描的加热轨道的8个独立比例积分反馈控制器控制与骨骼相接的肌肉的空间温度分布,快速地按照沿轨道扫描轨迹测算的功率调整发射器的功率,并按照下列方程在每次获得图像之后进行控制器输出的更新:

表1 核磁共振成像参数
在输注溶解性阿霉素热敏脂质体 2 h 后,研究人员在采集组织样本前,通过输注生理盐水冲洗未被吸收的脂质体以免影响对药物释放的评估。动物死亡后,研究人员从处理过的实验对象大腿的目标区域和未处理的相应部位采集 10 mm厚的大腿骨(包括骨髓)轴向切片和 50~100 mg 相邻肌肉的样本,并迅速放入液氮中在 -80℃下冷冻储存。
1.5 大量组织样本的药物浓度分析
研究人员通过从经均质化的组织样本[28]中提取的阿霉素的荧光亮度,测出组织中阿霉素的主要聚积区域。在用组织磨碎器(PYREX Ten Broeck ;康宁公司,纽约)均质化前,组织样本经过称重并置于 20 倍体积的酸化乙醇萃取剂(0.3N 盐酸与 50% 乙醇混合溶液)中,隔夜后在酸化乙醇溶剂中冷藏,离心分离(16000 克,30 min)并在无光条件,-20℃下存储上清液。研究人员在 3 mL 的荧光测定皿中的 0.5 mL 上清液中加入共计 1.5 mL 酸化乙醇,用激发波长 480 nm、吸收波长590nm 的台式荧光计(VersaFluor;Bio-Rad 实验室,赫克里斯,加州)测定荧光强度,并通过加入到 1.5 mL 酸化乙醇中的 0.5 mL 空白组织匀浆中的游离阿霉素(盐酸阿霉素 ;Teva Novopharm,多伦多,安大略,加拿大)连续稀释的校正曲线,衡量与阿霉素聚积点荧光强度对应的阿霉素浓度。
1.6 统计学分析
2 结果
2.1 核磁共振成像控制的聚焦超声过高热
图 2 中 A 和 B 展示了在加热开始后选定的 10 min 内,对应图 1B,C 所描述的相同冠状成像平面上温度超过37℃时,相应部位的温度分布。在图 2,B 中,由于信噪比过低而无法精确测温的骨骼像素点均被消去,未予显示。在本实验中,研究人员将聚焦点与置于骨骼下方用于温控的厚度 5 mm 的成像平面的顶端,设在肌骨连接面上。控制平面的 10 mm 目标区域内的温度变化以及应用于每个控制点的声波能量的实时变化,见图3。在每个时间点上,实验人员均测得平均温度值、T90和 T10数值,相当于距循环目标边缘 10~12.5 mm 未加热区域的平均 温 度, 控 制 器 设 定 温 度 Tgoal, 以 及 输 注 可 溶 性 阿 霉 素热敏脂质体的始终时间。图4()的格式展示了受测骨骼区域和对照区域的径向稳态温度分布以及目标平面上的中心加热计量结果。表2总结了所有超高热实验数据,表明稳态平均温度值、T90和 T10值分别为 43.2℃、42.0℃ 和 44.4℃, 在 整 个 实 验 持 续 过 程 中 温 度 测 量 标 准差为 0.4℃。制的肌肉温度信号;B图:实验区域温度信号,其中骨骼信号由于强度过弱而被剔除。图像采集于开始加热后10 min。FOA=视野宽度。
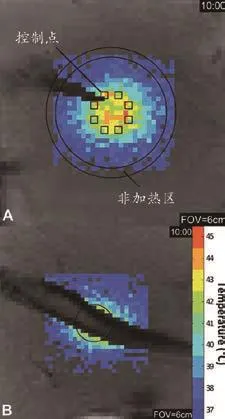
图2 通过核磁共振成像定位的聚焦超声引发的的(兔子大腿)肌肉-骨界面的过高热的温度分布快速成像。感兴趣的控制区域,感兴趣的圆形未加热区域,以及高于37℃的温度均被覆盖在冠状快速变质梯度回波图像上。A图:用于反馈控
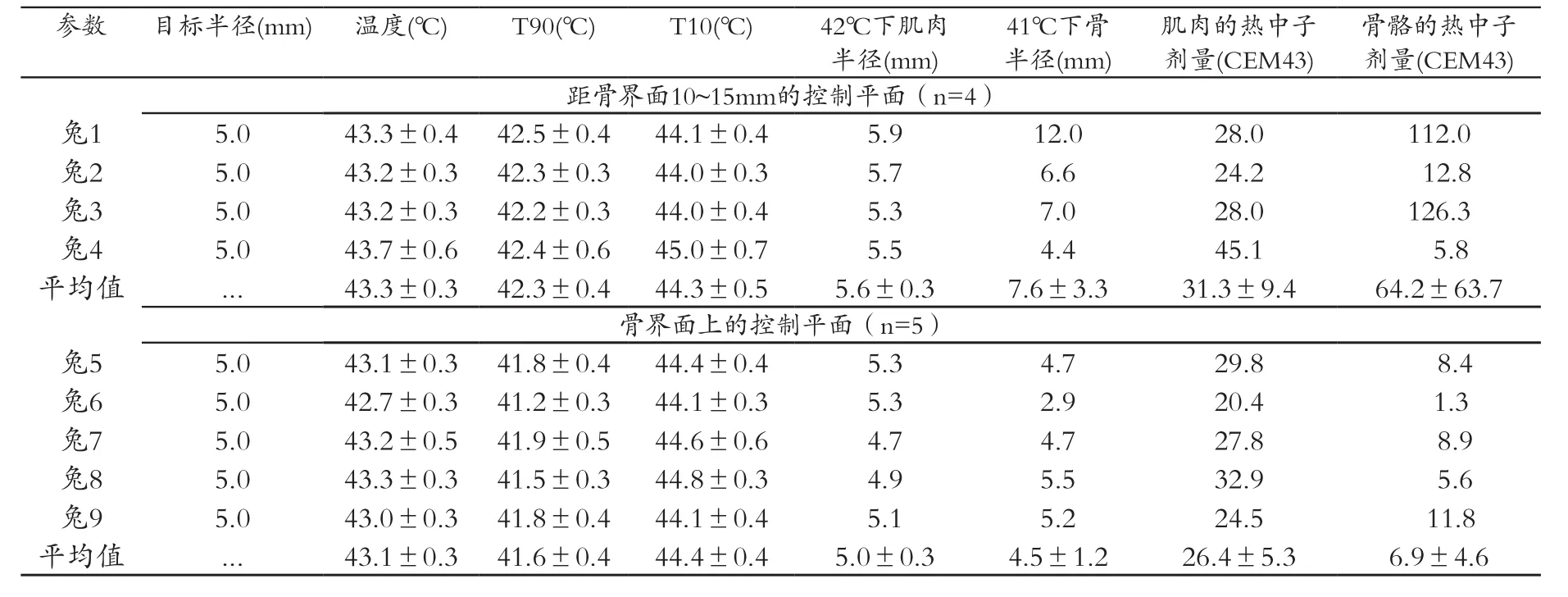
表2 分别以肌肉和骨骼为目标在兔腿内行体内MRI控制的聚焦超声超高温试验参数
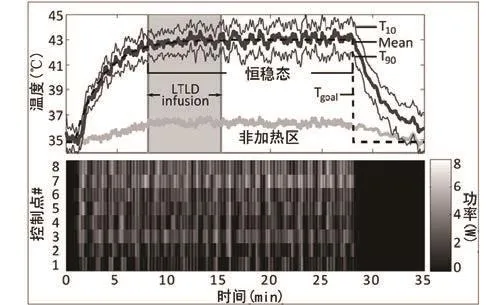
图3 在与图2所示同一组实验中通过核磁共振成像定位的聚焦超声在兔子大腿的肌肉-骨界面造成的温度变化随时间变化曲线。上方图表显示的是相关区域平均温度、T90和T10(在温控平面的直径10 mm的目标区域测得)。灰色区域表示脂质体输注的持续时间。
下图:8个控制区域中每个区域在每个时间段的声功率。LTLD=可溶性阿霉素热敏脂质体。
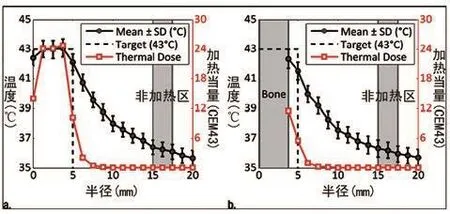
图4 与图2/3所示同一组实验中,(a)对照组和(b)骨骼加热平面的加热当量和稳态温度的径向分布图。该数据中骨骼温度数据被剔除,感兴趣区域中未被加热部分被阴影标出。CEM43=43℃下每分钟加热产生的热当量。
2.2 核磁共振成像控制超高温期间骨骼升温的数字模拟
研究人员通过数字模拟技术(附录 E1 [网上可见 ])计算了聚焦于骨骼界面以及该界面 10 mm 处的聚焦超声加热信号在图 5,A所示部位引起的骨骼部位温度变化。同一平面中计算得到的温度数据的平均值也被算出。图 5,B展示的是对照平面中,聚焦平面距离骨骼0 mm 和 10 mm 时该平面中的温度分布,控制区域的平均温度接近 43℃,近似于活体样本的测试结果。图 5,B 中相应的箭头状图像显示出聚焦平面位于距骨骼 10 mm 处的实验中,骨骼和邻近软组织的温度均有所升高。包含骨密质、骨髓和肌肉(5 mm 区域,位于骨骼界面 以下 2.5 和 12.5 mm 处)的超 声束轴线 周围直径 10 mm 区域中的温度平均值、T90和 T10值,见表 3,其中聚焦平面距离骨骼界面 10 mm 的加热方案中,实验样本的骨骼升温效应比对照样品高出 4.2~4.7 倍,聚焦平面距离骨骼界面 0 mm 的方案中实验样本的骨骼升温效应高出对照 样本的 1.1~1.8 倍。通过后处理 T2 加 权核磁成像以及对照加强 T1加权核磁成像的结果判断,聚焦平面距离骨骼界面 10 mm 的加热方案中产生的高温造成了周围组织的热损伤。骨密质中温度的变化是沿扫描轨道的高温造成的,该轨道不断调整通过传导加热中心区域的应用功率,如图6所示的模拟射线温度分布。
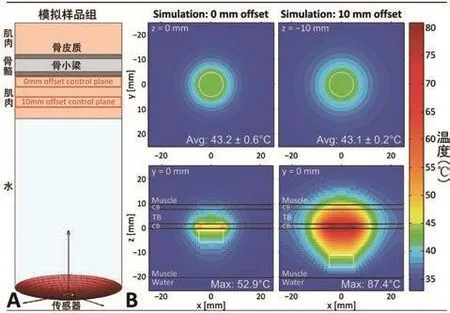
图5 核磁共振成像地暖为的聚焦超声在肌肉-骨界面产生的过高热的数值模拟试验结果。A,模拟样品组成展示,包括水分,肌肉,骨密质和骨小梁的图层,使用的组织参数见表E1(网上可见);B,左侧,聚焦面设在距骨界面0 mm处时模拟获得的平均稳态温度,由(上图)距界面0 mm的控制平面和(下图)矢状平面测出。右侧,聚焦面设在距骨界面10 mm处时模拟获得的平均稳态温度,由(上图)距界面10 mm的控制平面和(下图)矢状平面测出。
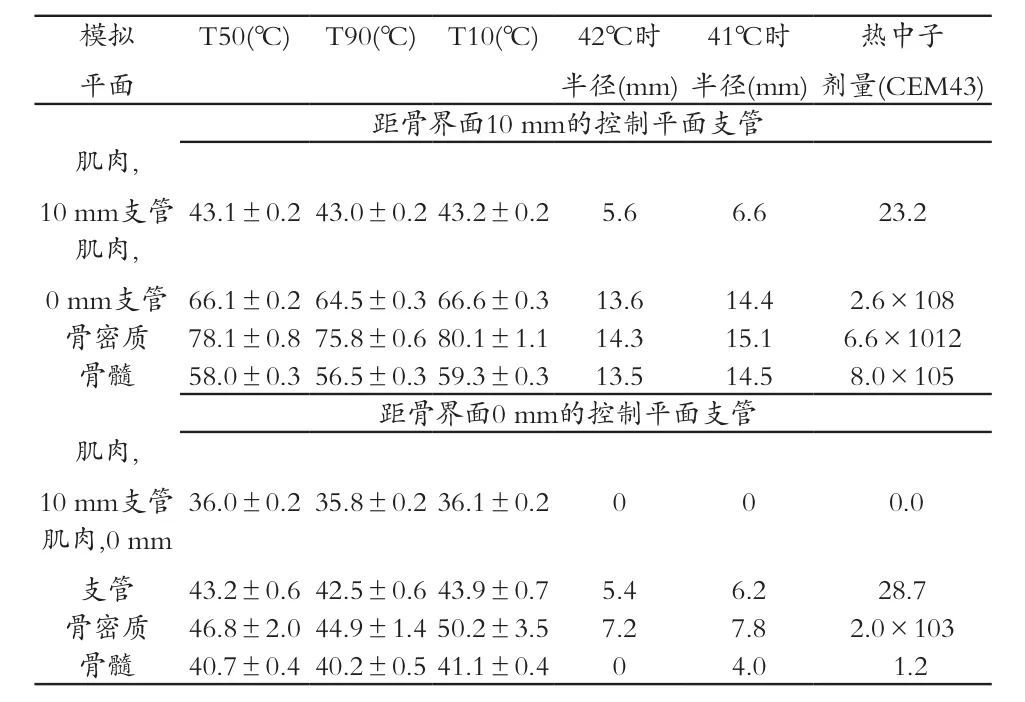
表3 核磁共振成像控制的聚焦超声骨过高热的数值模拟,在2种距肌肉-骨界面不同距离的支管处调整聚焦
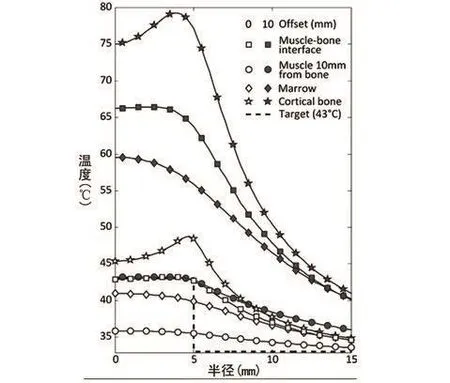
图6 2种控制方案中数字模拟得到的的稳态温度平均值的径向分布:控制平面设在距骨界面0 mm处(空心点)和控制平面支管设在距骨界面10 mm处(实心点)。对于每个方案,都由骨密质,骨髓,与骨相连的肌肉和距骨界面10 mm处肌肉测出平均稳态温度。每隔4个数据点选取一个显示于图中曲线上。
2.3 阿霉素在骨髓与肌肉中的浓度
表4展示了在每只兔子的组织样本中测得的阿霉素浓度,这些组织样本采集自已处理大腿的目标区域和未处理对侧大腿相应区域的骨髓和相邻肌肉。总地来说,每只动物样品加热中阿霉素浓度的增加分别是未加热骨髓和肌肉的(8.2±3.7)倍和(16.8±6.9)倍。图 7a 是的(所有实验中每种组织的)阿霉素浓度;对每一种组织(骨髓,P=0.002;肌肉P=0.002;单向 Wilcoxon 符号秩和检验)来说,其配对差异在统计学上都是显著的。
表4 通过组织样本(采集自兔子大腿肌肉和骨髓的加热与未加热区域)中的荧光强度测得的阿霉素浓度
图 7b展示了划分成对比试验(聚焦平面距离骨骼界面10~15 mm 对比 0 mm)的阿霉素浓度数据。研究人员用骨界面上的控制平面测得,加热时阿霉素浓度的增加分别是未加热的骨髓和肌肉的(9.9±3.3)倍(P=0.03)和(18.2±8.7)倍(P=0.03) 甚至更高。聚焦 平面置于 距骨界面 10~15 mm。时倍数有所增加,但对于骨髓来说只增加(6.1±3.3)倍(P=0.06),对于肌肉增加(15.1±4.1)倍(P=0.06),在统计学上并不显著。
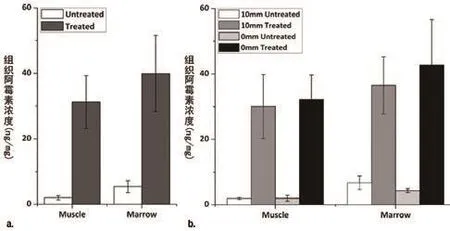
图7 通过组织样本(取自兔子大腿肌肉和骨髓的加热与未加热区域)的荧光强度测得的阿霉素平均浓度。图表显示通过所有实验得出的平均数据(a)和聚焦面距离骨骼10 mm和0 mm 两个实验的数据(b)。误差线=标准差。
3 讨论
在本研究中,研究人员通过使用核磁共振成像定位的聚焦超声加热和热敏微脂囊完成了非侵入式的骨骼中成像定位的药物释放,通过扫描聚焦超声使一个骨界面上的直径 10 mm 圆形区域的温度达到 43℃,并通过控制超声功率(根据相邻软组织的核磁共振成像温度测量)将此温度维持 20 min。加热期间对实验样本注入可溶性阿霉素热敏脂质体溶液导致了骨髓和骨界面处肌肉局部药物沉积的增加。
研究人员推荐通过质子共振频移核磁共振测量相邻软组织的温度来控制自动反馈控制环路中的局部骨骼加热。质子共振频移技术是基于水质子周围的局部磁场中温度变化的关系,在含水量低的组织,如骨骼、脂肪和肺方面的应用也有限。相位减法对于成像区域周围的组织位移和组织移动引起的磁场扭曲同样具有敏感性,这使得该技术对稳态温度测量仅限于固定的含水组织周边的部分。Sprinkhuizen 等人[29]已论证了,温度相关的脂肪磁化率的变化(0.0094 ppm/℃)会影响周围水分的质子共振频移场强跃变;我们计算出骨磁化系数对温度的依赖性大大降低(相对于磁化系数为-8.86 ppm[30],0.0007 ppm/℃,每摄氏度线性热膨胀系数降低 0.27×10-4[31]),而且在加热过程中不会影响邻近的软组织区域。通过将聚焦超声加热的范围扩大,研究人员发现该方法只能用于在软组织中带有超声窗口的目标区域。在高频(3 MHz)下,超声在贴近骨界面处产生升温效应,并可以通过测量相邻软组织的温度估算骨密质的温度。此方法已在本研究的 2.787 MHz的模拟实验中被证实有效。肌肉的模拟温度也证明了该方法与活体样本核磁共振温度测量值有良好的一致性。在较低的频率(1 MHz)上,骨骼的最高温度将超过相邻软组织的最高温度,并在距离骨界面更远的位置[32-33]产生,这在对成骨细胞损害病例中的厚骨密质层进行加热时可以有所帮助。包括侵入性射频加热装置在内的使用其他能源的核磁共振成像定位骨加热系统,会受到电磁加热装置与核磁共振成像的冲突的限制,并受制于骨骼的弱导电性(进而削弱加热效果)[34]。
其他使用热敏微脂囊的临床前研究已经证实,在组织样本(采集自动物肿瘤)和(经过水[35-36],微波加热[12]和超声[14-37]加热的)肌肉中,药物浓度增加了 10~20 倍。通过使用射频烧灼术[38],非热敏性微脂囊在肿瘤、肾脏和肝脏的烧灼损伤周围也产生了相似的增倍效果。我们的研究结果表明在骨髓和(与骨相邻)肌肉中,加热区域比未加热相应区域的药物浓度分别增加 6.1 倍和 15.1 倍,进而证明了影像定位骨骼附近药物释放的可行性。在研究中,我们在加热期间注射微脂囊,并利用被均匀化的骨髓肌肉样本中释放的阿霉素的荧光强度对药物沉积进行量化。临床药物代谢动力学数据显示,如果在输注后实施 30~60 min 加热[13],药物沉积效果可能更显著。万一发生热损伤,血管可能关闭以免微脂囊进入目标区域同时阻止组织中释放的药物返回脉管系统,再次凸显了输注时间的选择和目标温度的重要性。未来的研究将集中于药物注入和加热方式的优化以及组织学检查的执行,以便根据加热组织热损伤确定阿霉素的空间分布。
实际应用:在核磁共振成像引导的聚焦超声骨热烧蚀的临床研究中,磁共振测温被应用于治疗期间监控软组织的温度升高,以帮助临床医生调整治疗参数,以及避免对周围组织的额外热损伤[7-9,19]。现有系统能够通过闭路磁共振测温控制软组织中的温度[39],也能对骨骼的控制即时加热采取本文所提供的方法。我们得出的结果表明,将聚焦平面定位于骨界面时,研究人员可通过测量相邻软组织的温度,在临床治疗中估计骨骼的温度并将其控制在安全的范围内。研究结果还证明了多图层变换温度测定法对观察超声聚焦平面之外的加热状况的重要性,该技术现已实现商业化[40]。
通过使用高频烧蚀产生的热烧蚀治疗肝细胞癌[41]和通过微波过高热产生的轻微加热治疗周期性胸壁乳腺癌[42]结合阿霉素热敏脂质体的临床试验目前仍处于起步阶段。在研究中,聚焦平面定位于距离骨骼界面 10 mm 处时,周边组织观察到的热损伤范围较大,而将该平面定位于距离骨骼界面 0 mm 处时,损伤范围明显减小。在上述两种加热方案中,骨髓和肌肉中的药物浓度均有显著提高。这意味医生可以在临床上在不影响药物浓度的情况下通过降低加热程度来避免额外的热损伤。下一步研究需要关注的是优化药物输注方案;在单一聚焦平面无法覆盖的大面积目标区域中进行药物定位释放需要的持续加热时间,以及确定在没有软组织的热量聚集效应时,对骨骼的局部药物释放能否达到局部镇痛或肿瘤控制的效果。
出版前本文公布情况:
10.1148/radiol.12111189 Content codes: MK, US
补 充 资 料 请 参 考 网 址 :http://radiology.rsna.org/ lookup/suppl/doi:10.1148/radiol.12111189/-/DC1
[1] Coleman RE.Metastatic bone disease:clinical features, pathophysiology and treatment strategies[J].Cancer Treat Rev, 2001,27(3):165-176.
[2] Selvaggi G,Scagliotti GV.Management of bone metastases in cancer:a review[J].Crit Rev Oncol Hematol,2005,56(3):365-378.
[3] Mundy GR.Metastasis to bone:causes, consequences and therapeutic opportunities[J].Nat Rev Cancer,2002,2(8):584-593.
[4] Coleman RE.Bisphosphonates:clinical experience[J].Oncologist,2004,9(suppl 4):14-27.
[5] Callstrom MR,Charboneau JW,Goetz MP,et al.Painful metastases involving bone:feasibility of percutaneous CT- and USguided radio-frequency ablation[J]. Radiology,2002,224(1):87-97.
[6] Dupuy DE,Liu DW,Hartfeil D,et al.Percutaneous radiofrequency ablation of painful osseous metastases:a multicenter American College of Radiology Imaging Network trial[J].Cancer, 2010, 116(4):989-997.
[7] Catane R,Beck A,Inbar Y,et al.MR-guided focused ultrasound surgery (MRgFUS) for the palliation of pain in patients with bone metastases:preliminary clinical experience[J].Ann Oncol, 2007,18(1):163-167.
[8] Gianfelice D,Gupta C,Kucharczyk W,et al.Palliative treatment of painful bone metastases with MR imaging-guided focused ultrasound[J].Radiology,2008,249(1):355-363.
[9] Liberman B,Gianfelice D,Inbar Y,et al.Pain palliation in patients with bone metastases using MR-guided focused ultrasound surgery:a multicenter study[J].Ann Surg Oncol,2009,16(1): 140-146.
[10] Kong G,Braun RD,Dewhirst MW.Characterization of the effect of hyperthermia on nanoparticle extravasation from tumor vasculature[J].Cancer Res,2001,61(7):3027-3032.
[11] Needham D,Dewhirst MW.The development and testing of a new temperaturesensitive drug delivery system for the treatment of solid tumors[J].Adv Drug Deliv Rev,2001,53(3):285-305.
[12] Hauck ML,LaRue SM,Petros WP,et al.Phase I trial of doxorubicin-containing low temperature sensitive liposomes in spontaneous canine tumors[J].Clin Cancer Res,2006, 12(13): 4004-4010.
[13] Poon RT,Borys N.Lyso-thermosensitive liposomal doxorubicin: a novel approach to enhance efficacy of thermal ablation of liver cancer[J].Expert Opin Pharmacother,2009,10(2):333-343.
[14] Staruch R,Chopra R,Hynynen K.Localised drug release using MRI-controlled focused ultrasound hyperthermia[J].Int J Hyper thermia,2011,27(2):156-171.
[15] Salomir R,Vimeux FC,de Zwart JA,et al.Hyperthermia by MRguided focused ultrasound:accurate temperature control based on fast MRI and a physical model of local energy deposition and heat conduction[J].Magn Reson Med,2000, 43(3):342-347.
[16] Smith NB,Merrilees NK,Dahleh M,et al.Control system for an MRI compatible intracavitary ultrasound array for thermal treatment of prostate disease[J].Int J Hyperthermia,2001,17(3):27 1-282.
[17] Chopra R,Baker N,Choy V,et al.MRIcompatible transurethral ultrasound system for the treatment of localized prostate cancer using rotational control[J].Med Phys,2008,35(4):1346-1357.
[18] Smith NB,Temkin JM,Shapiro F,et al.Thermal effects of focused ultrasound energy on bone tissue[J].Ultrasound Med Biol,2001,27(10):1427-1433.
[19] Kopelman D,Inbar Y,Hanannel A,et al.Magnetic resonance guided focused ultrasound surgery:ablation of soft tissue at bone-muscle interface in a porcine model[J].Eur J Clin Invest, 2008,38(4):268-275.
[20] Hynynen K.Acoustic power calibrations of cylindrical intracavitary ultrasound hyperthermia applicators[J].Med Phys, 1993,20(1):129-134.
[21] Chopra R,Curiel L,Staruch R,et al.An MRI-compatible system for focused ultrasound experiments in small animal models[J].Med Phys,2009,36(5):1867-1874.
[22] Hynynen K.Hot spots created at skin-air interfaces during ultrasound hyperthermia[J].Int J Hyperthermia,1990,6(6):1005-1 012.
[23] McDannold NJ, King RL, Jolesz FA,et al.Usefulness of MR imaging-derived thermometry and dosimetry in determining the threshold for tissue damage induced by thermal surgery in rabbits[J].Radiology,2000,216(2):517-523.
[24] Tang K,Choy V,Chopra R,et al.Conformal thermal therapy using planar ultrasound transducers and adaptive closedloop MR temperature control: demonstration in gel phantoms and ex vivo tissues[J].Phys Med Biol,2007,52(10):2905-2919.
[25] Santos JM,Wright GA,Pauly JM.Flexible real-time magnetic resonance imaging framework[J].Conf Proc IEEE Eng Med Biol Soc,2004,(2):1048-1051.
[26] Peters RD,Hinks RS,Henkelman RM.Ex vivo tissuetype independence in protonresonance frequency shift MR thermometry[J].Magn Reson Med,1998,40(3):454-459.
[27] Sapareto SA,Dewey WC.Thermal dose determination in cancer therapy[J].Int J Radiat Oncol Biol Phys,1984,10(6):787-800.
[28] Bachur NR,Moore AL,Bernstein JG,et al.Tissue distribution and disposition of daunomycin (NCS-82151) in mice: fluorometric and isotopic methods[J].Cancer Chemother Rep, 1970,54(2):89-94.
[29] Sprinkhuizen SM,Konings MK,van der Bom MJ,et al.Temperature-induced tissue susceptibility changes lead to significant temperature errors in PRFS-based MR thermometry during thermal interventions[J].Magn Reson Med, 2010, 64(5) : 1360-1372.
[30] Schenck JF.The role of magnetic susceptibility in magnetic resonance imaging:MRI magnetic compatibility of the first and second kinds[J].Med Phys,1996,23(6):815-850.
[31] Duck FA .Physical properties of tissue:a comprehensive reference book[M]. London,England:Academic Press,1990.
[32] Hynynen K,DeYoung D.Temperature elevation at muscle-bone interface during scanned,focused ultrasound hyperthermia[J ].Int J Hyperthermia,1988,4(3):267-279.
[33] Lin WL,Liauh CT,Chen YY,et al.Theoretical study of temperature elevation at muscle/bone interface during ultrasound hyperthermia[J].Med Phys,2000,27(5):1131-1140.
[34] Ahmed M,Brace CL,Lee FT Jr,et al.Principles of and advances in percutaneous ablation[J].Radiology,2011,258(2):351-369.
[35] Kong G,Anyarambhatla G,Petros WP,et al.Efficacy of liposomes and hyperthermia in a human tumor xenograft model:importance of triggered drug release[J].Cancer Res,2000,60(24):6950-6957.
[36] Yarmolenko PS,Zhao Y,Landon C,et al.Comparative effects of thermosensitive doxorubicin-containing liposomes and hyperthermia in human and murine tumours[J].Int J Hyperther mia,2010,26(5):485-498.
[37] Patel PR,Luk A,Durrani A,et al.In vitro and in vivo evaluations of increased effective beam width for heat deposition using a split focus high intensity ultrasound (HIFU) transducer[J].Int J H yperthermia,2008,24(7):537-549.
[38] Ahmed M,Goldberg SN.Combination radiofrequency thermal ablation and adjuvant IV liposomal doxorubicin increases tissue coagulation and intratumoural drug accumulation[J].Int J Hypert hermia,2004,20(7):781-802.
[39] Enholm JK,K-hler MO,Quesson B,et al.Improved volumetric MR-HIFU ablation by robust binary feedback control[J].IEEE Trans Biomed Eng,2010,57(1):103-113.
[40] K-hler MO,Mougenot C,Quesson B,et al.Volumetric HIFU ablation under 3D guidance of rapid MRI thermometry[J].Med Phys,2009,36(8):3521-3535.
[41] Celsion.Phase 3 study of ThermoDox with radiofrequency ablation (RFA) in treatment of hepatocellular carcinoma (HCC).ClinicalTrials.gov[EB/OL].(2010-12-20)[2011-03-19]. http://www.clinicaltrials.gov/ct2/show/NCT00617981.
[42] Celsion.Phase 1/2 study of ThermoDox with approved hyperthermia in treatment of breast cancer recurrence at the chest wall (DIGNITY).ClinicalTrials.gov[EB/OL].(2010-05-24)[2011-03-19].http://www.clinicaltrials.gov/ct2/ show/NCT00826085.
10.3969/j.issn.1674-1633.2012.08.001
1674-1633(2012)08-0001-09
本文英文原版出自Radiology杂志2012年第263卷4月刊第117-127页。翻译及转载均经过北美放射学会许可。北美放射学会对在翻译过程中出现的译文不准确现象概不负责。
2011-06-14
修稿通知发出日期:2011-08-05
修回日期:2011-08-26
通过审核日期:2011-09-29
定稿日期:2011-11-20
本文受加拿大国立癌症研究院以及加拿大安大略政府基金项目支持。
联系人:R.S.(e-mail: staruchr@sri.utoronto.ca).
©RSNA,2012
