嗅觉事件相关电位及磁共振成像对嗅觉功能的评估*
2012-07-21张金玲于焕新
杭 伟 刘 钢 张金玲 于焕新 王 铭
嗅觉是重要的感觉,但相关研究文献较少。目前嗅觉功能主要依靠嗅觉事件相关电位(OERP)和磁共振成像(MRI)进行检查评估,尚无统一的客观标准。本研究应用OERP和MRI检查对嗅觉功能进行客观评估,旨在探讨其临床应用价值。
1 资料与方法
1.1 一般资料 2008年1月—2010年12月于我科就诊的嗅觉障碍患者33例,依病因不同分为3组:慢性鼻窦炎伴息肉患者(NP组)11例,男5例,女6例,平均年龄(45.5±3.5)岁,未见其他原因引起的嗅觉障碍,均无鼻部手术史,测试前未经过任何治疗,病程约3个月~1年;颅脑外伤患者(PT组)11例,男5例,女6例,平均年龄(44.9±3.1)岁,有明确的颅脑外伤史,颅脑外伤后6个月~1年仍有嗅觉障碍,排除其他疾病引起的嗅觉障碍;上呼吸道感染后嗅觉障碍患者(PI组)11例,男6例,女5例,平均年龄(45.1±3.3)岁,有明确急性上呼吸道感染后嗅觉障碍的病史,上呼吸道感染后至少6周,排除其他疾病引起的嗅觉障碍,病程约3个月~1年。同期选取嗅觉正常的受试者11例为对照(NL)组,男6例,女5例,平均年龄(43.8±3.4)岁,无嗅觉障碍及其他与嗅觉障碍相关的疾病,无嗅觉障碍家族史,鼻科常规检查正常。各组性别(χ2=3.34)、年龄(F=1.07)差异无统计学意义(P>0.05)。
1.2 T&T嗅觉计定量检查法 应用T&T嗅觉计(日本第一药品产业株式会社)定量检测各组的嗅觉识别阈,以刚能分辨气味的浓度作为嗅觉识别阈[1],共计算5种嗅素的平均识别阈。在通风良好、无背景气味的环境中进行。
1.3 OERP测试 采用北京协和医院、北京为尔福电子公司联合研制开发的嗅觉诱发电位仪(OEP-98C)来测试。测试在标准的电声屏蔽室进行,环境无异味,室温保持24℃~28℃,受试者保持觉醒、安静、平稳呼吸,双耳戴耳塞,闭目,腹部束呼吸监测带。单纯嗅觉刺激剂为醋酸异戊酯,由于在OERP测试中P1、P3波不常出现,故本文只对N1、P2、N2波的振幅及潜伏期做定量分析。测试采用文献[2]的方法。气味刺激的同时不伴有机械、温度等物理刺激。
1.4 MRI测量嗅球体积 全部受试者采用3.0T Siemens Trio a Tim磁共振扫描仪进行头颅扫描,8通道头颅线圈,扫描序列包括:冠状位快速自旋回波(fast spin echo,FSE)T2加权像,(TR/TE,3 000~4 000/90~100 ms),扫描层厚 2 mm,间隔0 mm,FOV 230 mm×230 mm,扫描从额窦前缘到下丘脑水平。根据三平面定位像及冠状图像,行嗅球矢状位SPGR T1WI扫描(TR/TE,65/18 ms FA 30),扫描层厚1 mm,间隔0 mm,FOV 230 mm×230 mm,扫描方向平行于嗅束,范围包括全脑。通过嗅球的冠状截面,截面面积求和后乘以嗅球长度得到其体积大小[3]。
1.5 统计学分析 采用SPSS 10.0软件进行统计学分析。正态分布的计量数据以均数±标准差(x ±s)表示,多组间均数比较采用单因素方差分析及LSD-t检验。计数资料组间比较用卡方(χ2)检验,以P<0.05为差异有统计学意义。
2 结果
2.1 T&T嗅觉计定量检查法测试结果 NL组与NP、PT、PI组T&T检查分数差异有统计学意义(P<0.001),但NP、PT、PI组间两两比较差异无统计学意义(P>0.05),见表1。
Table 1 Results of T&T olfactory testing表1 T&T嗅觉计定量检查法测试结果(n=11,分,±s)
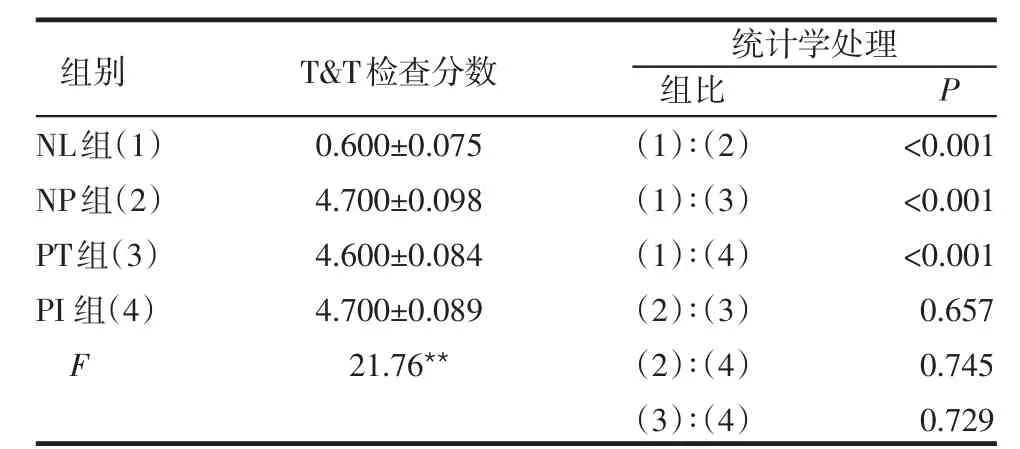
Table 1 Results of T&T olfactory testing表1 T&T嗅觉计定量检查法测试结果(n=11,分,±s)
**P<0.01
NL组(1)NP组(2)PT组(3)PI组(4)F 0.600±0.075 4.700±0.098 4.600±0.084 4.700±0.089 21.76**组比(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)P<0.001<0.001<0.001 0.657 0.745 0.729统计学处理组别 T&T检查分数
2.2 OERP测试结果 NL组11例、NP组3例、PT组3例、PI组4例可以引出N1、P2、N2波。NL组较NP、PT、PI组N1、P2、N2波幅抬高,潜伏期缩短。失嗅者无法测出波形。
2.3 MRI测量嗅球体积双侧平均检测结果 NL组嗅球体积大于其他3组,PT组嗅球体积小于NP、PI组,差异均有统计学意义(P<0.001);NP、PI组差异无统计学意义(P>0.05),见表2。T&T检测嗅觉功能越差,嗅球体积越小,见图1。
Table 2 Results of olfactory bulb volumes by MRI表2 MRI测量嗅球体积结果 (n=11,mm3 ±s)
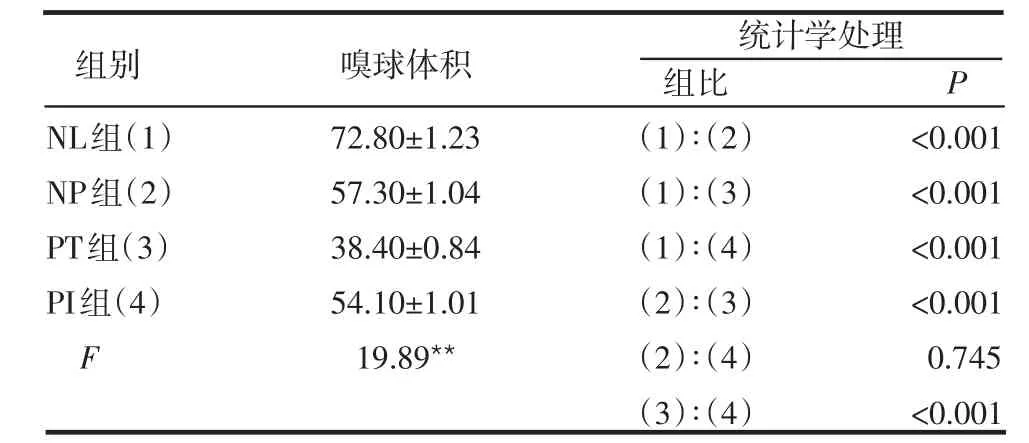
Table 2 Results of olfactory bulb volumes by MRI表2 MRI测量嗅球体积结果 (n=11,mm3 ±s)
**P<0.01
NL组(1)NP组(2)PT组(3)PI组(4)F 72.80±1.23 57.30±1.04 38.40±0.84 54.10±1.01 19.89**组比(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)P<0.001<0.001<0.001<0.001 0.745<0.001统计学处理组别 嗅球体积
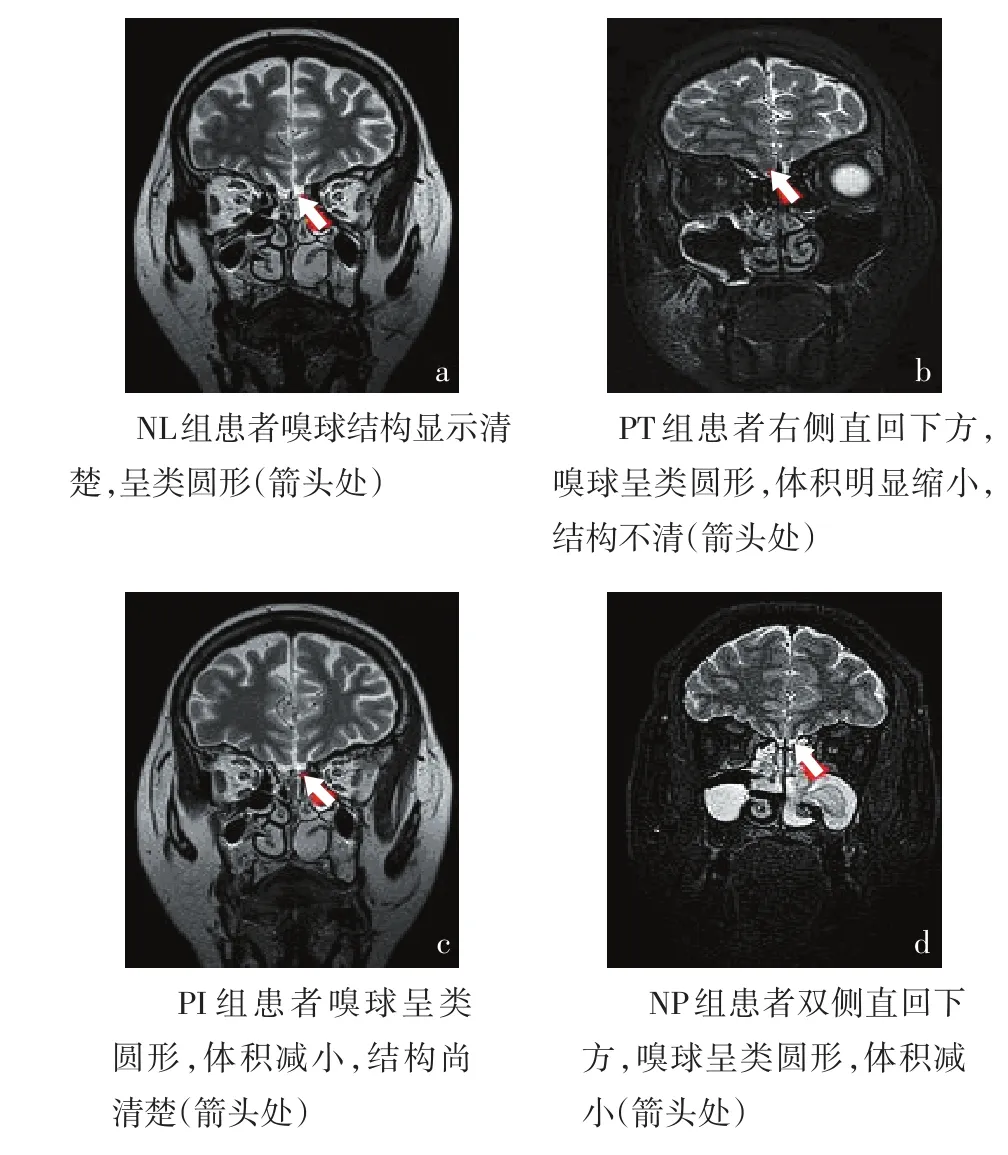
Figure 1 The olfactory bulb coronal location scanning by MRI(T2WI)in four typical example图1 典型4组受试者嗅球MRI冠状位(T2WI)扫描
3 讨论
嗅觉是人体重要的感觉功能之一,嗅觉通路由嗅黏膜、嗅球、嗅束和嗅觉中枢组成。文献报道嗅觉中枢主要位于双侧眶额回、颞中回、额内侧回、扣带回及丘脑等处[4]。正常嗅觉的形成依靠嗅觉传导通路的完整和正常的生理功能,嗅觉通路上任何部位的病变都有可能导致嗅觉障碍。
嗅觉事件相关电位(OERP)是由嗅刺激剂刺激嗅黏膜,应用计算机叠加技术,在头皮特定部位记录到的特异性脑电位,所反映的是嗅觉信号产生、传导及整合的电生理过程[5]。本研究结果显示嗅觉障碍3组较嗅觉正常对照组T&T分数高,OERP各波波幅降低、潜伏期延长。嗅觉减退越严重,T&T分数越高,OERP各波波幅越低、潜伏期越长。嗅觉丧失者无法引出OERP波,呈现杂乱无章的波形。如果嗅觉有一定程度的恢复,OERP各波的波幅、潜伏期也有一定程度的改变,即各波波幅提高,潜伏期缩短。所以有文献认为,OERP可作为嗅觉恢复程度的一个预后指标[6]。但OERP各波的具体来源以及与疾病间的相互关系尚不清楚。
嗅球是一个小的类圆形的灰质块,位于鸡冠两侧、嗅沟前部的嗅窝内,嗅球前缘与筛泡前缘基本在同一水平[7]。MRI可以清楚的显示嗅球及嗅束,冠状面薄扫是显示嗅球、嗅束的最佳扫描方法,冠状位定位线以正中矢状位做参考定位图像,定位线垂直于听眶线,扫描范围从额窦前缘到下丘脑水平,层厚2 mm无间隔扫描[8]。笔者认为,慢性鼻窦炎伴息肉嗅球体积减小的原因可能为息肉、脓性分泌物阻塞嗅区黏膜,造成了传导性嗅功能障碍,还有嗅区黏膜因炎症刺激肿胀、变性引起感觉性嗅功能障碍,两者均可造成嗅素无法到达嗅区、嗅区黏膜也无法感受嗅素,嗅觉细胞减少,嗅觉冲动输入减少,嗅球体积变小。颅脑外伤患者嗅觉传导通路外周段受损,造成嗅觉传输障碍,嗅球接收的神经输入减少,嗅球神经元随之减少,或者嗅球直接受损,最终导致嗅球体积减小。上呼吸道感染后嗅球体积减小,考虑也是由于嗅区黏膜肿胀、细胞变性造成嗅觉传导障碍或感觉障碍,嗅觉神经冲动传入减少,因而嗅球体积变小。本研究结果显示,各病变患者嗅球体积明显小于嗅觉正常的对照组,且T&T分数越高,嗅球体积越小,嗅觉功能越差,故笔者认为,嗅球体积可以反映外周嗅觉损伤的程度。本研究结果还显示,PT组的嗅球体积明显小于NP、PI组,原因可能是颅脑外伤后患者嗅球受到了直接损伤或嗅觉中枢受损,从而导致其嗅上皮神经元的再生能力明显低于其他两组[9]。嗅上皮的神经元可以多次分化,终生具有突触再生的功能,嗅觉可能在一定时期或有效治疗后有所恢复,嗅球体积也有所增大[10]。定期复查头MRI测量嗅球体积的变化,可作为嗅觉恢复程度的客观指标。但MRI对于嗅神经、嗅上皮等是否损伤及严重程度,只能通过嗅球体积间接反映,尚不能直接显示[11]。
综上所述,OERP是一项客观、准确的电生理检查,可对嗅觉进行定性、定量分析。MRI是一种无创安全、客观的检查,可以通过嗅球体积的变化对嗅觉损失进行定量的评估。MRI嗅球体积成像、OERP、T&T等嗅觉检查方法之间结果具有高度的一致性,可以互相补充和印证。联合应用这些检查方法可以辨别伪嗅,并且能对嗅觉功能进行全面、客观的评估。
[1]Rombaux P,Collet S,Martinage S,et al.Olfactory testing in clinical practice[J].B-ENT,2009,5(13):39-51.
[2]Bulsing PJ,Smeets MA,Gemeinhardt C,et al.Irritancy expectancy alters odor perception:evidence from olfactory event-related poten⁃tial research[J].Neurophysiol,2010,104(5):2749-2756.
[3]Nguyen AD,Pelavin PE,Shenton ME,et al.Olfactory sulcal depth and olfactory bulb volume in patients with schizophrenia:an MRI study[J].Brain Imaging Behav,2011,50(8):65-68.
[4]Schecklmann M,Schenk E,Maisch A,et al.Altered frontal and tem⁃poral brain function during olfactory stimulation in adult atten⁃tion-deficit/hyperactivity disorder[J].Neuropsychobiology,2011,63(2):66-76.
[5]Kassab A,Schaub F,Vent J,et al.Effects of short inter-stimulus in⁃tervals olfactory and trigeminal event-related potentials[J].Acta Otolaryngol,2009,129(11):1250-1256.
[6]Rombaux P,Huart C,Collet S,et al.Presence of olfactory event re⁃lated potentials predicts recovery in patients with olfactory loss fol⁃lowing upper respiratory tract infection[J].Laryngoscope,2010,120(10):2115-2118.
[7]Frasnelli J,Lundström JN,Boyle JA,et al.Neuroanatomical corre⁃lates of olfactory performance[J].Exp Brain Res,2010,201(1):1-11.
[8]Veyseller B,Aksoy F,Yildirim YS,et al.Reduced olfactory bulb volume in total laryngectomy patients:a magnetic resonance imag⁃ing study[J].Rhinology,2011,49(1):112-116.
[9]Negoias S,Croy I,Gerber J,et al.Reduced olfactory bulb volume and olfactory sensitivity in patients with acute major depression[J].Neuroscience,2010,169(1):415-421.
[10]Smitka M,Abolmaali N,Witt M,et al.Olfactory bulb ventricles as a frequent finding in magnetic resonance imaging studies of the olfac⁃tory system[J].Neuroscience,2009,162(2):482-485.
[11]Schneider JF,Floemer F.Maturation of the olfactory bulbs:MR im⁃aging findings[J].AJNR Am J Neuroradiol,2009,30(6):1149-1152.
