β-catenin与小鼠毛囊衰老性变化相关
2012-07-18郭海英连小华
邓 芳,郭海英,支 轶,连小华,杨 恬*
(1.第三军医大学细胞生物教研室;2.西南医院全军泌尿外科研究所,重庆 400038)
白发是人和哺乳动物衰老的一个明显体征,了解其形成的原因将对了解衰老的机制提供理论依据。毛发具有周期性生长的特性[1],其毛干结构的更替伴随着周期性的色素形成[2-3]。黑色素谱系细胞周期性的激活、分化、增殖、迁移及合成、呈递黑色素给角质化细胞是毛发周期性色素形成的基础[3-4]。然而,毛囊黑色素谱系细胞的这种周期性功能并不能一直良好地维持下去,随着年龄的增长,会逐渐出现不可逆的毛发变白。
在关于衰老机制的研究中,人们发现许多组织器官如骨、骨骼肌、血管等的衰老性变化都与经典Wnt-β-catenin 信号通路的变化相关[5-7]。前期研究也提示β-catenin能促进毛囊黑素谱系细胞的分化[5-7],其周期性的特征性的表达变化可能是毛发周期性色素生成的重要基础。据此推测在正常老年机体的皮肤组织出现了经典Wnt-β-catenin信号通路的改变,从而影响了毛囊黑素谱系细胞的周期性行为,导致毛发色素形成的障碍。
本研究初步探讨毛囊β-catenin在皮肤毛囊中衰老相关性变化,为进一步探讨经典Wnt-β-catenin信号通路与衰老相关性白发的关系提供依据。
1 材料与方法
1.1 材料
采用SPF级C57雄性小鼠[第三军医大学动物所,合格证号:SYXK(2007-0002)]。取出生后23 d,出生后35 d,出生后34个月C57雄性小鼠各12只,共36只。麻醉后贴皮剪短背毛后脱颈椎法处死,取其背部皮肤。出生后23 d的小鼠背皮均一地处于毛发第一周期静止期,其背皮所取样本在本文中用P23表示,代表年轻小鼠静止期样本。出生后35 d的小鼠背皮均一地处于毛发第2周期生长期,其背皮所取样本在本文中用P35表示,代表年轻小鼠生长期样本。出生后34个月小鼠背部皮肤毛发周期不同步,有区域性差异(图1),皮色为黑色区域为处于生长期的皮肤,所取样本在本研究中用34MA表示,代表老年小鼠生长期样本。皮色为淡粉色区域为处于静止期的皮肤,所取样本在本研究中用34MT表示,代表老年小鼠静止期样本。所取背部皮肤标本分为3个部分:1)4%多聚甲醛4℃固定12 h备用于石蜡包埋切片;2)-80℃保存备用于蛋白提取;3)保存于液氮罐中备用于RNA提取。
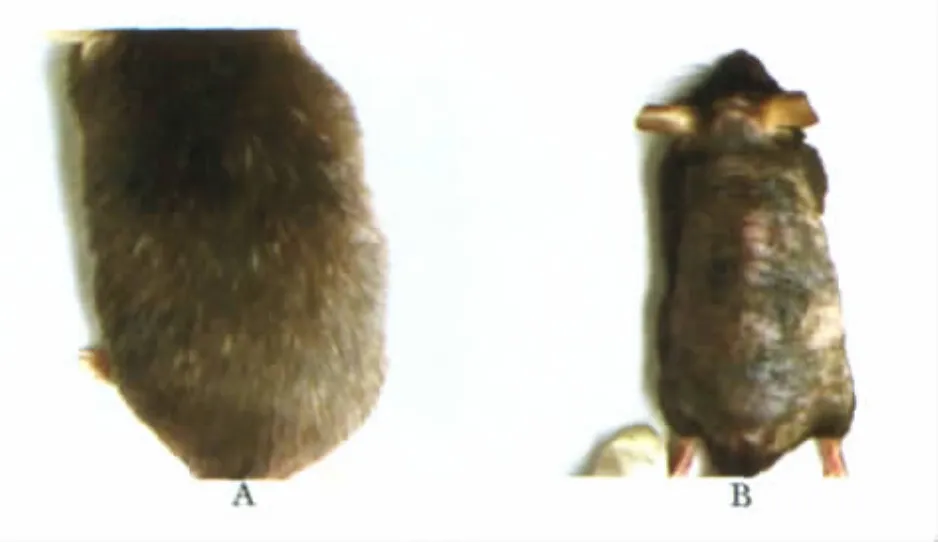
图1 34月龄C57小鼠毛发与皮肤肉眼观察大体情况Fig 1 Hair and skin appearance of 34 months old C57 mouse 3
1.2 方法
1.2.1 RT-PCR方法检测比较老龄鼠、年轻鼠皮肤中β-catenin mRNA在毛囊周期中的表达:取 P23、P35、出生后34个月C57雄性小鼠生长期区域皮肤和静止期区域皮肤组织各100 mg左右,DEPC水清洗组织3遍。采用 Trizol、氯仿/异丙醇法进行总RNA的提取。分光光度仪中检测RNA纯度及浓度。根据Genebank中CD1小鼠β-catenin序列,利用Primer Premier5.0软件设计引物,同时以看家基因GAPDH作为内参,序列如下:β-catenin上游引物为5'-ATCACTGAGCCTGCCATCTG-3',下游引物为5'-GTTGCCACGCCTTCATTCC-3',产物长度为581 bp GAPDH上游引物:5'-ACCACAGTCCATGCCATCAC-3',下游引物:5'-TCCACCACCCTGTTGCTGTA-3',产物长度450 bp。按反转录试剂盒说明进行反转录后PCR。PCR产物点样于1%琼脂糖凝胶中电泳,在凝胶成像系统中检测结果并照相,使用Quantity one软件对图像进行分析计算,测定各条带的吸光度值,以β-catenin条带吸光度值/GAPDH条带吸光度值表示β-catenin mRNA相对表达强度。
1.2.2 Western blot方法检测比较老龄鼠、年轻鼠皮肤中 β-catenin蛋白在毛囊周期中的表达:取P23、P35、出生后34个月C57雄性小鼠生长期区域皮肤和静止期区域皮肤组织各100 mg左右,液氮中研磨提取总蛋白。BCA法测蛋白浓度。常规Western blot操作。一抗:小鼠抗小鼠β-catenin单克隆一抗,空白对照用小鼠抗小鼠GAPDH单克隆一抗。HRP化学发光法显色。获得图像后用Quantity one软件对图像进行分析计算,测定各条带吸光度值,以β-catenin条带吸光度值/GAPDH条带吸光度值表示β-catenin蛋白相对表达强度。
1.2.3 石蜡包埋切片,IF检测比较老龄鼠、年轻鼠皮肤毛囊中β-catenin蛋白在毛囊周期中的表达:取P23、P35、出生后34个月C57雄性小鼠生长期区域皮肤和静止期区域皮肤组织修剪为约8 mm×5 mm长方形皮片,石蜡切片。常规免疫荧光操作。一抗:小鼠抗小鼠β-catenin单克隆一抗,另以PBS代替一抗做空白对照。二抗:Cy3标记山羊抗小鼠IgG抗体。荧光显微镜下观察并照相。
1.3 统计学分析
用Quantity One采集RT-PCR与WB图片条带吸光度,用SPSS10.0对数据作单因素方差分析,最后相对表达量用均数±标准差(±s)表示。
2 结果
2.1 RT-PCR检测皮肤β-catenin mRNA在毛囊周期中的表达
C57小鼠背皮的β-catenin mRNA的表达由强到弱的顺序为 34MA、P35、34MT、P23。可见 β-catenin mRNA在老龄鼠生长期的表达强于在年轻鼠生长期的表达。在老龄鼠静止期的表达也强于在年轻鼠静止期的表达。(P<0.05)(图2,表1)。

图2 β-catenin mRNA在小鼠毛囊周期中的表达Fig 2 β-catenin mRNA expression in hair cycle in mice skin
2.2 Western blot检测皮肤β-catenin蛋白在毛囊周期中的表达
C57小鼠背皮的β-catenin蛋白的表达由强到弱的顺序为 34MA、P35、34MT、P23。可见 β-catenin蛋白在老龄鼠生长期的表达强于在年轻鼠生长期的表达。在老龄鼠静止期的表达也强于在年轻鼠静止期的表达(图3)。上述表达变化的趋势与RT-PCR检测的结果一致的(P<0.05)(表1)。
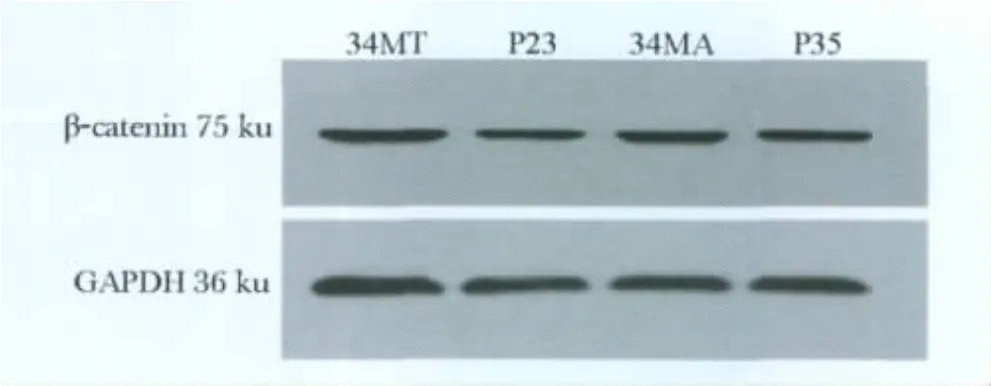
图3 β-catenin蛋白在小鼠毛囊周期中的表达Fig 3 β-catenin protein expression in hair cycle in mice skin
表1 β-catenin mRNA和蛋白在小鼠毛囊周期中表达的相对吸光度值比较Table 1 Relative optical density of β-catanin mRNA and protein expression(±s,n=12)

表1 β-catenin mRNA和蛋白在小鼠毛囊周期中表达的相对吸光度值比较Table 1 Relative optical density of β-catanin mRNA and protein expression(±s,n=12)
*P<0.05 compared with 34MT;#P<0.05 compared with 34MA.
age mRNA expression protein expression 34MT 0.4189±0.0537 0.6348±0.0241 P23 0.1235±0.0326* 0.4243±0.0378*34MA 1.0753±0.0278 0.9024±0.0167 P35 0.9204±0.0219# 0.8012±0.0184#
2.3 IF检测比较β-catenin蛋白在年轻小鼠和老龄小鼠毛囊中的表达
通过IF检测比较β-catenin蛋白(红色荧光)在老龄和年轻小鼠毛囊中的表达情况:在P23和P35的小鼠皮肤,均未见β-catenin蛋白的明显表达;出生后34月龄小鼠的静止期皮肤,β-catenin在毛囊的外根鞘和Bulge都有表达,尤其是在外根鞘上段的细胞表达明显,膜、质、核均有表达,在毛球部未见β-catenin的明显表达。出生后34月龄小鼠的生长期皮肤,β-catenin在毛囊的外根鞘、Bulge表达明显,胞膜、胞质、胞核均有表达,其中外根鞘上段的细胞表达较强,在毛球部未见β-catenin的明显表达(图4)。
3 讨论

图4 IF检测β-catenin蛋白在毛囊周期中的组织学分布Fig 4 β-catenin protein distribution in hair follicles tested by IF(β-catenin red,×100)
白发是人和哺乳动物衰老的一个明显体征,了解其形成的原因将对人们理解衰老的机制,治疗衰老相关性疾病提供一些理论基础。年轻机体正常的毛囊中,黑色素谱系细胞周期性的激活、分化、增殖、迁移、合成及递呈黑色素给角质化细胞是毛发周期性色素形成的基础[8]。随着年龄的增长,这一过程中某些环节的障碍可能是衰老性白发产生的原因。基于已有的有关衰老的研究中,许多证据提示衰老与经典 Wnt-β-catenin 信号通路的变化相关[5,7,9],并且前期研究也指明β-catenin能促进毛囊黑素谱系细胞的分化,其周期性的表达变化可能是毛发周期性色素生成的重要基础[10-11],据此推测在正常老年机体的皮肤组织有经典Wnt-β-catenin信号通路的改变,从而影响了毛囊黑素谱系细胞的周期性行为,导致毛发色素形成的障碍。
研究C57年轻鼠和鼠龄34个月的老年鼠,检测比较了皮肤毛囊的β-catenin mRNA、蛋白质表达水平、蛋白表达在毛囊中的组织学分布3个方面的差异。不论是在mRNA水平,还是在蛋白质水平,相较于处于同一毛囊周期阶段的年轻鼠皮肤,老年鼠背皮的β-catenin表达均有上调。但老年小鼠毛囊β-catenin的表达在静止期和生长期都是增强的,且集中在外根鞘和Bulge细胞,也可以观察到β-catenin的入核现象,此提示在老龄小鼠毛囊中,β-catenin表达的周期性发生改变,使得MSC的周期性激活与静息节律丧失,毛囊黑色素谱系细胞的周期性分化与色素生成不能实现。从表达部位上看,在老龄小鼠的毛囊中,β-catenin的表达不论在静止期或生长期,都集中于外根鞘上段和Bulge,均有入核表现,在外根鞘下段与毛基质未见明显表达,这与年轻小鼠有明显不同[12],提示老龄鼠毛囊中 β-catenin表达时间和部位的变化可能影响黑色素谱系细胞正常的分化及分化过程中的迁移导致毛发周期性色素生成障碍。综上,在老龄小鼠毛囊中,β-catenin表达量上调,周期节律不明显,表达部位有变化可能是衰老相关性白发产生的原因之一。
[1]Alonso L,Fuch E.The hair cycle[J].J Cell Sci,2006,119:391-393.
[2]Stenn KS,Paus R.Controls of hair follicle cycling[J].Physiol Rev,2001,81:449 -494.
[3]Slominski A,Wortsman J,Plonka PM.Hair follicle pigmentation[J].J Invest Dermatol,2005,124:13 -21.
[4]Osawa M,Egawa G,Mak SS.Molecular characterization of melanocyte stem cells in their niche[J].Development,2005,132:5589 -5599.
[5]Brack AS,Conboy MJ,Roy S.Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis[J].Science,2007,317:807 -810.
[6]Nishimura EK,Granter SR,Fisher DE.Mechanisms of hair graying:incomplete melanocyte stem cell maintenance in the niche[J].Science,2005,307:720 -724.
[7]Marchand A,Atassi F,Gaaya A.The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans[J].Aging Cell,2011,10:220 - 232.
[8]Barsh G,Cotsarelis G.How hair gets its pigment[J].Cell,2007,130:779 -781.
[9]Chistiakov DA.How to fight with senescent cells[J].Geriatr Gerontol Int,2011,11:233 -235.
[10]O'Connell MP,Weeraratna AT.Hear the Wnt Ror:how melanoma cells adjust to changes in Wnt[J].Pigment Cell Melanoma Res,2009,22:724 -739.
[11]Khaled M,Levy C,Fisher DE.Control of melanocyte differentiation by a MITF-PDE4D3 homeostatic circuit[J].Genes Dev,2010,24:2276 -2281.
[12]邓芳,郭海英,杨恬,等.毛囊黑素谱系细胞中β-catenin在毛囊周期中的表达[J].第三军医大学学报,2011,33:793-796.
