外源性磷酸肌酸钠对缺血再灌注骨骼肌保护机制的实验研究
2012-07-17李大鹏王昕辉刘明明
丁 明,李大鹏,王昕辉,刘明明
断肢再植、四肢大血管损伤、骨筋膜室综合征、血栓形成及应用止血带时间过长等,均会引起肢体缺血。 缺血-再灌注(ischemia-refusion,I-R)损伤的概念也早已被提出[1]。目前认为缺血再灌注损伤与能量代谢有重要关系[2]。外源性磷酸肌酸钠作为一种外源性的能量合剂,临床上已经用于心脏停搏液中的心肌保护、充血性心衰及未成熟心肌保护等方面[3-5]。但外源性磷酸肌酸钠对骨骼肌缺血再灌注损伤的影响尚未见报道。本实验制备家兔肢体缺血再灌注损伤模型,探讨外源性磷酸肌酸钠对肢体缺血再灌注骨骼肌的作用。
1 材料与方法
1.1 动物分组与模型建立 健康成年家兔40只,体重2.5~3.5 kg,雌雄不限,由中国人民解放军第八十九医院动物中心提供。随机分为对照组、缺血再灌注组(IR)、低浓度磷酸肌酸钠组(LCP)和高浓度磷酸肌酸钠组(HCP),每组10只。
1.2 实验方法 参照Crinnion等方法建立家兔后肢缺血再灌注损伤动物模型[6]。3%戊巴比妥钠(25 mg/kg)耳缘静脉注射麻醉。无菌手术显露左大腿股血管鞘并游离股动静脉,于腹股沟韧带处用微血管夹阻断股动静脉,在阻断处以下用橡皮带弹性环扎以阻断侧支循环。4 h后取下橡皮带及血管夹,恢复肢体血供。①对照组:只解剖出股动静脉,不阻断不环扎;②缺血组:缺血4 h,恢复血流灌注前耳缘静脉给予生理盐水1 ml,恢复血流再灌注4 h;③低浓度组:缺血4 h,恢复血流灌注前耳缘静脉给予外源性磷酸肌酸钠溶液 (北京利祥制药有限公司生产,0.5 mg/ml,生产批号 100602)0.5 g,再灌注 4 h;④高浓度组:缺血4 h,恢复血流灌注前耳缘静脉给予外源性磷酸肌酸钠1 g,再灌注4 h。
1.3 检测项目及方法 四组分别于缺血前、缺血再通后1 h、缺血再通后4 h,3个时相点自右侧颈内静脉采集血样,并取术侧胫前肌组织,行免疫组织化学并制备电镜标本。
1.3.1 生化指标检测 天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)的测定采用罗氏P800全自动生化分析仪。丙二醛(MDA)和超氧化物歧化酶(SOD)测定采用硫代巴比妥钠法和黄嘌呤氧化酶法,试剂盒购自南京建成生物工程研究所,严格按照说明书操作。主要仪器有Spectrumlab 22PC(上海棱光技术有限公司)分光光度计。
1.3.2 Bax、Bcl-2蛋白免疫组化检测和图像分析采用Image-pro Plus6.0图像分析系统软件对胫前肌组织切片进行分析,相同亮度低倍镜(×100)下拍摄图片,每张切片随机选择5个视野,得出统计场积分光密度值(IOD)。
1.3.3 电镜观察 将取得的胫前肌标本切成1 mm×1 mm×1 mm的组织块,经30 g/L戊二醛4℃前固定2 h,再经锇酸后固定,梯度乙醇脱水,环氧树脂包埋,超薄切片,铅铀双重染色,透射电镜观察并摄片。
1.4 统计学处理 所得数据以均数加减标准差(x±s)表示。应用SPSS13.0 for Windows统计软件包进行数据处理,多组样本均数之间比较进行方差齐性检验,组间两两比较进行单因素方差分析,方差齐采用LSD法,不齐则采用Dunnet’s T3法。
2 结 果
2.1 血清学检测结果 缺血组再灌注后1、4 h,IR组较对照组 AST、LDH、MDA 显著升高 (P<0.01),SOD的活力则显著下降(P<0.01);HCP和LCP组较IR 组 AST、LDH、MDA 降低显著 (P<0.05),SOD 的活力则显著升高(P<0.01),且HCP组较LCP组变化明显(P<0.05)。 见表 1。
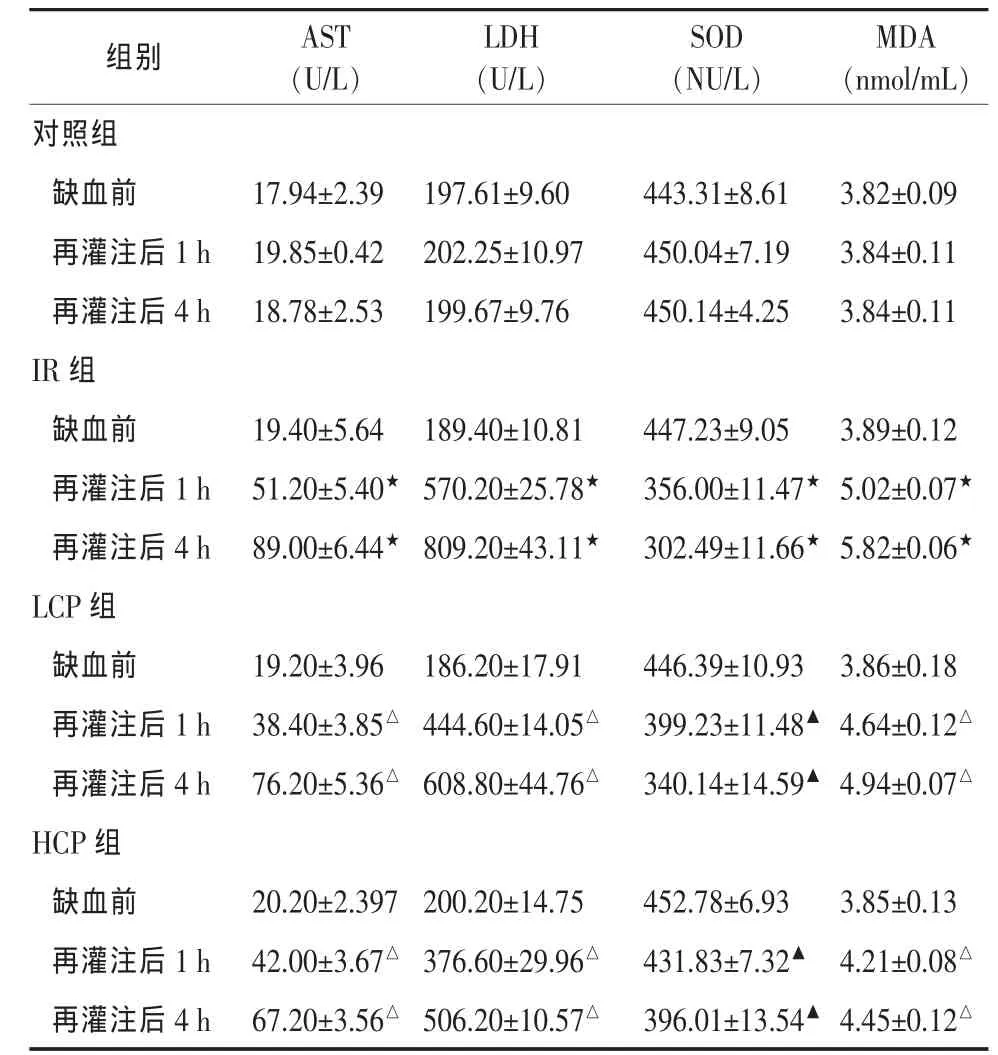
表 1 四组AST、LDH、SOD、MDA变量关系(n=10)
2.2 Bc1-2蛋白、Bax蛋白表达及Bc1-2/Bax比值变化 缺血再灌注1、4 h后,IR组Bcl-2/BAX比值较对照组显著降低(P<0.01)。见表2。

表 2 四组Bcl-2、BAX基因Bcl-2/BAX变量关系(n=10)
2.3 电镜检测结果 三组缺血前均显示正常横纹肌肌组织结构。见图1~3。

图 1 缺血再灌注后4 h IR组电镜图片

图 2 缺血再灌注后4 h LCP组电镜图片

图 3 缺血再灌注后4 h HCP组的电镜图片
3 讨 论
肢体缺血再灌注损伤指肢体缺血达到一定时间,在恢复血供后,反而出现比缺血时更加严重的损伤,表现为组织结构与功能损害的进一步加重。临床常见的缺血再灌注损伤有严重组织水肿、骨筋膜室综合征、肌纤维挛缩,严重者可导致肢体残疾。肢体缺血再灌注损伤的发病机制尚未完全明了,目前观点较多,如氧自由基损伤、钙超载、白细胞浸润和内皮的自稳态失衡等。其中氧自由基在肢体缺血再灌注损伤中的作用得到多数人肯定,是造成缺血再灌注损伤发病的重要环节[7,8]。
正常肌细胞内含丰富的AST、LDH,肌细胞受损后,酶可释放入血。因此,血清中该酶的含量可作为肌细胞损伤的指标,含量高低可反映细胞损伤的程度。测定SOD的活力可反映组织内自由基水平及脂质过氧化的程度[9]。丙二醛(MDA)是脂质过氧化作用的最终产物,它的含量反映了机体脂质过氧化的速度和强度,间接反映体内自由基的水平,其含量可间接反映肢体缺血再灌注损伤的程度。
Bcl-2基因具有促进细胞生存的作用,通过抑制钙离子释放[10]、抑制p53诱导细胞凋亡[11]、抑制自由基生成[12]、稳定线粒体膜[13]发挥作用。Bax基因与Bcl-2作用相反,属于促凋亡基因。最新研究表明,Bax蛋白发挥作用需要通过与Bcl-2蛋白形成二聚体。Bax高表达,形成Bax/Bax同源二聚体促进凋亡;Bcl-2高表达,则形成Bcl-2/Bax异源二聚体抑制凋亡。Bcl-2与Bax的比值是决定细胞凋亡作用强弱的关键[14]。
缺血再灌注损伤与线粒体结构和功能改变有重要关系。线粒体是细胞能量代谢中心,在维持细胞生理功能中发挥重要作用,尤其在缺血再灌注损伤发生及其发展中起中心环节作用[15]。外源性磷酸肌酸钠(CP)能维持线粒体膜结构的完整,使线粒体膜电位维持在较高水平,维持呼吸链正常氧化磷脂化功能,保证ATP的正常生成,维持细胞内高能量水平。CP可以抑制5’-核苷酸酶的活性,使溶血磷脂酸甘油脂浓度下降,稳定磷脂膜。CP维持ATP高水平,使氧自由基生产减少,保护机体免受氧自由基损伤。CP能使细胞较快恢复Ca2+顺利反流入肌浆网,避免细胞内游离钙离子浓度偏高。
本文实验结果显示,缺血再灌注后IR、HCP、LCP各组 AST、LDH、MDA均升高,SOD亦有下降(P<0.05),但 IR 组 AST、LDH、MDA 升高及 SOD 下降均较LCP组显著(P<0.05),较HCP组非常显著(P<0.01)。Bcl-2/BAX比值在HCP与LCP组升高,对细胞凋亡起到一定抑制作用。表明再灌注期间,氧自由基及其引发的脂质过氧化反应造成骨骼肌细胞的损伤,经电镜形态学观察证实在缺血再灌注4 h后细胞损伤明显。应用CP组细胞损伤较缺血组减轻,且高浓度组保护作用更为明显。说明应用外源性磷酸肌酸钠能显著保护缺血再灌注时肌细胞,减轻脂质过氧化反应,减少MDA的生成,维持SOD的活力,保护细胞膜的完整性,抑制AST、LDH的释放,减轻细胞内线粒体的损伤,对肢体缺血再灌注损伤有显著的保护作用。本研究为外源性磷酸肌酸钠在肢体缺血再灌注损伤保护方面,提供了一定的实验参考。
[1]Mccord JM.Oxygen-derived free radicals in past ischemic issue injury[J].N Engl J Med,1985,312(3):159-162.
[2]Illing B,Hom M,Han H,et al.Protective effect of the specific endothelin-1 antagonist BQ610 on mechanical function and energy metabolism during ischemia/reperfusion injury in isolated perfused rat hearts[J].J Cardiovasc Pharmacol,1996,27(4):487.
[3]袁 彪,朱朗标,王冬青,等.外源性磷酸肌酸在心脏直视术中心肌保护效果的观察[J].解放军医学杂志,2000,25(2):112.
[4]吴 蔚,张湘兰,高 宁.磷酸肌酸治疗充血性心力衰竭的临床观察[J].心血管康复医学杂志,2000,9(4):52.
[5]金 峰,李 彤,杨景学,等.外源性磷酸肌酸对未成熟心肌的保护作用[J].第四军医大学学报,2000,21(5):523.
[6]Balestrino M,Lensman M.Role of creatine and phosphocreatine in neuronal protection from anoxic and ischemic damage[J].Amino Acids,2002,23(1-3):221.
[7]王卫国,邓展生,龚家林,等.缺血预处理对肢体缺血再灌注损伤的保护作用[J].湖南医科大学学报,2000,25(4):353.
[8]Maines MD,Panahian N.The heme oxygenase system and celluar defense mechanisms Do H0-1 and H0-2 have different functions[J].Adv Exp Med Biol,2001,502(3):249-272.
[9]Janero DR.Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation tissue injury[J].Free Radic Biol Med,1990,9(6):515-540.
[10]Krajewski S,Tanaka S,Takayama S,et al.Investigation of the subcellular distribution of Bcl-2 oncoprotein[J].Cancer Res,1993,53(19):4701-4714.
[11]Li Y,Chopp M,Zhang ZG,et al.p53-immunoreactive protein and p53 mRNA expression after transient middle cerebral artery occlusion in rats[J].Stroke,1994,25(4):849-855.
[12]Jacobson MD.Reactive oxygen species and programmed cell death[J].Trends Biochem Sci,1996,21(3):83-86.
[13]Yang J,Liu X,Bhalla K,et al.Prevention of apoptosis by Bcl-2 release of cytochrome C from mitochondria block[J].Science,1997,275(5303):1129-1132.
[14]Yang E,Korsmeyer SJ.Molecullar thanatopsis:A discourse on the Bcl-2 family and cell death[J].Blood,1996,88(2):386-401.
[15]Hirata T,Fukuse T,Kawashima M,et al.High energy phosphates,mitochondria and reperfusion injury in isolated rat lungs[J].Transplant Proc,1998,30(7):3377.
