心肺细胞缺氧效应生物信息学分析
2012-07-16肖华军周翠红邓小燕温冬青
毕 得,肖华军,,周翠红,邓小燕,温冬青
1)北京航空航天大学航空科学与工程学院,北京100191;2)北京航空航天大学生物与医学工程学院,教育部生物力学重点实验室,北京100191;3)空军航空医学研究所,北京100142
缺氧使得胰岛素和瘦素表达增加,脂联素和Ghrelin表达下降[1],引起血脑屏障通透性增高,造成血管源性脑水肿加重神经元损伤[2],导致肺血管重构和缺氧性肺动脉高压的形成[3]及心肌损伤[4].缺氧缺血性脑损伤导致新生儿死亡,幸存者智力低下或永久性神经功能损害[5].对从低海拔进入高原的人,高原低氧的环境会诱发大部分人有不同程度的高原病.然而,缺氧预处理对脑、心脏和视网膜等退行性疾病,以及炎症反应有一定的保护作用,如缺氧预处理能保护视网膜的退化[6]、能改善急进高原人群的即时听觉记忆能力和手部运动的速度及准确性,避免部分脑功能的损害[7].缺氧能够引发机体多个器官的应激,但各种组织应对缺氧是否存在共通的应激机制或组织特异性激机制,目前还存在较多未知.
本研究使用BRB-ArrayTools,分析生物芯片基因表达谱,挖掘缺氧下心肌和肺细胞的差异基因表达,对其功能进行分析.采用文本挖掘分析缺氧调控的microRNA(miRNA)相关生物学功能,以期深入认识肺部微血管内皮细胞和心肌微血管内皮细胞应对缺氧的生物大分子机制,及两者缺氧应激分子机制的异同.
1 数据挖掘与分析
1.1 GEO数据库挖掘与芯片数据集获取
从美国国立生物信息中心 (National Center for Biotechnology Information,NCBI)的 GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)进行芯片样本筛选 (登录号GSE11341),芯片为Affymetrix的人类基因组U133A平台,含22 283个基因探针,GSE11341数据集包括肺微血管内皮细胞和心脏微血管内皮细胞在常氧,缺氧3、24和48 h共8组芯片数据,由Costello等[8]提交.将这些芯片原始数据按试验分为常氧组和缺氧组,实验条件常氧组φ(O2)=21%,缺氧组φ(O2)=1%.
1.2 差异表达基因的筛选和样本聚类
将所有的样本芯片数据导入软件BRB-Array Tools 4.1.0[9](http://linus.nci.nih.gov/~ brb/Data-Archive.html)中,分析肺微血管内皮细胞和心脏微血管内皮细胞在常氧,缺氧3、24和48 h处理后基因表达状况.利用Class comparison工具对样本芯片数据进行差异基因表达分析,取P<0.000 1,找到常氧和缺氧状态细胞的差异表达基因.芯片数据分析采用Just-RMA算法,进行基因筛选过滤:①两类样本的基因表达值中至少有20%样本数发生1.5倍的改变;②基因表达数据缺失的样本数不超过50%.探讨肺微血管内皮细胞和心脏微血管内皮细胞在缺氧时间序列的差异表达基因状况.将得到的差异表达基因导入在线分析工具GeneCoDis vision 3.0[10],结合 Gene Ontology(GO)数据库(http://www.Geneontology.org),分析缺氧差异表达基因参与的生物分子功能和生物学过程.
1.3 缺氧调控miRNA的文献挖掘与生物信号通路分析
通过NCBI文献数据库中PubMed(http://www.ncbi.nlm.nih.gov/pubmed)进行文献挖掘,获得缺氧调控的miRNA,利用miTALOS[11]在线分析工具,采用嵌入在 miTALOS中的 TargetScan、TargetSpy、RNA22和PicTar算法,分析预测缺氧调控miRNA在肺和心脏组织中参与的KEGG(kyoto encyclopedia of genes and genomes)[12]生物信号通路.
2 结果与讨论
2.1 缺氧差异表达基因及其生物学功能分析
经严格数据过滤和筛选,GSE11341数据集中满足条件的肺微血管内皮细胞基因有1 572个,差异表达基因为39个,其中上调表达基因31个,下调表达基因8个 (图1).肺微血管内皮细胞的缺氧差异基因表达分析显示,大部分基因在缺氧3 h开始差异表达;在缺氧24 h后显著差异表达;而缺氧48 h与24 h并无显著变化.
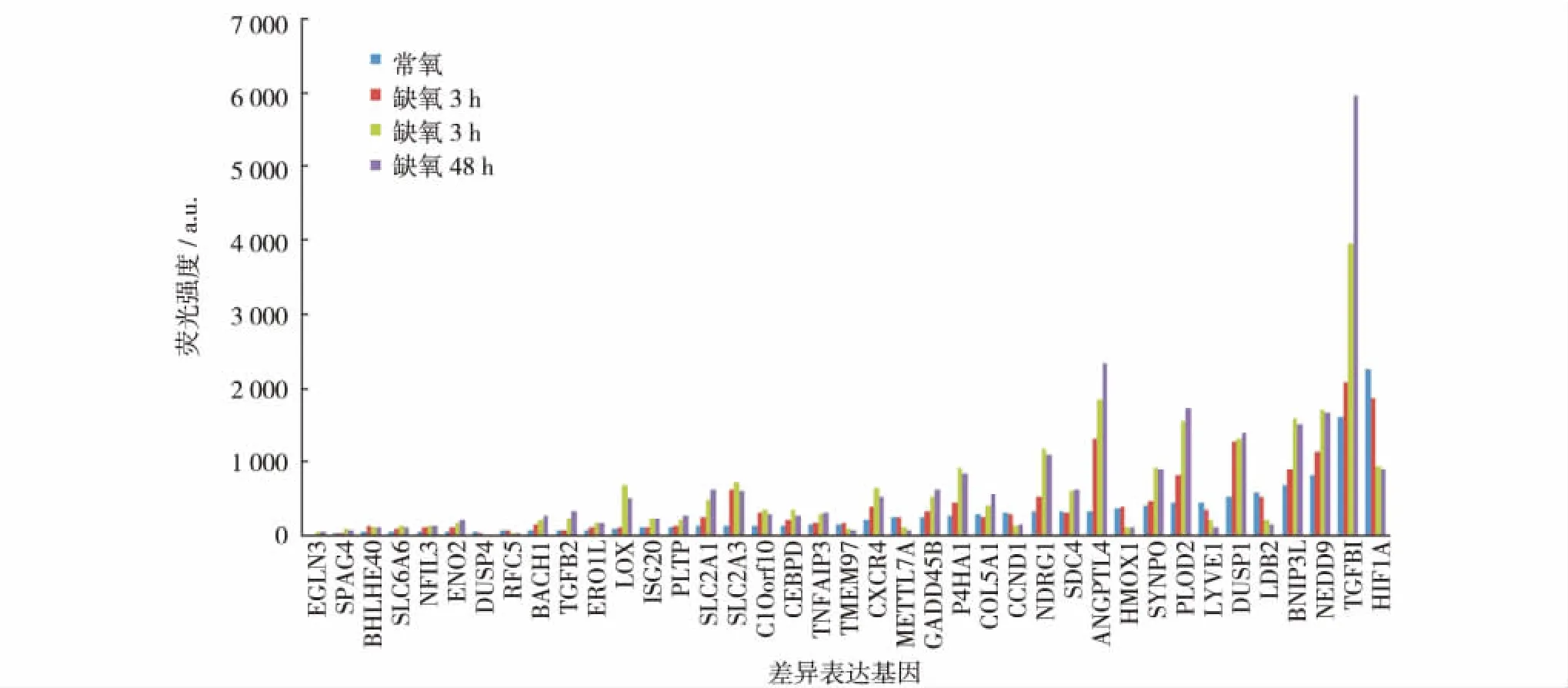
图1 人肺微血管内皮细胞缺氧时间序列的差异表达基因Fig.1 The differential expression genes of pulmonary microvascular endothelial cells in different time
GSE11341数据集中满足条件的心脏微血管内皮细胞基因有450个,差异表达基因66个,其中上调表达基因54个,下调表达基因12个(图2).大部分基因在缺氧3 h开始差异表达;缺氧24 h后显著差异表达;缺氧48 h与24 h无显著变化.部分差异表达基因在缺氧48 h呈现与总体上调或下调变化相反的趋势.虽然心肌微血管内皮细胞和肺微血管内皮细胞在缺氧环境的差异表达基因部分相同,但更多是不同的响应基因,且差异表达基因随缺时间延长达到相对稳定.

图2 人心脏微血管内皮细胞缺氧时间序列的差异表达基因Fig.2 The differential expression genes of cardiac microvascular endothelial cells in different time
表1和表2分别为差异表达基因的生物分子功能和生物学过程功能,其中,Hyp即hypergeometric p value,超几何p值;Hyp'即corrected hypergeometric p value,修正的超几何p值。表1和表2显示,差异表达基因参与的生物学过程在肺和心脏细胞有着较显著区别.在缺氧环境下,心脏需要提供更多的动力驱动血细胞携带更多的O2来满足机体各器官O2的需要,心肌需要表达较多的差异基因参与丰富的生物学过程.这表明不同的组织在缺氧压力下会表达不尽相同的基因来响应,以维持自身组织代谢所需.生物信息学已经成为研究分子相互作用,分子机制的重要研究手段[13-14].在缺氧的肺微血管内皮细胞中,缺氧响应的关键因子、缺氧诱导因子 -1α (hypoxia-inducible factor-1 α,HIF-1α 或HIF1A),随着缺氧时间延长呈下降表达趋势,而心脏微血管内皮细胞则没有显著差异变化.HIF-1α在缺氧预处理中通过表达增加来发挥重要作用.缺氧预处理通过抑制HIF-1α活性起到保护作用,或者不依赖HIF-1α途径产生保护作用[15].这表明缺氧引发的生物效应在不同的器官和组织,有着不同的分子体系作用过程和不尽相同的分子相应过程,而不是存在简单的通用性的信号响应.血管内皮生长因子 (vascular endothelial growth-factor,VEGF)能够诱导毛细血管的新生,改变内皮细胞的基因表达特性,引起微血管内皮细胞通透性增高,其受体家族调控心血管系统发育.NADPH氧化酶-4(NOX4)参与内皮细胞内活性氧 (reactive oxygen species,ROS)的生成,是ROS调节血管功能状态的重要信号分子.周建光等[16]发现高压氧下调内皮型一氧化氮合酶 (endothelial nitric oxide synthase,eNOS)的mRNA表达,姜丽华等[17]研究表明缺氧提高小鼠肺血管中NOX4和eNOS的mRNA和蛋白表达,eNOS和NOX4的表达在慢性缺氧条件下呈明显的正相关.本研究显示NOX4显著上调表达,且没有eNOS差异表达,这可能是由于eNOS变化情况没有在设定的统计参数之内.

表1 肺微血管内皮细胞和心脏微血管内皮细胞缺氧差异表达基因分子功能聚类分析Table 1 Molecular function enrichment of differential expression genes in pulmonary microvascular endothelial cells and cardiac microvascular endothelial cells
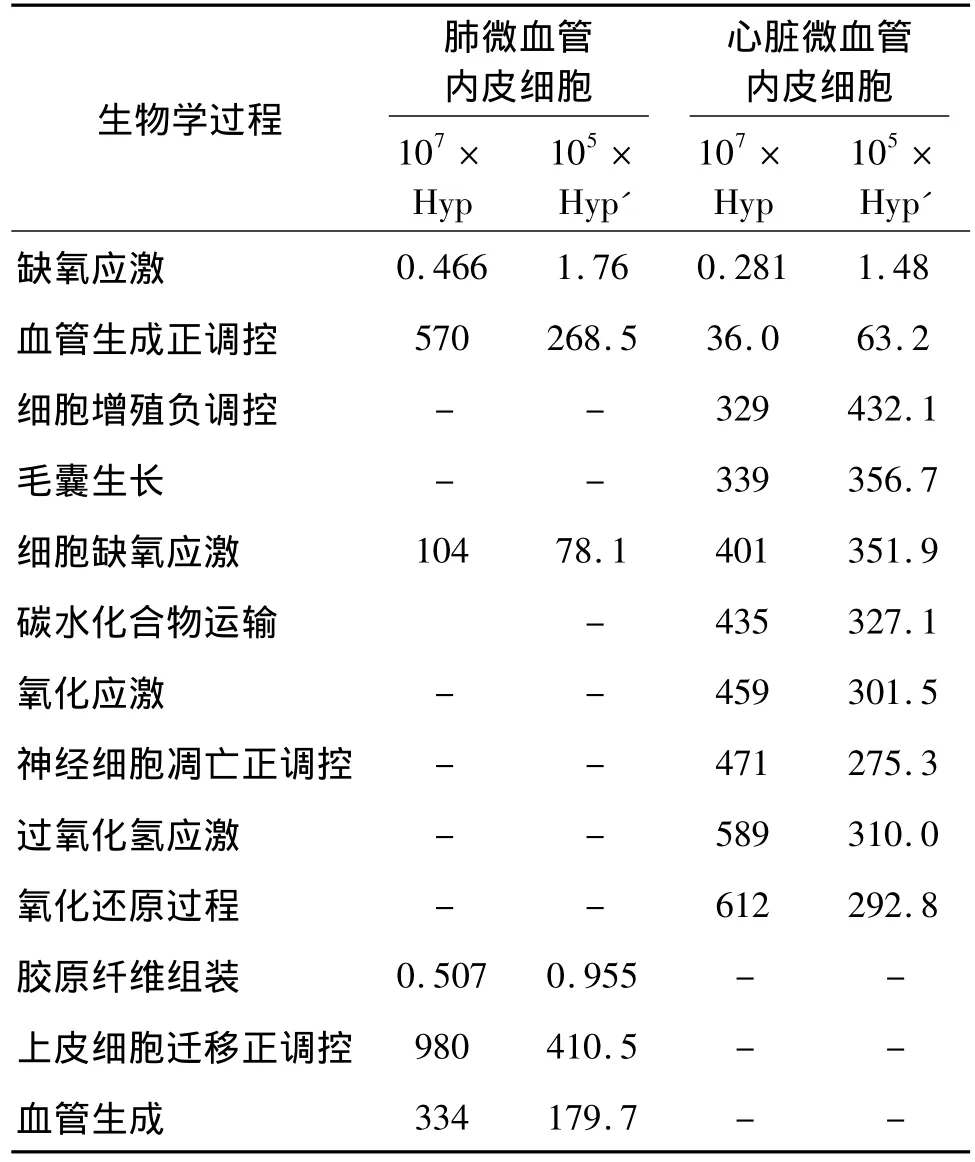
表2 肺微血管内皮细胞缺和心脏微血管内皮细胞缺氧差异表达基因生物学过程聚类分析Table 2 Biological processes enrichment of differential expression genes in pulmonary microvascular endothelial cells and cardiac microvascular endothelial cells
EGLN3(egl nine homolog 3)在肺微血管内皮细胞有显著上调表达,作为EGLN家族的同系物,EGLN家族在氧感受发挥重要作用,EGLN1突变导致真性红细胞增多,高表达的EGLN1与HIF1A成反比.图1显示,缺氧环境下EGLN3上调表达,HIF1A下调.与生活在低海拔地区的人比较,高原地区的人能够适应高原低氧环境,与其体内存在的血红蛋白密不可分,较高的血红蛋白积累能够导致中风,心脏病发作和肺动脉栓塞,而EGLN1在维持高原地区人们的低血红蛋白方面有重要作用[18].EGLN1与高原缺氧适应有关,EGLN1的单核苷酸多态性 (single nucleotide polymorphisms,SNPs)可作为个体缺氧耐受能力的标记物.高原反应的发生存在种群和个体间差异,高原地区的人较低海拔地区的人更易于适应高原低氧环境,其高原反应发生率也明显低于低海拔地区的人,这与基因的单核苷酸多态性有着重要关联.VEGF和诱导型一氧化氮合成酶 (NOS2)等基因已经被证实与高原反应的易感性密切相关.
分子功能聚类 (molecular function,MF)分析显示,缺氧差异表达基因参与MAPK(mitogen-activated protein kinase)活性,MAPK信号通路在细胞的增殖、分化、转化和凋亡中具有至关重要作用。徐菲菲等[19]研究发现缺氧预处理的心肌保护作用与MAPK诱导的 HIF-1磷酸化有关.李玉宇等[20]研究显示缺氧导致迟发性凋亡的神经元缺失,可诱导细胞增殖、神经元分化,触发神经发生,对受损的脑组织进行代偿性修复和神经功能的重建.这可能与过程聚类中缺氧应激、神经细胞凋亡正调控、细胞增殖负调控等生物学过程密切相关.低氧作用对人体产生的有益影响涉及一系列生理生化过程,包括呼吸调控,红细胞生成增多,抗过氧化能力增强,氧自由基代谢获得改善,血液和组织内过氧化物歧化酶的活性增高;细胞膜更趋稳定,Ca2+从细胞质内排出增多,对组织的氧输送改善;线粒体发生变化,包括NAD(辅酶I)依赖性的代谢,ATP合成增多[21].这些研究也侧面印证本研究中的缺氧差异表达基因参与的功能:血管生成,NAD+活性,跨膜转运作用,还原酶作用,氧化还原过程,以及氧化应激等.
2.2 缺氧调控microRNA生物信号通路
miRNA是真核生物中一类长约21~25个核苷酸的小分子非编码RNA,通过与靶基因转录的mRNA结合,调控靶基因表达,是重要的转录后调控因子,在细胞生理活动中,如细胞增殖、分化、发育和凋亡,以及在某些疾病发生和发展中发挥重要作用[22].通过 PubMed挖掘得到的缺氧调控 miRNA.缺氧调控miRNA在肺微血管内皮细胞和心脏微血管内皮细胞中的信号通路有部分相同(表3),但富集程度有所区别.缺氧调控miRNA的信号通路功能分析显示这些信号通路涉及神经因子的调控与细胞凋亡,范有明等[23]发现低压缺氧预处理能够诱导海马神经元产生延迟预适应,增强其抗缺血缺氧能力.miRNA-210可通过VEGF-Notch参与血管新生的调控过程.Wnt信号通路参与调节细胞的分化、增殖和凋亡,参与细胞发育和形态形成、Wnt信号通路在脂肪形成,成骨细胞形成过程发挥重要作用,在一定程度决定肥胖易感性.缺氧调控miRNA参与T细胞和B细胞受体信号通路可能与缺氧预处理提高机体部分功能相关.为得到较为全面的缺氧调控miRNA参与的信号通路,本文综合Target、ScanT-arget、SpyRNA22和 PicTarmiRNA四种靶基因预测算法,关联缺氧调控miRNA调控的信号通路.miRNA能够调控多种靶基因,这些靶基因参与不同的信号通路,其参与的调控网络包括基因调控网络、细胞信号传导网络及代谢网络等,miRNA通过在转录后水平调控这些分子广泛地参与了细胞内各种生物过程.作为真核生物转录后调控的重要方式,全面认识缺氧调控miRNA参与的信号通路,可为机体的缺氧效应提供更丰富的认识.缺氧调控表达基因和 miRNA,通过调控 VEGF、Wnt、Notch和MAPK等信号通路,参与缺氧应激、缺氧预适应或缺氧病变等生理过程.

表3 肺微血管内皮细胞和心脏微血管内皮细胞缺氧调控miRNA KEGG信号通路分析Table 3 Biological pathways enrichment of hypoxiaregulated miRNAs in pulmonary microvascular endothelial cells and cardiac microvascular endothelial cells
随着现代生物技术的高速发展及各种高通量方法的运用,生物数据呈现爆炸式的增长,生物信息的提取与分析显得愈加必要.本研究运用生物信息学数据挖掘的方法,挖掘GEO数据库中潜在的研究对象,结合PubMed强大的知识库,应用在线分析工具,对肺和心脏微血管内皮细胞缺氧效应的分子机制进行分析,结果表明缺氧引发的生物效应在不同的器官和组织,并不存在简单的通用性的信号响应机制,而是有着不尽相同的分子相应过程和分子作用体系.虽然缺氧预处理已较多的应用于机体防护、医疗等方面,但对缺氧预处理的分子机制研究甚少,各种缺氧预处理的防护、治疗效果的分子机理并不很清楚.缺氧对人体的生理和病理方面的多重效应,应该是缺氧调控的生物大分子参与的信号通路之间相互制约与平衡的结果.通过对缺氧分子机制的认识,不但能够加深对缺氧生理效应的理解,更能够提高对缺氧的有害生理效应的预防和控制,趋利避害,积极发挥缺氧对人类工作效率、健康和医疗的有益效应.
结 语
基于生物信息学的肺和心脏微血管内皮细胞的缺氧差异表达基因的分析,以及对缺氧调控miRMA的功能分析,揭示了机体中不同组织应对缺氧存在不尽相同的生物大分子调控机制,这种组织特异的应激机制与缺氧的多重生物效应有着密切关系.随着生物数据的丰富,应用生物信息学数据挖掘,整合更多的有效信息,系统地建立机体各组织对缺氧的响应分子机制,为深入认识缺氧分子机制提供了新思路.
/References:
[1]Chaiban J T,Bitar F F,Azar S T.Effect of chronic hypoxia on leptin,insulin,adiponectin,and ghrelin[J].Metabolism,2008,57(8):1019-1022.
[2]BAO Huan,BAO Shi-yao.Molecular mechanisms of blood-brain barrier tight junction change after hypoxia[J].Cerebrovascular Diseases Foreign Medical Sciences,2005,13(8):604-608.(in Chinese)鲍 欢,包仕尧.缺氧后血脑屏障紧密连接变化的分子机制[J].国外医学脑血管疾病分册,2005,13(8):604-608.
[3]Howell K,Ooi H,Preston R,et al.Structural basis of hypoxic pulmonary hypertension:the modifying effect of chronic hypercapnia[J]. ExperimentalPhysiology,2004,89(1):66-72.
[4]Pierson D J.Pathophysiology and clinical effects of chronic hypoxia[J].Respir Care,2000,45(1):39-53.
[5]Busl K M,Greer D M.Hypoxic-ischemic brain injury:pathophysiology,neuropathology and mechanisms[J].Neuro Rehabilitation,2010,26(1):5-13.
[6]Thiersch M,Raffelsberger W,Frigg R,et al.Analysis of the retinal gene expression profile after hypoxic preconditioning identifies candidate genes for neuroprotection[J].BMC Genomics,2008,9:73.
[7]JIANG Chun-hua,HUANG Qing-yuan,GAO Yu-qi,et al.Hypoxic preconditioning improves the brain function of recruits after ascending to high altitude by air[J].Journal of Preventive Medicine of Chinese People's Liberation Army,2005,23(5):323-326.(in Chinese)蒋春华,黄庆愿,高钰琪,等.预适应锻炼对急进高原新兵脑功能的保护作用[J].解放军预防医学杂志,2005,23(5):323-326.
[8]Costello C M,Howell K,Cahill E,et al.Lung-selectivegene responses to alveolar hypoxia:potential role for the bone morphogenetic antagonist gremlin in pulmonary hypertension[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2008,295(2):L272-284.
[9]Zhao Y,Simon R.BRB-ArrayTools Data Archive for human cancer gene expression:a unique and efficient data sharing resource[J].Cancer Inform,2008,6 9-15.
[10]Nogales-Cadenas R,Carmona-Saez P,Vazquez M,et al.GeneCodis:interpreting gene lists through enrichment analysis and integration of diverse biological information[J].Nucleic Acids Research,2009,37(web server issue):W317-W322.
[11]Kowarsch A,Preusse M,Marr C,et al.miTALOS:analyzing the tissue-specific regulation of signaling pathways by human and mouse microRNAs[J].RNA,2011,17(5):809-819.
[12]Kanehisa M,Goto S,Furumichi M,et al.KEGG for representation and analysis of molecular networks involving diseases and drugs[J].Nucleic Acids Research,2010,38(database issue):D355-D360.
[13]XIA Li-xin,YAN Hao,TANG Mu-jin,et al.Bioinformatics comparison of peanut allergen Ara h2 and Ara h6[J].Journal of Shenzhen University Science and Engineering,2010,27(2):241-246.(in Chinese)夏立新,闰 浩,汤慕瑾,等.花生过敏原Ara h2与Ara h6的生物信息学比较研究[J].深圳大学学报理工版,2010,27(2):241-246.
[14]WANG Xiao-dong,JIANG Yong,CHEN Min-sheng.Proteomics analysis on rats soleus muscle fibers following hindlimb suspension[J].Journal of Shenzhen University Science and Engineering,2010,27(4):502-504.(in Chinese)王晓东,姜 咏,陈民盛.后肢悬吊后大鼠比目鱼肌的蛋白质组学解析[J].深圳大学学报理工版,2010,27(4):502-504.
[15]Taie S,Ono J,Iwanaga Y,et al.Hypoxia-inducible factor-1 alpha has a key role in hypoxic preconditioning[J].Journal of Clinical Neuroscience,2009,16(8):1056-1060.
[16]ZHOU Jian-guang,FANG Yi-qun,LIU Chang-yun,et al.Effect of hyperbaric oxygen on the expression of nitric oxide synthase mRNA in cortex after acute traumatic cerebral injury[J].Chinese Journal of Applied Physiology,2012,28(1):38-41.(in Chinese)周建光,方以群,刘长云,等.高压氧对急性脑创伤后皮层一氧化氮合酶mRNA表达的影响[J].中国应用生理学杂志,2012,28(1):38-41.
[17]JIANG Li-hua,DU Li-zhong.Expressions of NOX4 and eNOS in pulmonary vasculature in mouse model of chronic hypoxia[J].Journal of Clinical Pulmonary Medicine,2011,16(5):679-681.(in Chinese)姜丽华,杜立中.NOX4和eNOS在小鼠慢性缺氧肺血管重塑中的表达及意义[J].临床肺科杂志,2011,16(5):679-681.
[18]Aggarwal S,Negi S,Jha P,et al.EGLN1 involvement in high-altitude adaptation revealed through genetic analysis of extreme constitution types defined in Ayurveda[J].Proceedings of the National Academy of Sciences,2010,107(44):18961-18966.
[19]XU Fei-fei,LIU Xiu-hua,CAI Li-rong.Role of hypoxiainducible factor-1α in the prevention of cardiomyocyte injury induced by hypoxic preconditioning[J].Acta Physiological Sinica,2004,56(5):609-614.(in Chinese)徐菲菲,刘秀华,蔡莉蓉.缺氧诱导因子-1α在缺氧预处理预防心肌细胞损伤中的作用[J].生理学报,2004,56(5):609-614.
[20]LI Yu-yu,XU Jian-wen,GUO Wei,et al.Effects of transient hypoxia on apoptosis and neurogenesis in the newborn rat brain[J].Acta Anatomica Sinica,2011,42(6):741-745.(in Chinese)李玉宇,徐剑文,郭 玮,等.短暂缺氧对新生鼠脑细胞凋亡和神经再生的影响[J].解剖学报,2011,42(6):741-745.
[21]WU Tian-yi.The beneficial effects of plateau environmen on human[J].Journal of Medical Research,2007,36(12):1-3.(in Chinese)吴天一.高原环境对人体有益影响的研究[J].医学研究杂,2007,36(12):1-3.
[22]Bushati N,Cohen S M.microRNA functions[J].Annual Review of Cell Developmental Biology,2007,23 175-205.
[23]FAN You-ming,GAO Yu-qi,LIU Fu-yu,et al.Protective roles of hypobaric hypoxic pretreatment on hippocampus neurons in mice[J].Chinese Journal of Pathophysiology,2006,22(1):93-97.(in Chinese)范有明,高钰琪,刘福玉,等.低压缺氧延迟预适应对小鼠海马神经元的保护作用研究[J].中国病理生理杂志,2006,22(1):93-97.
