慢性饮酒对大鼠肺组织中TIMP-1表达的影响*
2012-07-16于洪志杜钟珍
王 星 吴 琦 于洪志 杜钟珍
自20世纪80年代起我国酒类消费急剧增加,城市居民成人饮酒率达38.8%~59.0%,饮酒相关问题已严重影响我国人民的身心健康,全球近4%的死亡与乙醇有关[1]。有研究表明,乙醇与急性肺损伤、哮喘、慢性阻塞性肺疾病等多种肺病有关[2]。乙醇可以引起肝、肾等脏器纤维化。本研究旨在通过观察慢性摄入乙醇大鼠的肺组织改变,以探讨乙醇和肺纤维化之间的关系。
1 材料与方法
1.1 实验动物 健康雄性清洁级Sprague-Dawley大鼠20只,160~200 g,购自中国协和医科大学放射科研究所,饲养于天津医科大学动物实验中心。
1.2 主要试剂 根据文献[3]方法自行配制Lieber-Decarli乙醇饲料(Lieber-Decarli Rat Ethanol Diet)和 Lieber-Decarli对照饲料,该配方饲料含热量4 185.85 J/mL。其中乙醇饲料热量:35%来自脂肪,11%碳水化合物,18%蛋白,36%乙醇;对照饲料热量:35%来自脂肪,47%碳水化合物,18%蛋白。大鼠基质金属蛋白酶抑制剂(TIMP)-1酶联免疫分析试剂盒购自武汉华美生物工程有限公司。Masson三色染液购自珠海贝索生物技术有限公司。
1.3 动物分组、模型的建立及标本处理 将20只大鼠按体质量编号,采用随机数字表法分成乙醇组和对照组,每组10只。对照组每日给定量Lieber-Decarli对照饲料单笼喂养;乙醇组每日给定量Lieher-Decarli乙醇饲料单笼喂养,不再提供饮水。16周后,将大鼠称质量后经2%水合氯醛(50 mg/kg)腹腔内注射麻醉,采用腹主动脉放血处死动物。沿胸骨中线打开胸腔,完整分离气管和肺组织。取右肺下叶放入10%福尔马林溶液内固定,行HE染色、Masson染色;右肺上叶、中叶先于液氮中保存之后一起转存于-70℃低温冰箱,制作组织匀浆测羟脯氨酸(HYP)、谷胱甘肽(GSH)和TIMP-1含量。
1.4 检测指标及方法
1.4.1 Masson染色评定肺组织纤维化程度 用Olympus BX41光学显微镜,在100倍下随机取10个视野进行观察,按照Szapiel法[4]肺泡炎和肺纤维化的评分标准,计算各视野的分值,取其平均值作为该样本的肺泡炎和肺纤维化评估分级。
1.4.2 GSH、HYP和TIMP-1含量检测 比色法计算大鼠肺组织中GSH和HYP的含量,通过ELISA法检测TIMP-1含量。实验步骤按试剂盒说明书进行。
1.5 统计学方法 采用SPSS 15.0统计软件包。计量资料采用±s表示,2组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 造模前2组大鼠体质量差异无统计学意义(P>0.05),造模结束时,对照组大鼠体质量高于乙醇组(P<0.05),整个造模过程中2组大鼠总进食量(每日进食量×喂养总天数)差异无统计学意义(P<0.05),见表1。整个实验过程中对照组大鼠精神状态好,食欲佳,鼻尖干燥,皮毛有光泽,有溏便。乙醇组大鼠出现精神萎靡,活动减少,反应迟钝,易激惹,鼻尖湿红,毛色灰暗甚至脱落,稀便等表现。
Table 1 Changes of total food intake and body weight in two groups表1 2组大鼠总进食量和体质量变化±s)

Table 1 Changes of total food intake and body weight in two groups表1 2组大鼠总进食量和体质量变化±s)
**P<0.01
对照组乙醇组t 10 10造模前体质量(g)179.1±10.3 175.3±7.5 0.813造模结束时体质量(g)260.2±4.5 180.7±6.9 7.087**总进食量(mL)2 870±113 2 749±64 1.753组别 n
2.2 肺组织病理学改变
2.2.1 HE染色镜下观察 乙醇组标本显示部分肺组织结构破坏、肺泡腔萎陷,肺泡间隔增宽,伴少量淋巴细胞浸润及肺泡Ⅱ型上皮细胞增生,终末细支气管周围已可见少量淋巴细胞浸润,对照组显示肺泡结构清晰,肺泡壁薄,肺泡腔及间质内未见炎性细胞浸润,见图 1、2。
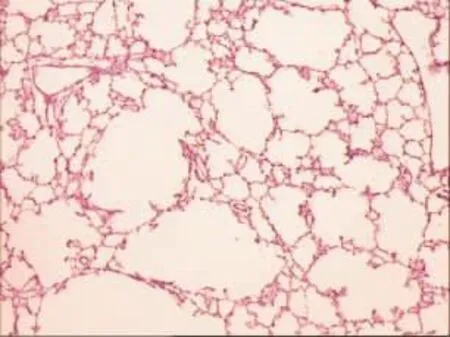
Figure 1 The lung tissues of control group图1 对照组肺组织(HE×100)
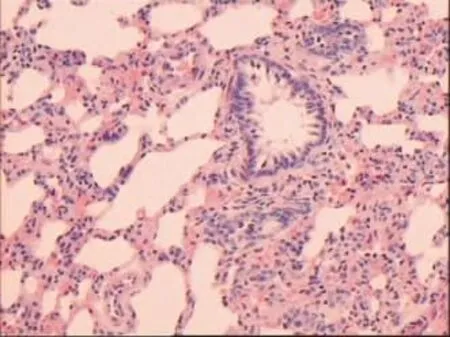
Figure 2 The lung tissues of alcohol group图2 乙醇组肺组织(HE×100)
2.2.2 2组大鼠的肺泡炎和肺纤维化评分的结果 Masson染色观察显示乙醇组肺泡间隔中胶原纤维中度增多,融合成细带状;而对照组肺泡间隔偶有细丝状胶原纤维,见图3、4。 对照组与乙醇组肺泡炎评分及纤维化的比较,差异均有统计学意义(P<0.01),见表 2。
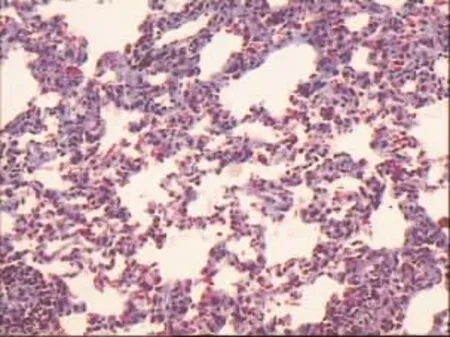
Figure 3 The lung tissues of control group图3 对照组肺组织(Masson染色×400)
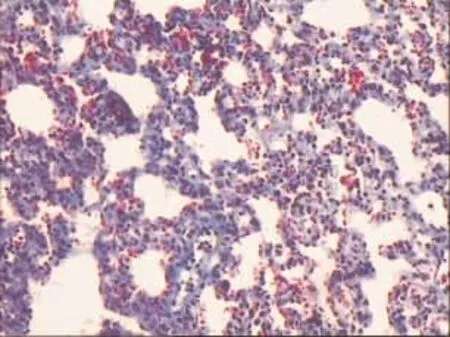
Figure 4 The lung tissues of alcohol group图4 乙醇组肺组织(Masson染色×400)
2.3 2组肺组织匀浆中HYP、GSH和TIMP-1含量的比较 乙醇组肺组织匀浆HYP和TIMP-1含量高于对照组,GSH含量低于对照组,差异有统计学意义(P<0.05 或 P<0.01),见表 2。
Table 2 Comparison of indexes between two groups表2 2组各检测指标比较±s)

Table 2 Comparison of indexes between two groups表2 2组各检测指标比较±s)
*P<0.05,**P<0.01
组别对照组乙醇组t n 10 10肺泡炎(分)1.23±0.11 2.47±0.19 12.691**肺纤维化(分)1.29±0.16 2.39±0.22 10.869**HYP(mg/g)0.343±0.073 0.579±0.134 3.128*GSH(mg/g)0.301±0.076 0.067±0.037 2.742*TIMP-1(μg/L)1 107.04±236.73 1 921.42±331.82 4.29**
3 讨论
肺纤维化是由于过多的成纤维细胞聚集和细胞外的基质成分如胶原蛋白沉积而导致正常的肺组织结构改变和功能丧失的一类疾病。虽然起因不同,但纤维化的发展与结局基本相似。研究表明,氧化应激在弥漫性肺疾病(尤其是肺纤维化)的发病中具有重要的作用,增加氧化剂的水平或者降低抗氧化能力能促进肺纤维化的进展,不同类型的氧化应激可能引起不同特征的弥漫性肺疾病[5]。肺泡上皮细胞衬液和Ⅱ型肺泡上皮细胞内的GSH是肺部主要的抗氧化物质。本研究发现,乙醇组肺组织内GSH含量要明显低于对照组,表明慢性乙醇可以使肺内GSH产生减少,进而可能引起氧化/抗氧化失衡,造成肺损伤。同时病理结果显示乙醇组大鼠肺组织结构破坏,肺泡间隔炎性细胞浸润,肺泡壁增厚,肺泡间隔内胶原纤维沉积明显增多,提示饮酒可以对大鼠肺组织造成损伤并引起肺间质改变和纤维化。
肺纤维化发病机制的共同特征可能是体内胶原代谢的失衡,即胶原合成超过破坏,或胶原合成增加或(和)胶原破坏减少而导致胶原过多地沉积在肺实质内。由于HYP为胶原纤维所特有,故可作为评价肺纤维化的指标。细胞外基质(extracellular matrix,ECM)的沉积是肺纤维化的主要特征,许多酶可以降解ECM成分中大分子蛋白质,其中基质金属蛋白酶(MMPs)被认为是最重要的一类。ECM与MMPs之间的失衡或MMPs与TIMPs之间的失衡均可导致ECM的代谢失衡。因此,MMPs/TIMPs在肺损伤及肺纤维化过程中可能发挥了重要的作用[6]。TIMP-1几乎能够抑制所有已知MMPs的活性,从而在维持生理状态下ECM的沉积、降解平衡中起关键作用。本实验发现慢性饮酒大鼠的肺组织匀浆HYP和TIMP-1含量明显高于对照组,提示高水平表达的TIMP-1可能抑制了MMPs的活性,使Ecm在肺损伤修复过程中合成增加,降解减少,胶原代谢紊乱,导致肺组织HYP含量增加,从而发生了纤维化改变。这也提示TIMP-1的增高可能是慢性饮酒大鼠肺间质胶原沉积的主要原因。
转化生长因子(TGF)-β是肺、肾、肝及皮肤病理性纤维化增生中的关键因子,TGF-β1在肺成纤维细胞中诱导TIMP-1,引起不可逆的肺纤维化,常被称为“纤维化损伤性修复”[7]。已有研究显示,慢性饮酒大鼠肺组织中TGF-β1表达升高[8]。本研究显示慢性饮酒大鼠肺组织中TIMP-1表达升高,提示二者在慢性饮酒导致肺间质改变中发挥重要作用,但二者之间的相互联系以及更多的细胞因子在肺纤维化中的作用有待进一步研究。
[1]Rehm J,Mathers C,Popova S,et al.Global burden of disease and injury and economic cost attributable to alcohol use and alcoholuse disorders[J].Lancet,2009,373(9682):2223-2233.
[2]Sisson JH.Alcohol and airways function in health and disease[J].Alcohol,2007,41(5):293-307.
[3]Lieber CS,DeCarli LM.The feeding of alcohol in liquid diets:two decades of applications and 1982 update[J].Alcohol Clin Exp Res,1982,6(4):523-531.
[4]Szapiel SV,Elson NS,Fulmer JD.Bleomycin-induced interstitial pulmonary disease in nude,athymic mouse[J].AM Rev Respir Dis,1979,120(4):893.
[5]Bargagli E,Olivieri C,Bennett D,et al.Oxidative stress in the pathogenesis of diffuse lung diseases A review [J].Respiratory Medicine,2009,103(9):1245-1256.
[6]Sissie W,Belvisi MG,Birrell MA.MMP/TIMP expression profiles in distinct lung disease models:implications for possible future therapies[J].Respiratory Research,2009,10(1):72.
[7]Ask K,Bonniaud P,Maass K,et al.Progressive pulmonary fibrosis is mediated by TGF-beta isoform 1 but not TGF-beta3[J].Int J Biochem Cell Biol,2008,40(3):484-495.
[8]华静娜,吴琦,武俊平,等.不同浓度乙醇对大鼠肺组织TGFβ-1和bFGF表达的影响[J].天津医药,2010,38(12):1090-1092.
