儿童肥胖非酒精性脂肪肝胰岛β细胞功能的研究
2012-07-16于阿莉刘戈力杨菁岩郑荣秀鲍鹏丽高芳芳
于阿莉 刘戈力 杨菁岩 郑荣秀 鲍鹏丽 高芳芳
随着人们生活方式的改变和饮食结构的调整,儿童和青少年肥胖的发病率逐年上升,肥胖已成为令世界瞩目的公共卫生问题。非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是常见的肥胖并发症,在欧美国家,NAFLD占慢性肝病的比例已大于30%[1],且其发病率呈明显的上升趋势。近年来的研究表明胰岛素抵抗和全身能量代谢的失衡是NAFLD的发病机制之一,而胰岛素抵抗和β细胞功能衰竭是2型糖尿病的发病基础。本研究通过对肥胖并伴NAFLD儿童胰岛β细胞功能进行研究,探讨肥胖儿童NAFLD的发病机制,为早期发现肥胖儿童糖脂代谢异常并实施干预提供依据。
1 对象与方法
1.1 研究对象 选取2007年6月—2011年4月就诊于我科内分泌门诊的肥胖儿童362例。肥胖的诊断按照2004年中国肥胖问题工作组(WGOC)推荐的中国儿童青少年肥胖筛查体质量指数(BMI)分类标准[2]。同时根据中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的NAFLD病诊疗指南(2010年修订版)[3],将本组分为肥胖并伴有NAFLD的儿童170 例(NAFLD 组),男 111 例,女 59例,平均年龄(11.5±2.1)岁;不伴NAFLD且肝功能正常的单纯肥胖儿童192例(单纯肥胖组),男 131 例,女 61 例,平均年龄(11.8±2.0)岁;此外,选取同时期在我院正常查体且BMI正常的儿童164例作为正常对照组,男92例,女72例,平均年龄(10.6±2.5)岁。各组性别 (χ2=5.79)、 年龄 (F=1.76) 差异均无统计学意义 (P>0.05)。
1.2 方法
1.2.1 一般指标测定 空腹10 h后晨起抽取肘正中静脉血3 mL,采用葡萄糖氧化酶法测空腹血糖(FPG),采用放射免疫法测定空腹胰岛素(FINS),采用高压液相离子交换层析法测定糖化血红蛋白(HbA1c)水平。测量3组儿童的身高和体质量,计算体质量指数(BMI)。采用稳态模型计算胰岛素抵抗指 数 (HOMA-IR) =FPG×FINS/22.5, 胰 岛 素 敏 感 指 数(QUICKI)=1/(lgFPG+lgFINS),胰岛 β 细胞功能指数(HOMA-β)=FINS×20/(FPG-3.5)。
1.2.2 口服葡萄糖耐量和胰岛素释放试验 所有肥胖儿童均口服葡萄糖1.75 g/kg(最大限量 75 g),分别在服糖后30、60、120和180 min测定血糖和胰岛素水平。依据美国ADA2010年的诊断标准,符合下列任意1项者诊断为糖尿病(DM):(1)HbA1c≥6.5%。(2)FPG≥7.0 mmol/L。(3)口服葡萄糖耐量试验 (OGTT)2 h后血糖≥11.1 mmol/L。FPG 5.6~6.9 mmol/L诊断为空腹血糖受损(impaired fasting glucose,IFG)。OGTT 2 h后血糖 7.8~11.0 mmol/L诊断为糖耐量受损(impaired glucose tolerance,IGT)。
1.3 统计学方法 采用SPSS 13.0软件进行统计学分析,计量资料用±s表示,2组间均数比较采用t检验;3组间正态分布变量(FPG和HbA1c)均数比较采用方差分析,偏态分布变量(FINS、HOMA-IR、HOMA-β、QUICKI)取自然对数值转为正态分布后进行方差分析,两两比较采用LSD-t检验。计数资料采用例(%)表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组观察指标比较 3组间 FPG、FINS、HbA1c、HOMA-IR、HOMA-β和QUICKI差异均具有统计学意义(P < 0.01)。 NAFLD 组 FPG、FINS、HbA1c、HOMA-IR和HOMA-β高于单纯肥胖组和对照组,单纯肥胖组高于对照组。NAFLD组QUICKI明显低于单纯肥胖组和对照组,单纯肥胖组低于对照组,差异均有统计学意义(P<0.05或P<0.01),见表1。
Table 1 Comparison of islet β-cell function betweenthree groups表1 3组胰岛β细胞功能指标比较±s)
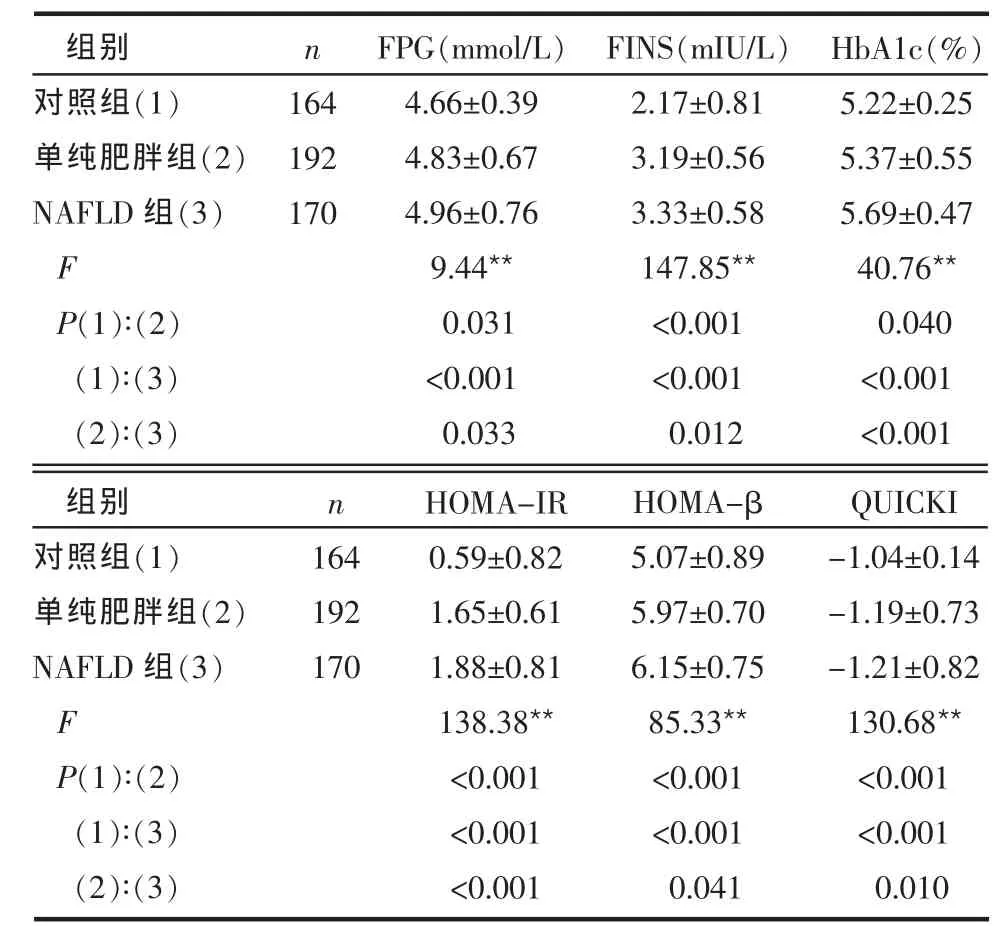
Table 1 Comparison of islet β-cell function betweenthree groups表1 3组胰岛β细胞功能指标比较±s)
**P<0.01
组别对照组(1)单纯肥胖组(2)NAFLD 组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)n 164 192 170 FPG(mmol/L)4.66±0.39 4.83±0.67 4.96±0.76 9.44**0.031<0.001 0.033 FINS(mIU/L)2.17±0.81 3.19±0.56 3.33±0.58 147.85**<0.001<0.001 0.012 HbA1c(%)5.22±0.25 5.37±0.55 5.69±0.47 40.76**0.040<0.001<0.001 HOMA-IR 0.59±0.82 1.65±0.61 1.88±0.81 138.38**<0.001<0.001<0.001 HOMA-β 5.07±0.89 5.97±0.70 6.15±0.75 85.33**<0.001<0.001 0.041 QUICKI-1.04±0.14-1.19±0.73-1.21±0.82 130.68**<0.001<0.001 0.010组别对照组(1)单纯肥胖组(2)NAFLD 组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)n 164 192 170
2.2 2组肥胖儿童糖代谢异常情况比较 NAFLD组的糖代谢异常总检出率高于单纯肥胖组,NAFLD组IGT检出率高于单纯肥胖组,差异有统计学意义(P<0.05);2组IFG和DM检出率差异无统计学意义(P > 0.05),见表 2。
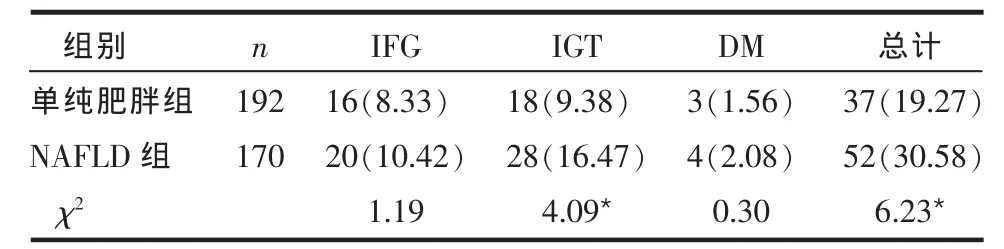
Table 2 Comparison of the relevance ratio of abnormal glucose metabolism between two groups表2 2组糖代谢异常检出率比较 例(%)
2.3 2组胰岛素释放试验结果比较 空腹及口服葡萄糖后不同时间的胰岛素水平,均是NAFLD组高于单纯肥胖组,差异有统计学意义(P<0.05或P < 0.01),见表 3。
Table 3 Comparison of INS levels in different time periods between two groups表3 2组不同时间胰岛素水平比较 (mIU/L±s)

Table 3 Comparison of INS levels in different time periods between two groups表3 2组不同时间胰岛素水平比较 (mIU/L±s)
*P<0.05,**P<0.01
组别单纯肥胖组NAFLD组t n 192 170空腹3.19±0.56 3.35±0.56 2.64**30 min 5.00±0.60 5.19±0.54 2.08*60 min 4.85±0.71 5.11±0.63 3.46**120 min 4.78±0.70 4.98±0.89 2.28*180 min 4.04±0.94 4.30±0.80 2.41*
3 讨论
随着儿童肥胖在全球范围的流行,NAFLD成为儿童肝脏疾病最主要的原因。儿童肥胖伴NAFLD可能是代谢异常向2型糖尿病、高血压及心血管疾病发展的肝脏表现[4]。目前国内关于儿童肥胖伴NAFLD胰岛β细胞功能的研究报道较少。机体正常葡萄糖代谢的维持有赖于胰岛β细胞分泌胰岛素的功能和胰岛素在周围组织敏感性之间的平衡。从糖耐量正常到空腹葡萄糖受损、糖耐量受损、2型糖尿病的过程,也可以看成是胰岛β细胞功能从正常到代偿、失代偿、衰竭的过程。Weir等[5]将该过程分为4个时期:(1)胰岛β细胞功能代偿期。(2)胰岛β细胞功能轻度失代偿期。(3)胰岛β细胞功能重度失代偿期,即糖尿病期。(4)胰岛β细胞功能完全失代偿期,此期处于不可逆状态,功能完全衰竭。前3个时期胰岛β细胞功能的损伤是可逆的。因此,研究肥胖儿童胰岛β细胞的分泌功能对该类人群向2型糖尿病的发生、发展及制定适当的治疗方案是非常必要的。
本研究显示 NAFLD 组的 FPG、FINS、HOMAIR及HOMA-β均显著高于单纯肥胖组和对照组。NAFLD组的总体糖代谢异常检出率高于单纯肥胖组,NAFLD组IGT检出率高于单纯肥胖组,2组IFG和DM检出率差异无统计学意义,可能与例数少有关,尚需更大样本的研究。
HbA1c是血中葡萄糖与红细胞内血红蛋白经过非酶缩合而形成的产物,无须胰岛素参与。HbA1c聚集在红细胞内,含量越高表示血糖与血红蛋白的结合越多,而且以这种形式存在于红细胞的整个生存周期。红细胞的寿命为120 d,半衰期为60 d,所以测定HbA1c含量能反映测定前机体1~2个月的平均血糖水平。本研究显示NAFLD组的HbA1c水平高于单纯肥胖组和正常对照组,提示NAFLD组儿童近1~2个月的平均血糖水平显著高于单纯肥胖组和对照组。
胰岛素β细胞分泌胰岛素,而胰岛素分泌受血糖水平的调节。血糖升高可刺激胰岛分泌胰岛素,在行OGTT时同时测定血胰岛素水平可更准确地反映胰岛β细胞的储备能力。本研究结果显示NAFLD组胰岛素水平在空腹及服糖后30~180 min均显著高于单纯肥胖组,提示儿童NAFLD的发生与胰岛素抵抗及胰岛β细胞功能受损密切相关。
[1]Feldstein AE.Novel insights into the pathophysiology of nonalcoholic fatty liver disease[J].Semin Liver Disease,2010,30(4):391-401.
[2]中国肥胖问题工作组.中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J].中华流行病学杂志,2004,25(2):97-102.
[3]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南 (2010年修订版).胃肠病学和肝病学杂志,2011,19(6):483-487.
[4]Mager D,Roberts E.Nonalcoholic fatty liver disease[J].CMAJ,2005,173(7):735.
[5]Weir GC,Laybult DR,Kaneto H,et al.B-cell adaptation and decompensation during the progress ion of diabetes[J].Diabetes,2001,50(1):154-159.
