雄激素对前列腺癌细胞系泌乳素相关蛋白表达的影响*
2012-07-16崔书霞郝志梅郭志义郝小惠王素云
崔书霞 郝志梅 郭志义 郝小惠 王素云 田 炜
前列腺癌(prostate cancer,PCa)是男性生殖系统常见的恶性肿瘤,近年来随着社会的老龄化和饮食习惯的西方化,PCa的发病率显著增高[1]。目前普遍认为PCa为雄激素依赖性肿瘤,其发生与雄激素的刺激有关,雄激素受体(adrogen receptor,AR)在介导雄激素生物学效应上发挥着重要作用[2]。泌乳素相关蛋白(prolactin inducible protein,PIP)是一种15~17 ku的糖蛋白[3],广泛存在于精液、唾液、乳汁等体液中,并发挥着多种生物学作用[4]。PIP可作为一种肿瘤标志物被用来诊断乳腺来源的转移癌[5]。最近研究发现,前列腺上皮细胞也能产生PIP,在前列腺癌中PIP有过度表达,并与前列腺特异抗原(PSA)存在共表达[6-7]。本研究探讨PIP在前列腺癌细胞系中的表达情况,以及雄激素对其表达的影响,为进一步探讨前列腺癌的发病机制提供理论基础。
1 材料与方法
1.1 材料 人前列腺癌细胞系LNCaP、PC-3、DU145及人乳腺癌细胞系T47D均购自中国科学院细胞库。兔抗人GCDFP-15(PIP)多克隆抗体购自美国Santa Cruz公司,鼠源GAPDH多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG及辣根过氧化物酶标记山羊抗小鼠IgG购自中杉金桥生物有限公司。
1.2 方法
1.2.1 细胞培养 于含10%胎牛血清(FBS)、双抗(青霉素100 U/mL, 链霉素 100 mg/L) 的 RPMI1640 (LNCaP、PC-3、DU145)或 DMEM(T47D)培养基中,置于 37 ℃、5%CO2、饱和湿度的孵箱中培养。细胞生长状态良好,达到对数生长期时,将细胞按1×104/mL接种于培养瓶或6孔板内,孵箱孵育24 h后待用。
1.2.2 处理及分组 各培养细胞系分为空白对照组、不同浓度及不同时间处理组,不同浓度处理组应用(0.1、1、10、100 nmol/L) 双 氢 睾 酮 (Dihydrotestosterone,DHT) 或 睾 酮(Testosterone,T)分别对各细胞系进行处理,不同时间处理组为应用10 nmol/L DHT或T处理6、24和48 h。
1.2.3 引物设计 通过NCBI基因库获得各目标基因序列,使用Primer Premier 5.0引物设计软件 (Premier公司,加拿大)设计引物,由Invitrogen公司合成,设 glyceraldehyde-3-phosphate dehydrogenase(GAPDH)为内参,各引物序列见表1。

Table 1 Primer sequences of PIP,AR and GAPDH genes表 1 PIP、AR和GAPDH基因特异性引物序列
1.2.4 逆转录-聚合酶链反应(RT-PCR) 取各组培养细胞,用Trizol抽提法提取总RNA,紫外分光光度计测定RNA纯度,-70℃冻存待用。用Oligo(dT)、随机引物、逆转录酶(Takara)等进行逆转录反应合成cDNA。使用各基因特异性引物,应用RT-PCR二步法试剂盒(Takara公司Ver2.1)进行PCR扩增,扩增产物应用1.5%琼脂糖凝胶在100 V电压下电泳确认。
1.2.5 实时荧光定量PCR 将1.2.4中逆转录反应合成的cDNA用各目标基因的特异性引物,使用Rotor-Gene Multiplex RT-PCR Kit(Qiagen)试剂盒,Rotor-Gene 3000 定量PCR仪(Corbett Robotics公司,澳大利亚)对各基因进行实时荧光定量PCR反应,反应条件为94℃15 s,56℃25 s,72℃20 s,40个循环。所获得的PCR产物应用琼脂糖凝胶电泳技术确认,同时使用各待测基因分别制作标准曲线,对所获得的定量数据应用标准曲线法进行相对定量分析,使用GAPDH作为管家基因,实验至少重复3次。
1.2.6 蛋白提取 将处于对数生长期且状态良好的各组细胞,用 10 g/L的 NP40细胞裂解液(10 g/L NP40,pH 7.4 Tris碱 50 mmol/L,NaCl 150 mmol/L,1 g/L SDS,5 g/L 脱氧 胆酸盐,200 mg/L苯甲基磺酰氟,50 mg/L抑肽酶)裂解细胞,冰上震荡裂解30 min,4℃12 000 r/min离心10 min。将离心后的上清分装至0.5 mL Ep管中,BCA蛋白浓度测定试剂盒 (碧云天生物技术研究所)定量,-80℃保存待用。
1.2.7 Western blot 按照每孔 20 μg蛋白量上样,SDSPAGE 100 V电压电泳,8 mA/cm2电流半干转印2 h将蛋白转至PVDF膜上,5 g/L脱脂奶粉封闭2 h后,加入GCDFP-15(PIP)或GAPDH抗体工作液,4℃孵育过夜,TBST充分洗膜后加入辣根过氧化酶标记二抗室温孵育2 h,BeyoECL Plus(碧云天生物技术研究所)化学发光显色。
1.3 统计学方法 应用SPSS 16.0统计软件进行统计分析,计量数据用均数±标准差±s)表示,组间比较应用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各细胞系PIP的表达 在LNCaP及T47D细胞中有PIP mRNA及PIP蛋白的表达,但LNCaP细胞中的PIP表达量低于T47D细胞;而在PC-3及DU145细胞中无PIP mRNA和PIP蛋白的表达,见图1、2。在LNCaP与T47D中有AR mRNA表达,且表达量相近,而在PC-3与DU145中AR表达较少或无AR表达,见图1。经实时荧光定量PCR确认LNCaP细胞中的PIP表达量约为T47D细胞的1/600。
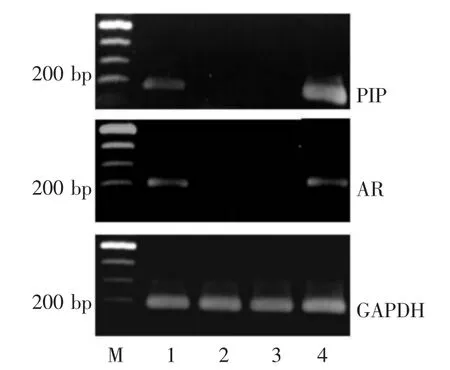
Figure 1 PIP and AR mRNA expressions in four cell lines图1 PIP及AR mRNA在4种细胞系中的表达
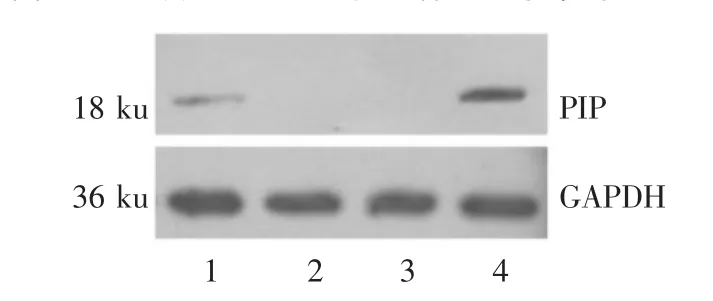
Figure 2 PIP expression in four cell lines by Western blot analysis图2 PIP蛋白在4种细胞系中的表达
2.2 雄激素对LNCaP及T47D中PIP mRNA表达的影响 PIP mRNA的表达随DHT或T浓度增加而增加,且DHT或T浓度达到10 nmol/L时PIP mRNA的表达量最大,与对照组(0 nmol/L)相比差异有统计学意义(P<0.01),见表2。经10 nmol/L DHT或T处理后24 h内LNCaP细胞中PIP mRNA的表达随时间的延长而增加,于24 h时达到最大峰值,与对照组(0 h)相比差异有统计学意义(P<0.05),见表3。
Table 2 PIP mRNA expressions of LNCaP and T47D cell lines stimulated by different concentrations of DHT or T表2 不同浓度DHT或T对LNCaP及T47D细胞系中PIP mRNA表达的影响 (PIP/GAPDH±s)
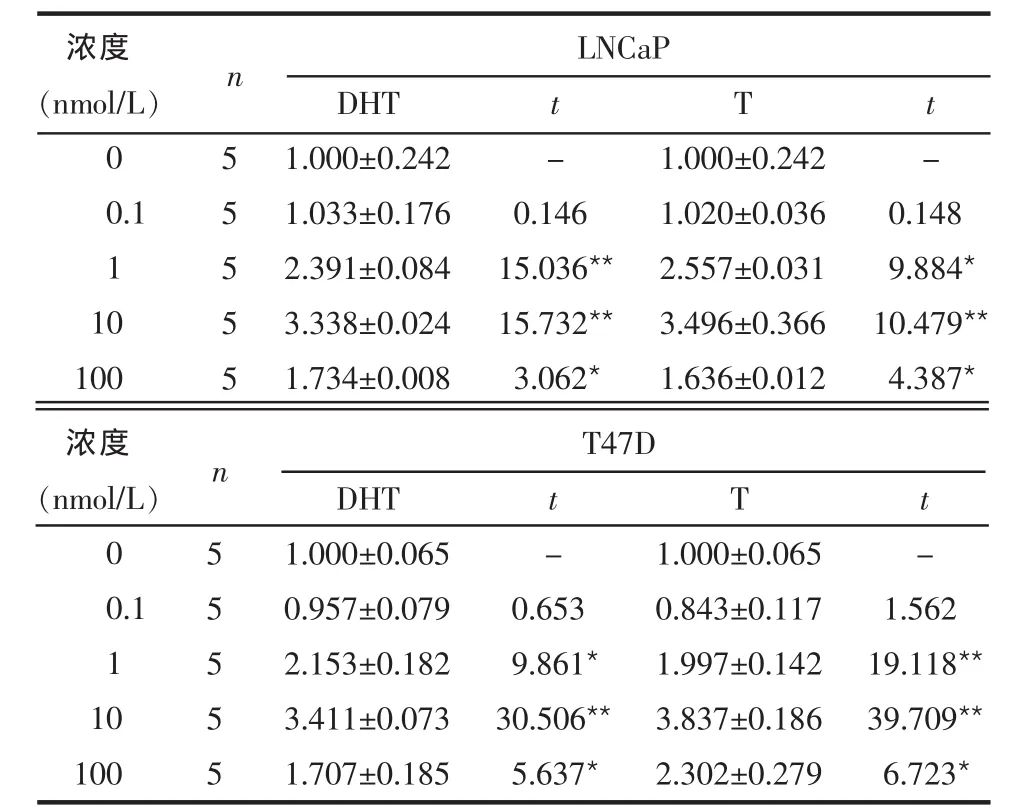
Table 2 PIP mRNA expressions of LNCaP and T47D cell lines stimulated by different concentrations of DHT or T表2 不同浓度DHT或T对LNCaP及T47D细胞系中PIP mRNA表达的影响 (PIP/GAPDH±s)
*P<0.05,**P<0.01;t值为各浓度组与0 nmol/L组比较,表4同
浓度(nmol/L)0 0.1 1 10 100 55555 DHT 1.000±0.242 1.033±0.176 2.391±0.084 3.338±0.024 1.734±0.008 t -0.146 15.036**15.732**3.062*T 1.000±0.242 1.020±0.036 2.557±0.031 3.496±0.366 1.636±0.012 t -0.148 9.884*10.479**4.387*LNCaP n浓度(nmol/L)0 0.1 1 10 100 55555 DHT 1.000±0.065 0.957±0.079 2.153±0.182 3.411±0.073 1.707±0.185 t -0.653 9.861*30.506**5.637*T 1.000±0.065 0.843±0.117 1.997±0.142 3.837±0.186 2.302±0.279 t -1.562 19.118**39.709**6.723*T47D n
Table 3 PIP mRNA levels of LNCaP and T47D cell lines stimulated by different times of 10 nmol/L DHT or T表3 10 nmol/L DHT或T处理不同时间对LNCaP及T47D细胞系中PIP mRNA表达的影响(PIP/GAPDHs)
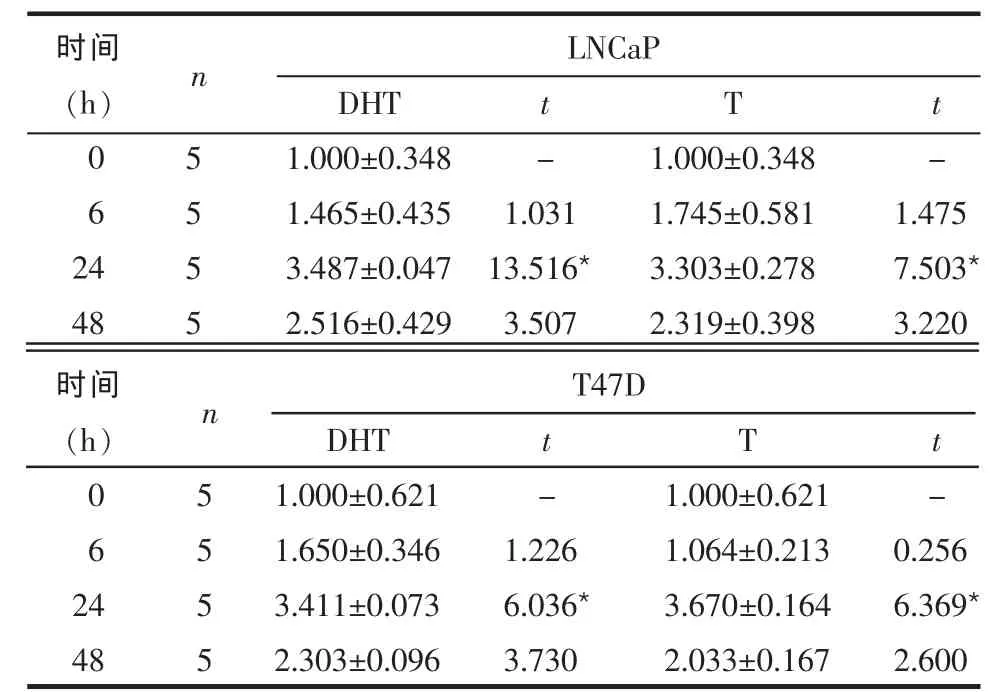
Table 3 PIP mRNA levels of LNCaP and T47D cell lines stimulated by different times of 10 nmol/L DHT or T表3 10 nmol/L DHT或T处理不同时间对LNCaP及T47D细胞系中PIP mRNA表达的影响(PIP/GAPDHs)
*P<0.05;t值为各时点组与0 h组比较,表5同
时间(h)062 4 48 5555 DHT 1.000±0.348 1.465±0.435 3.487±0.047 2.516±0.429 t -1.031 13.516*3.507 T 1.000±0.348 1.745±0.581 3.303±0.278 2.319±0.398 t -1.475 7.503*3.220 LNCaP n 5555 DHT 1.000±0.621 1.650±0.346 3.411±0.073 2.303±0.096 t -1.226 6.036*3.730 T 1.000±0.621 1.064±0.213 3.670±0.164 2.033±0.167 t -0.256 6.369*2.600 T47D n时间(h)062 4 48
2.3 雄激素对LNCaP及T47D中AR mRNA表达的影响 对LNCaP及T47D细胞给予不同浓度或不同时间DHT或T处理,AR mRNA的表达差异均无统计学意义(均 P>0.05),见表 4、5。
Table 4 AR mRNA levels of LNcap and T47D cell lines stimulated by different concentrations of DHT or T表4 不同浓度DHT或T对LNCaP及T47D细胞系中AR mRNA表达的影响 (PIP/GAPDHs)
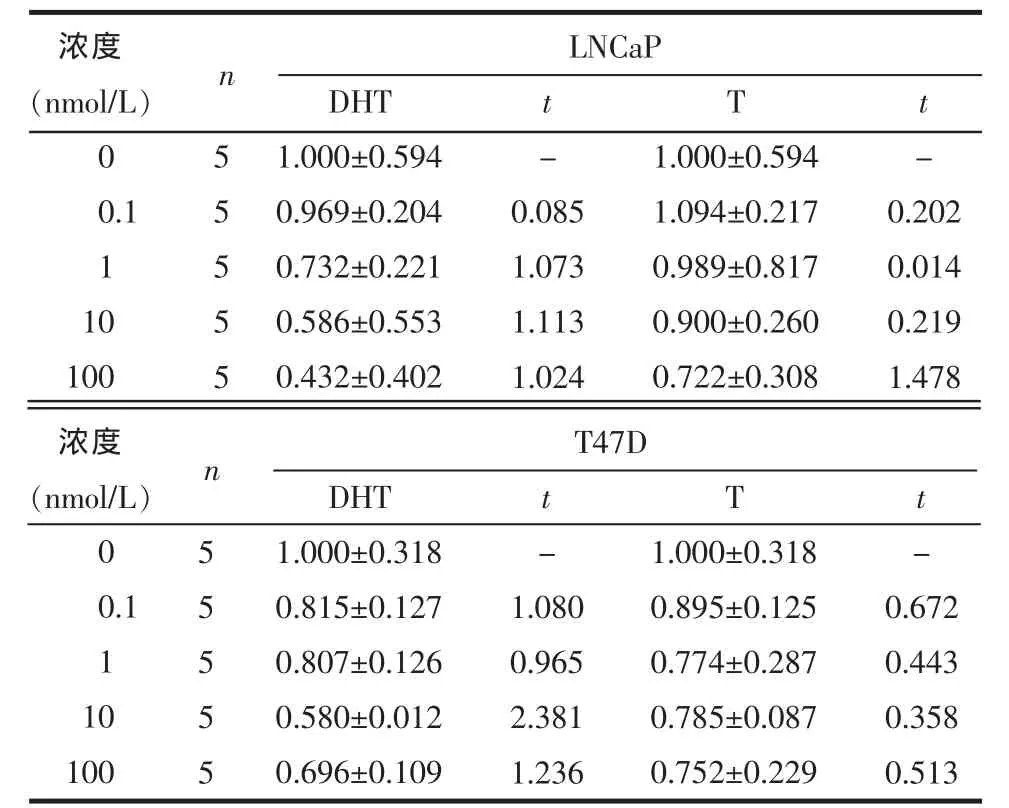
Table 4 AR mRNA levels of LNcap and T47D cell lines stimulated by different concentrations of DHT or T表4 不同浓度DHT或T对LNCaP及T47D细胞系中AR mRNA表达的影响 (PIP/GAPDHs)
均P>0.05
浓度(nmol/L)0 0.1 1 10 100 55555 DHT 1.000±0.594 0.969±0.204 0.732±0.221 0.586±0.553 0.432±0.402 t -0.085 1.073 1.113 1.024 T 1.000±0.594 1.094±0.217 0.989±0.817 0.900±0.260 0.722±0.308 t -0.202 0.014 0.219 1.478 LNCaP n浓度(nmol/L)0 0.1 1 10 100 55555 DHT 1.000±0.318 0.815±0.127 0.807±0.126 0.580±0.012 0.696±0.109 t -1.080 0.965 2.381 1.236 T 1.000±0.318 0.895±0.125 0.774±0.287 0.785±0.087 0.752±0.229 t -0.672 0.443 0.358 0.513 T47D n
Table 5 AR mRNA level of LNcap and T47D cell lines stimulated by different times of 10 nmol/L DHT or T表5 10 nmol/L DHT或T处理不同时间对LNCaP及T47D细胞系中AR mRNA表达的影响(PIP/GAPDHs)
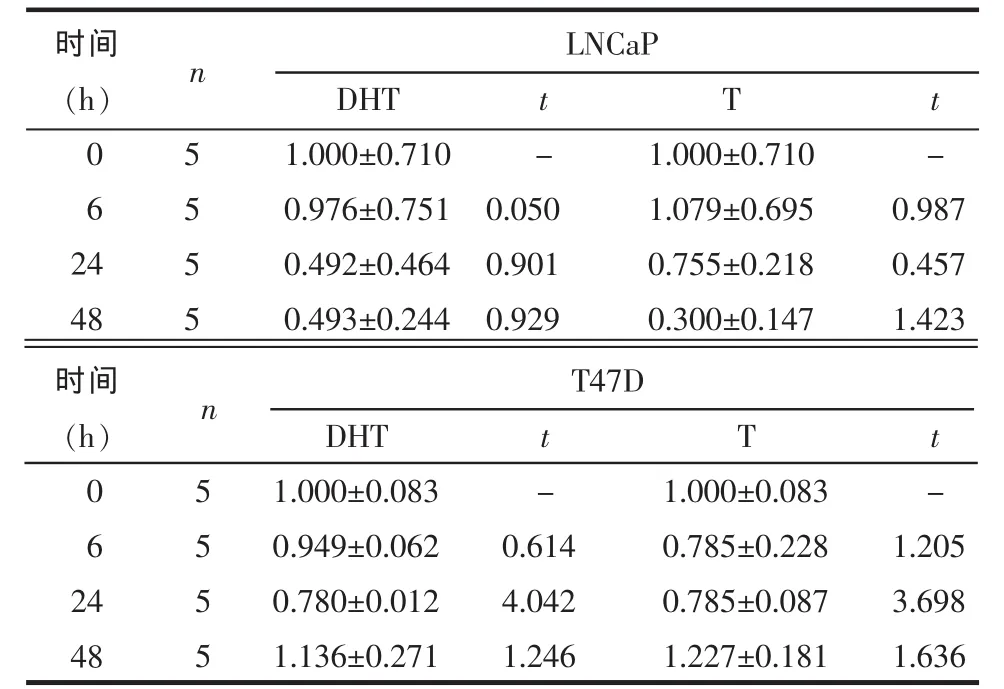
Table 5 AR mRNA level of LNcap and T47D cell lines stimulated by different times of 10 nmol/L DHT or T表5 10 nmol/L DHT或T处理不同时间对LNCaP及T47D细胞系中AR mRNA表达的影响(PIP/GAPDHs)
均P>0.05
时间(h)062 4 48 5555 DHT 1.000±0.710 0.976±0.751 0.492±0.464 0.493±0.244 t -0.050 0.901 0.929 T 1.000±0.710 1.079±0.695 0.755±0.218 0.300±0.147 t -0.987 0.457 1.423 LNCaP n 5555 DHT 1.000±0.083 0.949±0.062 0.780±0.012 1.136±0.271 t -0.614 4.042 1.246 T 1.000±0.083 0.785±0.228 0.785±0.087 1.227±0.181 t -1.205 3.698 1.636 T47D n时间(h)062 4 48
3 讨论
PIP虽是一种小分子糖蛋白,但却在肿瘤,尤其在乳腺癌和前列腺癌的增生和转移过程起作用,在免疫反应、抗菌、受精及细胞凋亡等方面也具有重要作用[4],并且PIP在乳腺癌中的过表达和癌的预后有关[7]。前期研究中已经证实PIP在正常前列腺组织中有表达,而且在前列腺癌中过表达[6]。本研究结果显示PIP在雄激素依赖性PCa细胞LNCaP中表达,进一步证实了PIP与PCa发生发展有关。
体外培养前列腺癌细胞发现,雄激素对其生长有双相作用,一定浓度范围的雄激素刺激前列腺癌细胞(如LNCaP)的生长,过大剂量雄激素则抑制其生长,而过低浓度的雄激素则对癌细胞的生长没有促进作用[8]。研究表明,在乳腺癌细胞系T47D中PIP的过表达受雄激素调节[9]。本研究结果显示,PIP的表达随雄激素的浓度增加而增加,当雄激素超过一定浓度时反而不能使PIP过度表达,说明PIP与LNCaP细胞的生长进程密切相关。结果还显示,PIP在雄激素依赖性PCa细胞LNCaP中表达,而在雄激素非依赖性PCa细胞PC-3和DU145中不表达,更加证实了PIP的表达受到雄激素的调控,并且提示雄激素依赖性PCa与雄激素非依赖性PCa的发生发展机制有所不同,PIP或许可以成为一种鉴别手段应用于临床。
研究认为,PIP基因上存在雄激素受体反应元件(androgen responsive element,ARE),而 AR 正是通过ARE作用于相关靶基因,从而介导产生雄激素生物学效应的[10]。当AR与雄激素配基结合后,AR构象发生改变形成同型二聚体并发生核转位反应,由胞浆转移至核内,识别并特异结合ARE,募集调节因子形成多蛋白复合体,该蛋白复合体与转录因子和基础转录装置相互作用从而调节基因转录[11]。目前研究认为,PCa与AR基因突变、扩增和表达缺失有关[12]。本研究结果显示,AR的表达并未随雄激素浓度及时间而增加,说明雄激素并非通过使AR增加来调控PIP的表达,或许是通过AR基因突变增加了其与雄激素及ARE的反应性,从而使PIP表达增多。
综上所述,PIP在雄激素依赖性前列腺癌细胞(LNCaP)及雄激素非依赖性前列腺癌细胞(PC-3、DU145)中的表达有差异,PIP的表达受到雄激素的调控作用,但雄激素的这一作用并非通过AR表达的增加来实现。PIP或许在前列腺癌发生发展进程中,以及鉴别前列腺癌是否具有雄激素依赖性方面有一定作用。
[1]田炜,郝志梅,梅津和夫,等.法医尸检标本中前列腺腺癌的发生率和分级[J].中国煤炭工业医学杂志,2007,10(5):614-615.
[2]潘寿华,阎家峻,郑专.前列腺癌雄激素依赖转化后雄激素受体基因表达变化的研究[J].中国癌症杂志,2011,21(4):287-289.
[3]王素云,田炜.泌乳素诱导蛋白基因及其在肿瘤中作用的研究进展[J].广东医学,2011,32(21):2872-2874.
[4]Hassan MI,Waheed A,Yadav S,et al.Prolactin inducible protein in cancer,fertility and immunoregulation:structure,function and its clinical implications[J].Cell Mol Life Sci,2009,66(3):447-459.
[5]Takeda Y,Tsuta K,Shibuki Y,et al.Analysis of expression patterns of breast cancer-specific markers(mammaglobin and gross cystic disease fluid protein 15)in lung and pleural tumors[J].Arch Pathol Lab Med,2008,132(2):239-243.
[6]Tian W,Osawa M,Horiuchi H,et al.Expression of the prolactininducible protein (PIP/GCDFP15)gene in benign epithelium and adenocarcinoma of the prostate[J].Cancer Sci,2004,95(6):491-495.
[7]Blanchard A,Nistor A,Castaneda FE,et al.Generation and initial characterization of the pro lactin-inducible protein (PIP)null mouse:accompanying global changes in gene expression in the submandibular gland [J].Can J Physiol Pharmacol,2009,87(10):859-872.
[8]Culig Z,Hoffmann J,Erdel M,et al.Switch from antagonist to agonist of the androgen receptor blocker bicalutamide is associated with prostate tumor progression in a new model system [J].Br J Cancer,1999,81(2):242-251.
[9]Hassan MI,Bilgrami S,Kumar V,et al.Crystal structure of the novel complex formed between zinc alpha2-glycoprotein(ZAG)and prolactin-inducible protein(PIP)from human seminal plasma[J].J Mol Biol,2008,384(3):663-672.
[10]Fujimoto N,Yeh S,Kang HY,et al.Cloning and characterization of androgen receptor coactivator,ARA55,in human prostate [J].J Biol Chem,1999,274(12):8316-8321.
[11]Agoulnik IU,Weigel NL.Androgen receptor action in hormonedependent and recurrent prostate cancer[J].J Cell Biochem,2006,99(2):362-372.
[12]Hughes C,Murphy A,Martin C,et al.Molecular pathology of prostate cancer[J].J Clin Pathol,2005,58(7):673-684.
