牛支原体蛋白质组学双向电泳技术的建立及初步分析
2012-07-09辛九庆张秀英
陈 维,李 媛,辛九庆,刘 洋,张秀英
(1.东北农业大学动物医学学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究室,哈尔滨 150001)
牛支原体(Mycoplasma bovis,M.bovis)属于柔膜体纲(Mollicute),支原体目(Mycoplasmatales),支原体科(Mycoplasmataceae),支原体属(Mycoplasma),是牛肺炎、关节炎、乳腺炎和角膜结膜炎等一些其他疾病的主要病原[1-5]。该病原1961年首次在美国牛乳腺炎病例中分离得到[6]。近几年M.bovis相关疾病的广泛传播给世界养牛业造成严重的经济损失[7]。我国于2008年首次从呼吸道疾病病例中分离得到M.bovis病原[2]。试验通过对M.bovis全菌蛋白样品的制备,固相干胶条pH梯度等双向电泳的几个关键环节进行分析,建立了适合分离M.bovis蛋白的双向凝胶电泳技术方案,得到了分辨率较高和重复性较好的电泳图谱,并对部分蛋白进行质谱鉴定,初步分析其功能,为进一步对M.bovis进行蛋白质组学研究打下基础。
1 材料与方法
1.1 材料
1.1.1 菌种
M.bovis Hubei分离株由哈尔滨兽医研究所细菌室支原体研究组从湖北省送检的牛肺中分离纯化及保存[2]。
1.1.2 主要试剂和设备
IPG干胶条13 cm(pH 4~7和 pH 3~10)、IPG Buffer(pH 4~7和 pH 3~10)、CHAPS、二硫苏糖醇(DTT)、尿素、硫脲、碘乙酰胺(IAA)、2D quant试剂盒,2D Clean-up试剂盒,考马斯亮蓝R350均购自美国GE healthcare公司。快速银染试剂盒购自碧云天生物技术研究所。
等电聚焦系统Ettan IPGphorⅢ,胶条槽Ettan IPGphor Manifold,标准垂直电泳系统SE 600 Ruby,扫描仪Image Scanner美国安玛西亚公司,超速离心机美国Beckman公司。
1.2 方法
1.2.1 样品的处理
将M.bovis菌株接种于含100 mL·L-1马血清的马丁肉汤培养基中,37℃培养至浓度(CFU)为1×108~1×109个·mL-1时,取培养物14 000 r·min-1离心1 h收集菌体沉淀。将菌体沉淀洗涤3次(洗涤缓冲液:10 mmol·L-1Tris-Cl)。洗涤后将每50 mL培养物的菌体沉淀分装一管于液氮中冻存备用。每管菌体沉淀用 200 μL 裂解液缓冲液(20 mmol·L-1Tris-cl pH 7.5,7 mol·L-1尿素,2 mol·L-1硫脲,4%CHAPS,2%IPG Buffer,40 mmol·L-1DTT),室温振荡裂解1 h。裂解充分后25 000 g离心1 h,取上清。
M.bovis总蛋白质的提取:①2D Clean-up处理裂解样品,参照试剂盒说明书操作提取蛋白。②TCA-丙酮法处理裂解样品,每100 μL加入1 mL(10倍体积于裂解样品)预冷(在-20℃下预冷1 h)的10%TCA-丙酮溶液,于-20℃静置过夜后,4℃、15 000 r·min-1离心15 min,弃上清,沉淀用10倍体积于裂解样品的预冷的90%丙酮溶液重悬,-20℃放置15 min,15 000 r·min-1离心15 min,沉淀室温放置风干5 min。
将上述方法提取的蛋白沉淀用200 μL(2倍体积于裂解样品)水化液(7 mol·L-1尿素,2 mol·L-1硫脲,2%CHAPS,0.002%溴酚蓝。上样前加入0.5%IPG缓冲液,40 mmol·L-1DTT)重新溶解。
1.2.2 双向电泳(2-DE)试验
根据胶条的pH范围和后续的染色方法吸取适量已定量样品,参照GE Healthcare公司提供的试验操作手册一步完成胶条的水化、上样和第一向等电聚焦(聚焦参数为:30 V,12 h;200 V,30 min;500 V,2 h;1 000 V,1 h;7 000 V,2 h;7 000 V,50 000 Vh)。
配制12.5%聚丙烯酰胺分离胶,将平衡后的胶条移至凝胶上端,0.5%低熔点琼脂糖封闭IPG胶条,设置电泳程序为:5 mA·gel-1电泳1.5 h进胶,然后20 mA·gel-1,当溴酚兰指示线至凝胶下缘时停止电泳。将凝胶分别用考马斯亮蓝R350加热染色和银染染色,然后用Image Scanner扫描仪以300 dpi分辨率透射扫描凝胶,利用Image Master 2D Platinum version 6.0软件分析凝胶图像。银染参照快速银染试剂盒说明书进行。
1.2.3 图像分析及部分蛋白点的质谱鉴定与数据库检索分析
相同条件下(2D Clean-up试剂盒处理的蛋白样品400 μg,13 cm干胶条(pH 4~7),考马斯亮蓝R350染色)重复3次,将获得的图谱利用Image Master 2D Platinum version 6.0软件进行点匹配和重复性检测。
随机挑取重复性好的蛋白点由哈尔滨赛拓生物科技有限公司进行质谱鉴定,并将鉴定结果与自建的M.bovis蛋白数据库以及NCBInr数据库检索分析。
2 结果与分析
2.1 不同蛋白提取方法对蛋白得率的影响
2D Clean-up试剂盒和TCA-丙酮法提取的蛋白含量分别为 10.884 mg·mL-1和 4.31 mg·mL-1,这表明利用两种方法提取的蛋白含量差异较大,TCA-丙酮法蛋白损失多于2D Clean-up试剂盒提取。
将两种方法提取的蛋白各上样400 μg,在13 cm干胶条(pH 3~10)上进行双向凝胶电泳,考马斯亮蓝R350染色,结果见图1。

图1 不同处理方法的双向凝胶电泳图谱Fig.1 Two-dimensional gel electrophoresis(2-DE)protein maps of M.bovis proteins under different treatment
由图1可知,2D Clean-up试剂盒处理的蛋白在胶图上展现了更多的点,且点聚焦效果更好,拖尾少,效果更好。
2.2 不同固定干胶条pH范围的电泳结果
将2D Clean-up试剂盒处理的样品400 μg,在13 cm(pH分别为3~10和 4~7)的干胶条中进行双向凝胶电泳,考马斯亮蓝R350染色,对比结果见图2。
由图2-a可知,M.bovis的大部分蛋白的pI值集中分布在pH 4~7区域,但这些蛋白在pH 3~10梯度上分辨率低,而在图2-b pH 4~7中这些蛋白距离拉开能更清晰的展示在胶图上。

图2 不同pH范围双向凝胶电泳图谱Fig.2 Two-dimensional gel electrophoresis(2-DE)protein images of M.bovis proteins with different IPG
2.3 不同染色方法的电泳结果
将2D Clean-up试剂盒处理的样品400 μg,在13 cm干胶条(pH 4~7)中进行双向凝胶电泳,考马斯亮蓝R350染色,与125 μg样品在13 cm干胶条(pH 4~7)中进行双向凝胶电泳,快速银染试剂盒染色对比,结果见图3。
由图3可知,银染法蛋白点数比考马斯亮蓝染色法多且清晰,上样量少。

图3 不同染色方法双向凝胶电泳图谱Fig.3 Two-dimensional gel electrophoresis(2-DE)protein images of M.bovis proteins with different staining
2.4 M.bovis蛋白2-DE的重复性
确定了双向电泳各个环节之后,对相同条件(上样量400 μg,pH 4~7 13 cm干胶条,考马斯亮蓝R350染色)的3次重复获得的图像进行点匹配分析,蛋白斑点检测参数设置为:smooth 2,min area 50和saliency 50。消除干扰斑点和假斑点后,各胶的斑点数较一致(分别为506,516,538),平均斑点数为520个,Gel2与参考胶的匹配率为79.9%,Gel3与参考胶(Master)的匹配率为82.0%,平均匹配率为80.95%,胶匹配结果见图4。
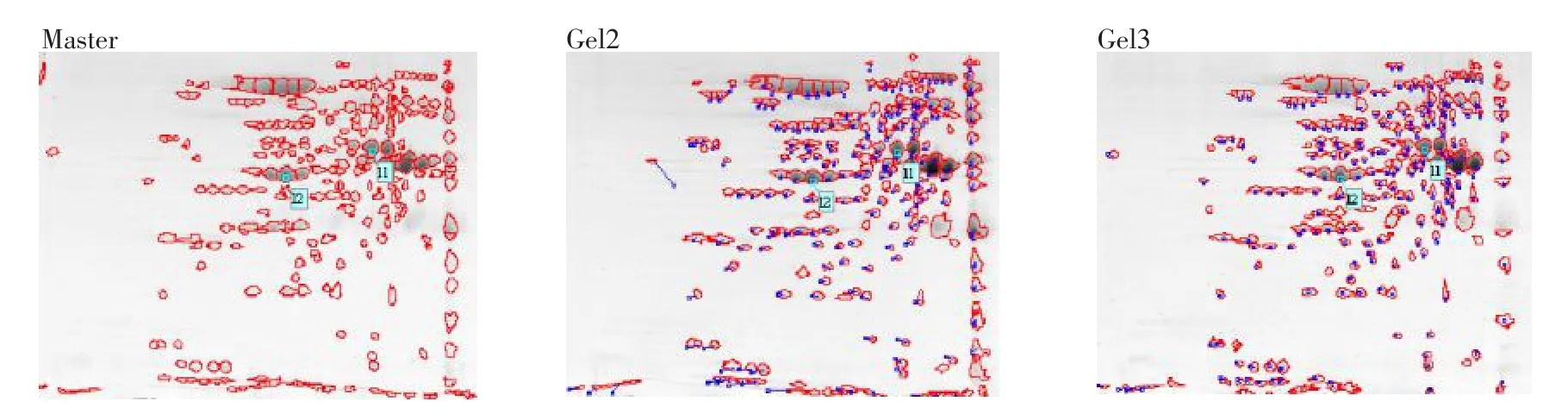
图4 重复性检测蛋白斑点的胶匹配结果Fig.4 Match gels of protein dots of repetitive testing
由图4可知,Gel2和Gel3上的斑点和master凝胶上的斑点之间的匹配矢量长度很短,方位一致,说明匹配率高,重复性好。
2.5 部分蛋白点的质谱鉴定与数据库检索分析结果
结果见表1。
选取重复性较好的20个蛋白质点进行质谱和生物信息学分析。质谱分析后,获得19蛋白质点的肽质量指纹图谱,鉴定成功率为95%。通过检索结果可以获悉,蛋白点匹配率较高,分值高于82的分值限值(P<0.05)的不同蛋白有12个,多为酶类。

表1 从蛋白质库搜索与质谱结果相匹配的蛋白质(P<0.05)Table 1 Information of proteins whose MS results matched with that in the proteins bank(P<0.05)
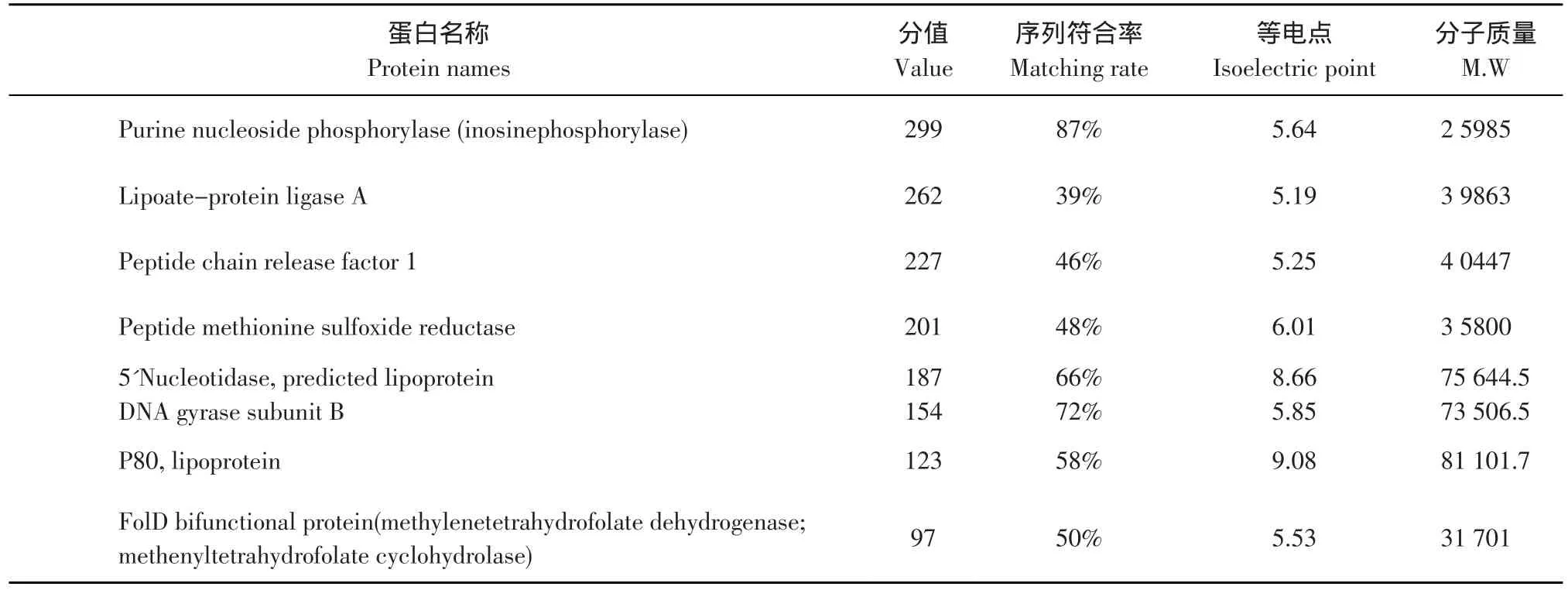
续 表
3 讨论与结论
在蛋白水平上对M.bovis进行研究,对更好地揭示M.bovis的致病及免疫调节机制有重要意义[8-10]。双向电泳是从等电点和分子量两个方面分离和展示蛋白质,已成为蛋白质组学研究中主要的技术手段[11],本试验通过双向电泳几个关键环节的分析优化建立了适合于M.bovis蛋白质的双向电泳技术方案。
双向电泳的最关键环节是蛋白样品的制备,样品制备越简单杂质引入及蛋白丢失越少。实验中菌体沉淀洗涤液含有较少的小分子盐,对一向聚焦的影响较小。M.bovis缺乏细胞壁,在菌体洗涤后液氮中速冻,再配合裂解液室温裂解即可充分裂解M.bovis[12]。裂解液中添加硫脲能更有效地溶解蛋白,尤其可以增加疏水性膜蛋白的溶解度[13-14]。同等条件下,2D Clean-up试剂盒比TCA-丙酮法提取的蛋白损失少,图1结果也显示出2D Clean-up试剂盒处理的图蛋白点清晰和拖尾少的现象。低丰度蛋白质往往具有重要的生物功能,一直是2-DE研究的热点[15],提高上样量有利于低丰度蛋白质的检测,但上样量过高,高丰度蛋白质的斑点过大会掩盖低丰度蛋白,或者聚焦时堵塞干胶条影响其他蛋白质点的分离和分析。为了解一个新样品蛋白的分布,最先使用宽范围、线性pH 3~10梯度[16],再根据感兴趣蛋白的分布选择窄范围胶条分离。由图2可见M.bovis的大部分蛋白的pI值分布在pH 4~7区域,在pH 3~10梯度上分辨率低。双向电泳常用染色方法中银染可以检测到ng级的蛋白点,上样量小,常用于珍贵的蛋白样品,但其线性范围窄,受温度影响大,每步操作需要精确控制时间,且判断染色终止全凭主观经验,这些导致实验重复性差。考马斯亮蓝染色法灵敏度低,上样量大,但线性范围广,过染后还可脱色至背景清晰,所以本研究中也普遍采用考马斯亮蓝染色法。
目前国际上尚未见到对M.bovis蛋白质组学的研究报道,因此,在今后的研究中可通过免疫印迹等方法筛选出其中与致病性相关的蛋白质,再进行质谱测序,从而鉴定出致病性相关蛋白,这样可以为致病机理的研究提供蛋白质组信息,同时也为开发M.bovis病的诊断防治方法提供帮助。
本试验成功建立了能有效分离M.bovis全菌蛋白的2-DE技术平台,并经质谱分析成功鉴定了12个蛋白。
[1]Nicholas R A J and Ayling R D.Mycoplasma bovis:Diagnosis and control[J].Res Vet Sci,2003,74:105-112.
[2]辛九庆,李媛,郭丹,等.国内首次从患肺炎的犊牛肺脏中分离到M.bovis[J].中国预防兽医学报,2008,30(9):661-664.
[3]Gonzalez R N and Wilson D J.Mycoplasmal mastitis in dairy herds[J].Vet Clin North Am Food Anim Pract,2003,19:199-221.
[4]Gagea M I,Bateman K G,Shanahan R A,et al.Naturally occurring Mycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves[J].Vet Diagn Invest,2006,18:29-40.
[5]Haines D,Martin K,Clark E,et al.The immunohistochemical detection of feedlot cattle with chronic unresponsive respiratory disease and/or arthritis[J].Canadian Vet,2001,42(1):857-860.
[6]Hale H H,Hemboldt C F,Plastridge W N,et al.Bovine mastitis caused by a Mycoplasma species[J].Cornell Veterinarian,1962,52:582-591.
[7]Tschopp R,Bonnemain P,Nicolet J,et al.Epidemiological study of risk factors for Mycoplasma bovis infections in fattening calves[J].Schweiz Arch Tierheilkd,2001,143:461-467.
[8]Lysnyansky I,Rosengarten R and Yogev D.Phenotypic switching of variable surface lipoproteins in Mycoplasma bovis involves high-frequency chromosomal rearrangements[J].Bacteriol,1996,178:5395-5401.
[9]Lysnyansky I,Yogev D and Levisohn S.Molecular characterization of the Mycoplasma bovis P68 gene,encoding a basic membrane protein with homology to P48 of Mycoplasma agalactiae[J].Res Letter,2008,279:234-242.
[10]Lysnyansky I,Ron Y,Sachse K,et al.Intrachromosomal recombination within the vsp locus of Mycoplasma bovis generates a chimeric variable surface lipoprotein antigen[J].Infection and Immunity,2001,69(6):3703-3712.
[11]Hanash S.Disease proteomics[J].Nature,2003,422(6928):226-232.
[12]Wilkins M R,Jones R C,Henry R R,et al.From proteins to proteomes:large scale protein identification by two-dimensional electrophoresis and amino acid analysis[J].Biotechnology,1996,14:61-65.
[13]Rabilloud T and Adessi C.Improvement of the solubilization of proteins in two-dimensional electr-ophoresis with immobilized pH gradients[J].Electrophoresis,1997,18:307-316.
[14]Gorg A,Obermaier C,Boguth G,et al.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2000,21(6):1037-1053.
[15]Jungblut P R,Zimny-Arndt U,Zeindl-Eberhart E,et al.Proteomics in human disease:Cancer,heart and infectious diseases[J].Electrophoresis,1999,20(10):2100-2110.
[16]Bjellqvist B,Sanchez J C,Pasquaili C,et al.A nonlinear widerange immobilized pH gradient for two-dimensional electrophoresis and its definition in a relevant pH scale[J].Electrophoresis,1993,14(1):1357-1365.
