神经外科手术患者应用氟喹诺酮类药抗感染疗效的影响因素
2012-07-07唐宗椿王晓峰杨兴奎张荣军解放军第三医院神经外科陕西宝鸡721004
唐宗椿,王晓峰,杨兴奎,张荣军 (解放军第三医院神经外科,陕西宝鸡 721004)
氟喹诺酮类药是一类人工合成抗菌药物,因其抗菌谱广、抗菌作用强等特点而广泛用于临床。随着该药在临床的广泛应用,呈现出耐药性增长过快的趋势[1-3]。合理、规范氟喹诺酮类药的使用势在必行。如何合理使用该类药、应用中有哪些需着重关注的因素是临床关注的焦点[4]。本研究对本院神经外科使用该类药的患者进行调查,分析影响氟喹诺酮类药抗感染疗效的主要因素,为临床合理用药提供参考。
1 资料与方法
1.1 临床资料
选择2010年1月至2011年12月本院神经外科住院手术且诊断为呼吸道感染患者249例,男性167例,女性82例,年龄(54.4±17.6)岁。患者用氟喹诺酮类药物进行抗感染治疗,并且符合下列条件:①明确诊断细菌感染;②符合用氟喹诺酮类药物适应证;③使用氟喹诺酮类药物其中1种;④手术等相关用药治疗。
1.2 分析变量选择
对影响氟喹诺酮类药物治疗效果的项目(变量)进行选择,包括年龄、性别、吸烟史、饮酒史、肌酐(Cr)、尿素氮(BUN)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、药物品种、给药次数、给药时间等11个项目,这些项目中以病历记载和实验室检查数据为准,药物品种、给药频率和给药时间以病历中医嘱为准。
1.3 治疗效果评价
患者为入院手术后使用氟喹诺酮类药物2周后进行评价,具备下列中的两项为有效,1项或以上不符合者视为无效[4]:①白细胞计数等实验室检查结果恢复正常;②体温、咳嗽、咯痰等症状和体征有明显好转或消失;③影像学检查正常。
1.4 统计学分析
使用SPSS15.0软件对数据进行统计分析和处理。患者自身及给药情况对药物疗效的影响采用多因素Logistic回归分析,P<0.05表明差异有统计学意义。
2 结果
2.1 入选病例
本组病例133例(53.41%),其中男87例,女46例,年龄(56.7 ±16.8)岁。治疗有效者 109 例(81.95%),无效者 24例。肝肾功能正常参考值范围[5]:Cr 62~116μmol/L(男性),44~96 μmol/L(女性);BUN 2.9~8.1 mmol/L;ALT 5~40 U/L(男性),5~35 U/L(女性);AST(男性 0~40 U/L,女性0~32 U/L)。变量中所分析的因素见表1。
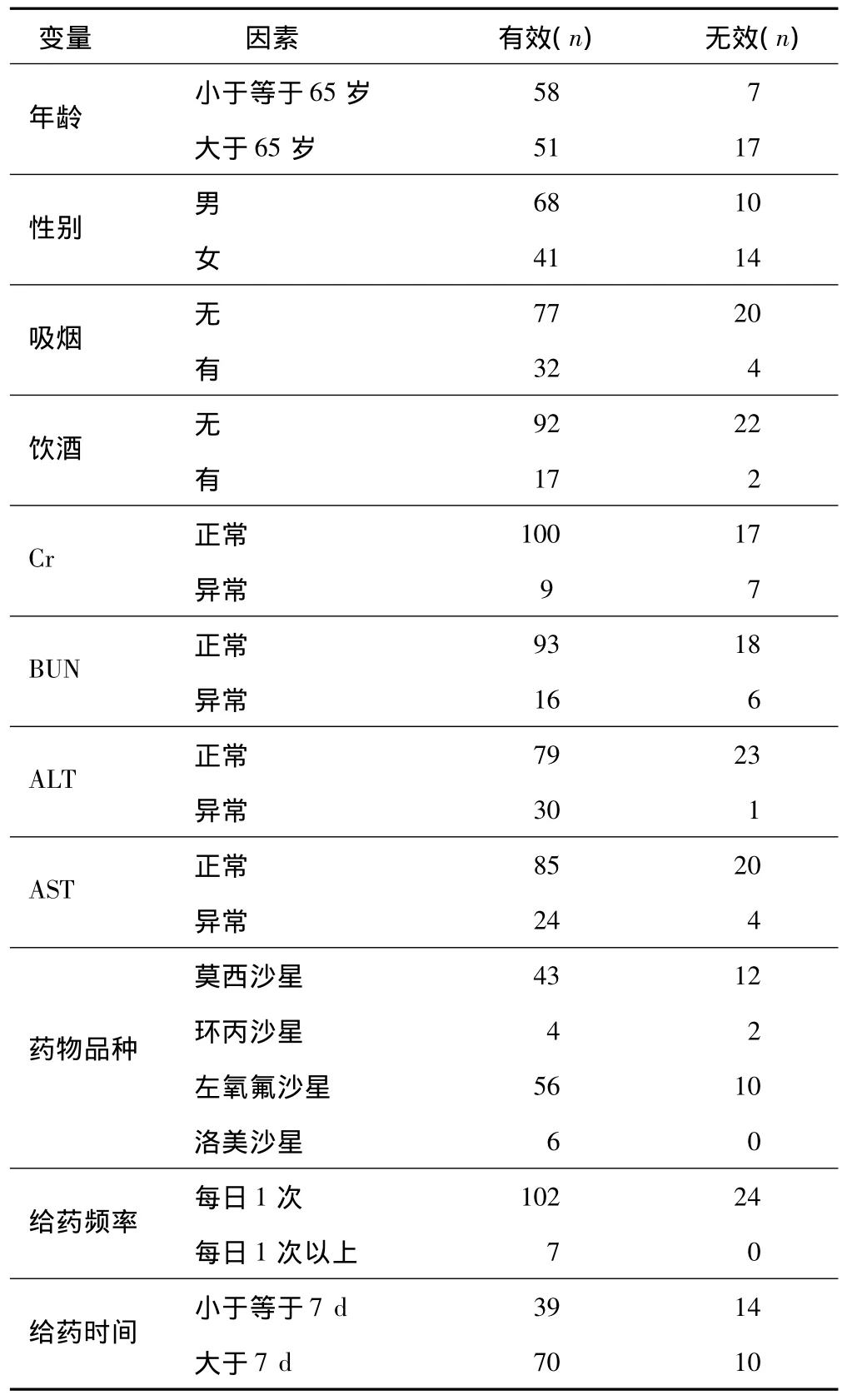
表1 影响抗感染药物疗效的基本因素
2.2 Logistic回归分析
对影响氟喹诺酮类抗感染药物疗效的因素进行多因素Logistic回归分析,结果表明影响抗感染药物疗效的主要因素是年龄、性别、Cr、ALT 和 AST 等5个(P<0.05),见表2。
2.3 药敏试验
本组133例病例中,有16例患者微生物试验培养出致病菌,检出率仅为12.03%。16例药敏试验结果,即检测例数(耐药例数)为:铜绿假单胞菌3(3),大肠埃希菌3(2),肺炎克雷伯菌2(1),模仿葡萄球菌2(1),耐甲氧西林金黄色葡萄球菌1(1),赛氏葡萄球菌1(1),鲍曼不动杆菌1(1),产气肠杆菌1(0),缓症链球菌1(1)和嗜麦芽窄食单胞菌1(0)。
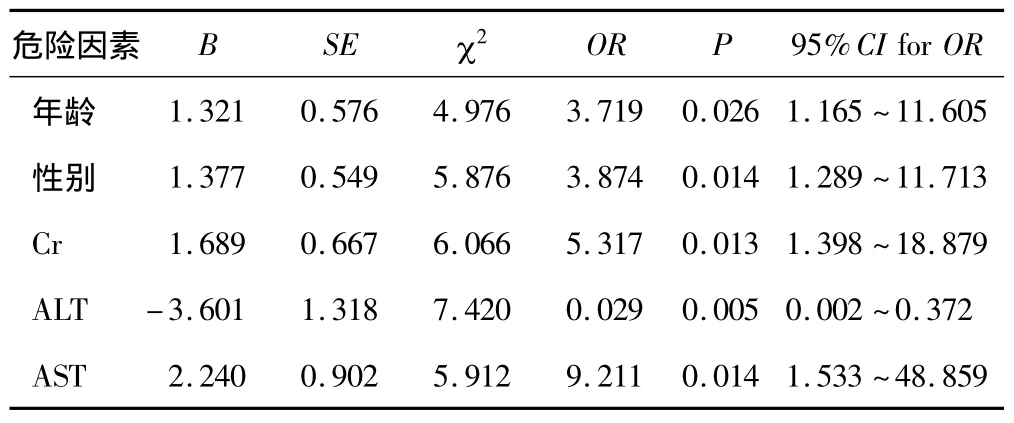
表2 影响抗感染药物疗效的多因素Logistic回归分析
3 讨论
3.1 合理应用氟喹诺酮类药物
氟喹诺酮类药物是含氟的第三代喹诺酮药,在喹诺酮类结构中加入了氟,使它的药代动力学发生了改变,提高了其抗菌作用。β-内酰胺类和氨基糖甙类药物由于临床应用时间长且广泛,耐药菌株不断增加,在此情况下,氟喹诺酮类药物逐渐成为临床抗菌药物的主力,受到广泛重视[6-9]。氟喹诺酮类抗菌谱广,对革兰阴性和阳性菌均有显著的抗菌效果,肺炎克雷伯菌、产气荚膜杆菌、变形杆菌属、沙门菌属、志贺菌属等革兰阴性杆菌的作用更强,同时对其他致病菌同样有一定杀灭或抑制作用,目前已广泛应用于呼吸道感染、尿路感染和腹腔感染等[8-10]。随着氟喹诺酮类药物新品种的不断问世和广泛应用,以及忽略患者的个体差异,不合理用药增加,细菌对氟喹诺酮类药的耐药性也在不断上升[11-12]。合理应用氟喹诺酮类药物显得非常重要。临床上抗菌药物个体化治疗方案的制定必须依据的是存在应用抗菌药物指征,有药敏试验结果和患者具体情况等。合理的抗菌药物个体化应用可以发挥药物的最大功效,减少耐药性的发生,同时最大限度地降低医疗费用。本文对患者个体情况与氟喹诺酮类抗菌药疗效间的相关性进行研究,探讨其内在联系,评价影响药物疗效的个体因素,为氟喹诺酮类药物的临床个体化治疗提供理论依据。
3.2 氟喹诺酮类药物疗效的主要影响因素
本文通过Logistic回归分析结果表明,年龄对氟喹诺酮类药有显著影响(P<0.05)。老年人使用氟喹诺酮类药时,由于脏器功能较差,如肾脏血流改变,肾小球滤过功能下降等,药代动力学存在潜在的变化[12-14]。如果老年患者肌酐清除率下降,在应用该类药时需要减量,需要结合老年患者的身体状况以及病情变化,随时对用药方案进行合理的调整。肌酐是人体肌肉组织代谢产生的小分子物质,通过肌酐值计算可反映肾脏的代谢能力,肾脏代谢功能下降时肌酐清除率过低,这时应用氟喹诺酮类药,可采用测定肌酐清除率的方法区分肾功能损害程度从而调整用药方案。本研究也表明,肌酐值是影响氟喹诺酮类药疗效的主要因素(P<0.05)。肝功能重要指标是ALT和AST,在我们的分析中也得到证实。诺氟沙星、氟罗沙星等氟喹诺酮类药需通过肝脏代谢,肝受损会影响这些药物的代谢,从而使血药浓度升高。肝受损或其他因素均可影响氟喹诺酮类药疗效,主要是药物代谢受影响,血药浓度发生了改变[13-16]。虽然氟喹诺酮类药的肝毒性相对较小,但也有文献报道其严重肝毒性的个案。因此,肝受损患者在使用氟喹诺酮类药时应慎重选择适宜的剂量,以提高其安全性。
3.3 药敏试验与临床用药
抗菌药物广泛应用的后果是新型致病菌的不断出现,从而抗菌药物的防治效果越来越差。并且各种致病菌对不同的抗菌药物的敏感性不同,同一细菌的不同菌株对不同抗菌药物的敏感性也有差异[2-4]。各种致病菌耐药性的产生使各种常用抗菌药物往往失去药效,以及不能很好的掌握药物对细菌的敏感度。正确药敏试验结果,可供临床医师选用抗菌药物,进行有针对性的治疗[10-12]。本组133例患者中有16例检出致病菌,仅为12.03%,这可能与临床采集标本过程存在不足有关,尚需改进。由于致病菌检出率较低,对临床治疗指导作用不大,本文也无法对其相关性进行统计分析。在仅有的14例药敏试验报告中,铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌、鲍曼不动杆菌等全部对氟喹诺酮类药耐药,大肠埃希菌部分耐药,肺炎克雷伯菌、嗜麦芽窄食单胞菌等敏感,这几种致病菌因样本过小仅供参考。
本文分析表明,临床应用氟喹诺酮类药物过程中,必须重视年龄、性别、肝肾功能情况,以达到最小副作用和最大治疗作用的效果。以药敏试验为基础,对于老年、肾功能异常患者必须实行个体化治疗,并根据病情变化和肝肾功能状况给予合适的剂量和给药间隔。
[1] 赵 磊,荆鹏伟.氟喹诺酮类药物体外诱导大肠埃希菌耐药性观察[J].郑州大学学报(医学版),2011,46(1):103 -106.
[2] Morgan Linnell SK,Becnel Boyd L,Steffen D,et al.Mechanisms accounting for fluoroquinolone resistance in Escherichia coli clinical isolates[J].Antimicrob Agents Chemother,2009,53(1):235 -241.
[3] Gao Q,Zheng HB,Luo D,et al.Facile synthesis of magnetic one-dimensional polyaniline and its application in magnetic solid phase extraction for fluoroquinolones in honey samples[J].Anal Chim Acta,2012,720:57-62.
[4] 赵德恒,李娅杰,谢松梅,等.对抗菌药物临床试验指导原则中疗效评价标准的考虑[J].中国临床药理学杂志,2008,24(6):564-565.
[5] 于本章,王振忠,张承勋,等.临床检验手册—怎样看医院化验报告[M].上海:第二军医大学出版社,2002:97-108.
[6] 王明霞,白颐卿,杜恩起.氟喹诺酮类药物在肾功能损害患者中的药物动力学[J].中国医院药学杂志,2000,20(5):291 -294.
[7] 陈五波,林辉龙.肾功能减退时抗菌药物的应用[J].基层医学论坛,2009,13(7):247 -248.
[8] 李志强,张印刚,邱 方.莫西沙星与左氧氟沙星治疗社区获得性下呼吸道感染的系统评价[J].中国药房,2011,22(4):364 -367.
[9] 王月明.100例氟喹诺酮类药物不良反应分析[J].医学信息(上旬刊),2011,24(12):3799 -3801.
[10] 于玲玲,胡必杰,黄声雷,等.大环内酯类和氟喹诺酮类药物对细胞内嗜肺军团菌的作用[J].中华结核和呼吸杂志,2011,34(6):409-412.
[11] 方可华,于锋英.细菌对氟喹诺酮类药物耐药机制的研究进展[J].上海医药,2011,32(5):227 -228.
[12] Abbasi S,Imtiaz A,Usman J,et al.Evaluation of the current trend of nalidixic acid susceptibility in typhoidal Salmonellae;a marker of therapeutic failure for the fluoroquinolones[J].Iran J Microbiol,2011,3(2):80-83.
[13] Castanheira M,Deshpande LM,Jones RN,et al.Evaluation of quinolone resistance-determining region mutations and efflux pump expression in Neisseria meningitidis resistant to fluoroquinolones[J].Diagn Microbiol Infect Dis,2012,72(3):263 -266.
[14] Rice LB.Mechanisms of resistance and clinical relevance of resistance to β-lactams,glycopeptides,and fluoroquinolones[J].Mayo Clin Proc,2012,87(2):198 -208.
[15] Kim H,Nakajima C,Kim YU,et al.Influence of lineage-specific amino acid dimorphisms in GyrA on Mycobacterium tuberculosis resistance to fluoroquinolones[J].Jpn JInfect Dis,2012,65(1):72 -74.
[16] Hao H,Yang B,Shi J,et al.Drug resistance and related genes of chickenborne Salmonella to quinolone and fluoroquinolones[J].Wei Sheng Wu Xue Bao,2011,51(10):1413 -1420.
