SD大鼠钳夹脊髓损伤模型的建立
2012-07-07李祥炎陈建梅崔晓萍三明市第一医院骨科福建三明365000南京军区福州总医院a骨科神经内科福建福州350025
李祥炎,陈建梅,崔晓萍,徐 皓 (.三明市第一医院骨科,福建 三明 365000;2.南京军区福州总医院a:骨科,b:神经内科,福建福州 350025)
脊髓损伤后经过一系列复杂的病理生理改变会引起脊髓组织内神经细胞发生不可逆死亡,最终导致瘫痪。目前对其病理机制的研究还未完全阐明,建立合适的动物模型是开展研究重要前提。然而,现有的动物模型无法满足急性脊髓挤压等多种损伤类型的研究需要。本实验根据临床损伤特点,利用动脉瘤夹钳夹SD大鼠T10脊髓,以建立一种与临床脊髓损伤机制相接近的动物模型,从而为进一步探讨脊髓损伤后的修复提供基础。
1 材料与方法
1.1 材料
雄性清洁级Sprague-Dawley(SD)大鼠36只,体质量(262.3±5.6)g,购自上海斯莱克实验动物有限公司[合格证号:SCXK(沪)2007-0005],常规饲养1周后开始进行实验。将大鼠随机分成3组,每组12只。脊髓损伤组(A组):用动脉瘤夹钳夹大鼠T10脊髓;假手术组(B组):只打开椎板,暴露T10脊髓,不造成SCI;正常对照组(C组):不进行任何手术操作。术前所有实验动物双后肢BBB评分均为21分。
1.2 方法
1.2.1 脊髓损伤的制备 A组:将大鼠用10%水合氯醛(0.3 mL/100g)腹腔注射麻醉,俯卧位固定于手术台上。常规消毒铺单,以T10棘突为中心行后背正中切口,长约3 cm。逐层切开皮肤、皮下组织,剥离竖棘肌并向两侧牵开,显露T9~T11棘突及椎板,切断T10~T11棘间韧带,并去除T11部分棘突,用有齿镊夹持T10棘突并稍向上提起,使T10~T11关节突关节分离,小心咬除T11上关节突外侧缘部分骨质,使T10下关节突下缘出现空隙,以此为突破口向上咬除T10椎板,使T10脊髓充分暴露,可见脊髓背侧正中有一粗大静脉。然后用动脉瘤夹夹持脊髓至其直径的1/2,时间30 s。可见大鼠脊髓后正中的静脉变细,尾巴逐渐卷曲翘起,双后肢出现抽搐,随后双后肢及尾巴松弛瘫软。用生理盐水冲洗伤口,逐层缝合。术后每日观察双后肢及尾巴活动情况,并予以人工膀胱挤尿2~3次,双后肢被动屈伸活动及按摩2~3次,并保持毛发干燥。B组:暴露T10脊髓后不进行钳夹,生理盐水冲洗伤口后缝合,其他处理同A组。C组:麻醉后不进行手术处理。
1.2.2 行为学评分 在损伤后第1周、第2周、第3周、第4周,分别采用双人双盲法进行BBB功能评分[1]。方法简述如下:将造模后大鼠放置于平台上,观察记录其后肢行走及肢体活动能力。评分共三部分:第一部分为0~7分,评判动物后肢各关节活动;第二部分为8~13分,评判后肢的步态及协调功能;第三部分为14~21分,评判运动中爪的精细动作,三项满分为21分。
1.2.3 组织病理学检测 造模后3 d各组分别取动物3只,以10%水合氯醛(0.3 mL/100g)腹腔注射麻醉。仰卧位固定在灌注台上,剪开胸骨,暴露双肺和心脏,经左心室灌注37℃生理盐水250 mL,先快后慢,硬、肝脏触之坚韧后停止。然后将大鼠移至解剖台上,暴露原损伤脊髓处,将包括损伤部位上下各5 mm的脊髓取出,置于4%多聚甲醛溶液中继续后固定冲出体内血液,直至右心耳流出清亮的液体。然后继续灌注4%多聚甲醛300 mL,前100 mL快速灌注,当出现肌颤后改为缓慢灌注,直至大鼠四肢僵6 h。然后将脊髓组织经冲洗、脱水、透明、浸蜡、包埋、制成5μm厚切片,每10张切片取1张进行常规HE染色。
1.2.4 皮层体感诱发电位 分别于术后第1周、第4周,检测大鼠皮层体感诱发电位(cortical somato-sensory evoked potential,CSEP)(Keypoint-4 肌电图/诱发电位仪,Medtronic 公司,美国)。方法简述如下:用8%硫化钠溶液将大鼠双后肢退毛,10%水合氯醛(0.3 mL/100g)腹腔麻醉,再用0.5寸的针灸针于大鼠双眼外眦连线的中点向后5 mm处穿刺颅骨作为记录电极;左耳另穿一针灸针作为参考电极;接地电极置于对侧后肢;用同心圆针电极于大鼠坐骨神经处作为刺激极。给予直流方波电脉冲刺激,以2 Hz,0.2 ms方波刺激,叠加100~200次进行皮层体感诱发电位检测。多道记录对比,至少3道以上重复性好方可作为记录保存。
2 结果
2.1 BBB 评分
B组术后第1天后肢出现短暂性活动迟缓,第2天功能明显恢复,1周后功能恢复正常,评分20分。A组在造模后第1天出现精神轻度萎靡,腹壁贴地,双后肢处于完全伸直位,无活动迹象,出现尿滁留,BBB评分为0。术后第1周内未见明显功能恢复,2周排尿反射逐渐恢复,双后肢功能开始缓慢恢复,第4周时评分为5分,与假手术组、正常对照组相差显著(P<0.05),假手术组与正常对照组1周后对比未见差异。A组内动物之间BBB评分无显著性差异(P>0.05)。
2.2 神经电生理检测
CSEP检测过程中,刺激大鼠一侧坐骨神经,在对侧相当于后肢皮层感觉区可记录到稳定的CSEP波形。常见的CSEP波形是由正向-负向-正向即P1、N1、P2波形组成,部分大鼠可记录另一负向波N2波(图1a)。检测结果显示:A组损伤后第一周大鼠的潜伏期无限延长,基本无法引出CSEP波(图1b),组内动物的CSEP具有相同的表现特点。而B、C组无明显差异,表现为正常的CSEP。A、B组内CSEP有显著性差异(P<0.05),A组内动物之间CSEP无显者差异(P>0.05),见表1。
表1 各组CSEP检测结果(±s,n=9)

表1 各组CSEP检测结果(±s,n=9)
*:与 A 组比较,P <0.05;﹟:与 B 组比较,P >0.05
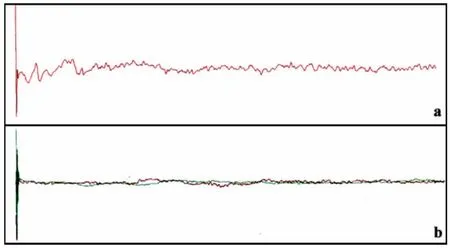
图1 大鼠CSEP图
2.3 脊髓组织病理学检测
大体观察:原钳夹部位脊髓周径较头尾两端小,中央静脉可见血栓。倒置显微镜下观察:B、C组大鼠脊髓灰白质组织结构完整,神经细胞形态正常、尼氏体清晰及细胞膜完整,白质内神经纤维排列整齐,细胞间基质均匀(图2a、b)。A组动物的脊髓组织学表现一致,损伤区灰白质界限不清,中央灰质出现大面积出血,尼氏体消失,白质周围细胞肿胀、空泡变性,部分细胞胞核固缩,并有大量炎性细胞和巨噬细胞浸润(图2c)。
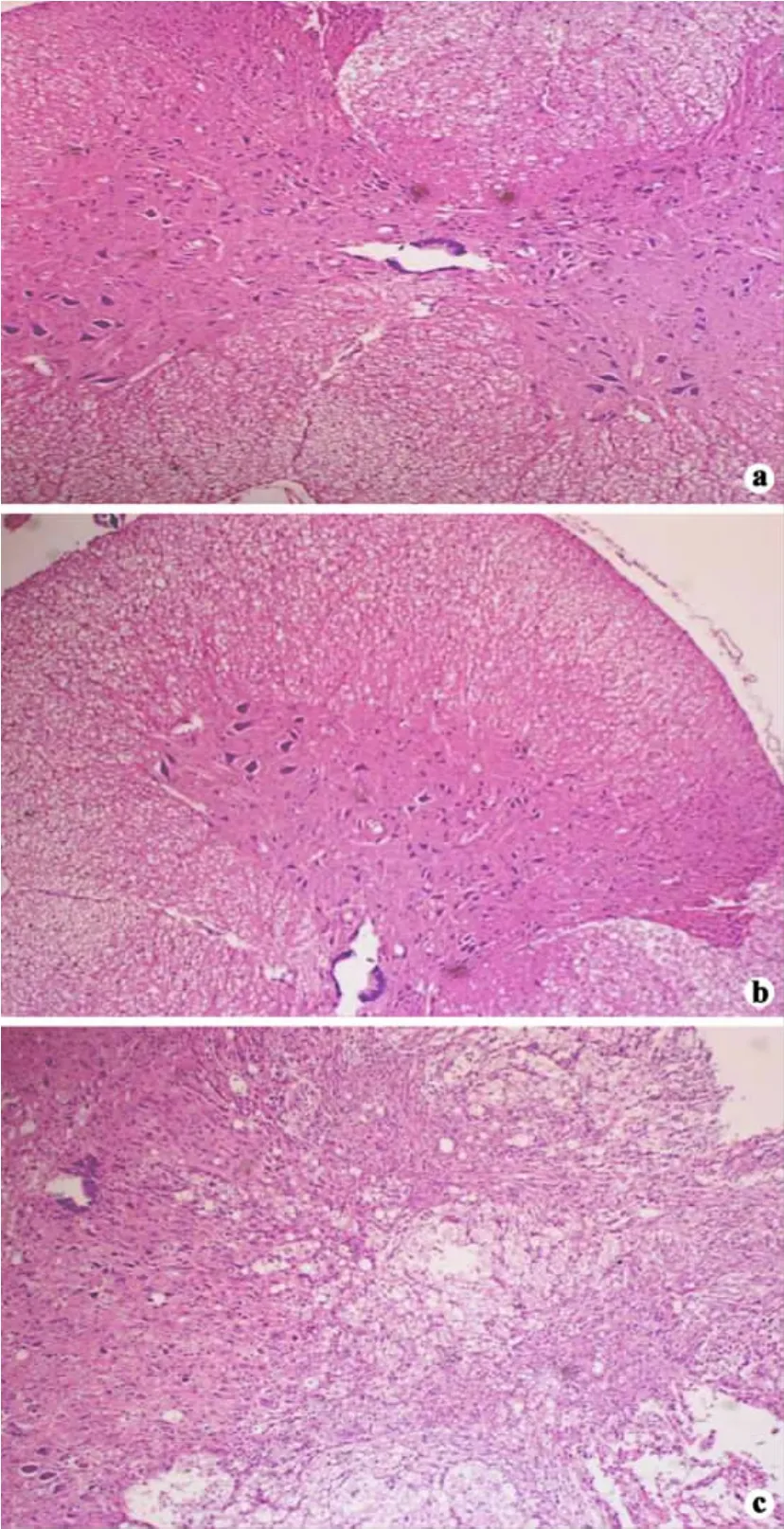
图2 大鼠脊髓HE染色
3 讨论
合理的SCI模型是开展研究的前提,理想的动物模型制作方法应具有以下特点[2]:①制作的SCI模型与临床相近;②对SCI模型制作的各关键步骤客观化、定量化;③制作的动物模型结果一致性高;④压迫力度、压迫时间可自行控制,用同一方法不同的压迫作用于动物脊髓同一部位产生不同程度的脊髓损伤,压迫程度大小与脊髓损伤程度成线性关系,以便进一步施加处理因素;⑤操作简单,即所用设备要求不高,操作不繁琐,便于快速大批制作;⑥经济实用。
目前常见的有脊髓撞击损伤、脊髓缺血再灌注损伤、脊髓切割及吸除损伤、静压脊髓挫伤、气囊压迫、光化学诱导、牵拉等模型。各种模型各有其优缺点,适用的研究方向也各不相同,如:脊髓撞击损伤模型通过调整重物的质量和高度来复制不同程度、不同类型的脊髓损伤模型[3];脊髓缺血再灌注损伤模型用于脊髓继发损伤程度和损伤机制的研究;切割模型及吸除模型将脊髓全部或部分切断,可用于解剖学评价是否有轴突再生[4-5];牵拉性SCI通过暴露脊髓,用特殊牵拉装置牵拉脊髓而造成损伤,多用于医源性SCI的致伤条件和受伤机制的研究[6];光化学诱导SCI是通过注射光增敏剂,然后以激光照射脊髓拟损伤部位,从而造成脊髓损伤,该模型可继发脊髓空洞,从而模拟外伤后脊髓空洞症[7]等。但这些动物模型仍无法模拟临床上脊柱损伤后骨折碎片急性移位对脊髓挤压造成的损伤,因而本课题组对此开展研究。
本实验利用动脉瘤夹钳夹SD大鼠T10脊髓,通过BBB评分、皮层体感诱发电位(CSEP)及组织学检测表明,建立的动物模型能保持硬脊膜的完整性,且脊髓损伤后的解剖结构与神经功能的变化与挫伤型非常相似,接近于日常生活中人体脊髓损伤的类型。SCI组与假手术组、正常对照组均有明显差异,组内动物无显著性差异,表明本动物模型具有良好的可行性及重复性好,且经济实用,可用于脊髓损伤的研究。
[1] Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J].Exp Neurol,1996,139(2):244 -256.
[2] 纪江峰,冯世庆.脊髓损伤动物模型研究进展[J].中华实验外科杂志,2006,23(9):1151 -1152.
[3] Allen AR,Marcy GE,Yu JK.The continuous and concurrent use of streptomycin,para-aminosalicylic acid,isoniazid plus early surgery in the treatment of tuberculosis[J].Dis Chest,1954,26(1):41 - 46.
[4] Pu Y,Guo QS,Wang AM,et al.Repair of acutely injured spinal cord through constructing tissue-engineered neural complex in adult rats[J].Chin JTraumatol,2007,10(3):171 -176.
[5] 田代实,王 伟,徐运兰,等.细胞周期素依赖性激酶抑制剂olomoucine对大鼠脊髓损伤后轴突再生微环境的影响及其意义[J].中华医学杂志,2006,86(13):901 -905.
[6] Dolan EJ,Transfeldt EE,Tator CH,et al.The effect of spinal distraction on regional spinal cord blood flow in cats[J].J Neurosurg,1980,53(6):756-764.
[7] Bunge MB,Holets VR,Bates ML,et al.Characterization of photochemically induced spinal cord injury in the rat by light and electron microscopy[J].Exp Neurol,1994,127(1):76 -93.
