水通道蛋白1在结直肠癌中的表达及其与临床病理的相关性研究
2012-07-07中国医科大学附属第四医院急诊科沈阳110032王萌炜
中国医科大学附属第四医院急诊科 (沈阳110032) 王萌炜 贾 浩 吴 伟
水通道蛋白(aquaporin,AQP)属于庞大的跨膜通道蛋白家族,于1988首次发现,到目前共发现14个家族成员[1]。AQPs的主要功能是调控细胞内水的进出,使 细 胞 处 于 稳 定 的 环 境。 最 近 研 究 发 现[2,3],AQP1在乳腺癌、鼻咽癌、卵巢癌、食管癌等组织中呈高表达,并且与肿瘤的发生、发展密切相关。为此,本研究采用免疫组织化学方法对81例结直肠癌标本及其癌旁正常结直肠组织中AQP1进行检测,现报告如下。
对象与方法
1 一般资料 选择2010年1月至2012年1月在我院医院病理科确诊为结直肠癌和癌旁正常结直肠组织各81例。结直肠癌患者男45例、女36例;年龄32~76岁,中位年龄54岁;Dukes分期:A期20例、B期24例、C期22例、D期15例;细胞分化程度;高分化27例、中分化42例、低分化12例;无淋巴结转移44例、淋巴结转移37例。所有患者手术前均未进行任何治疗。
2 试 剂 鼠抗人AQP1单克隆抗体购自美国ABCam公司,SP免疫组化试剂盒购于北京中杉金桥生物技术开发公司,DAB显色液为Maixin产品,购自购自福州迈新生物公司。
3 免疫组织化学方法 切片经脱蜡、脱水后,EDTA抗原修复,滴加3~5滴过氧化氢水,阻断内源性过氧化物酶活性,加100μl一抗4℃过夜后,PBS代替一抗作为阴性对照,顺序滴加适量的聚合物增强剂及酶标二抗,用新鲜配制的DAB溶液显色。免疫组化结果在高倍镜下随机选择具有代表性的10个视野,每个区域观察100个肿瘤细胞,以胞膜或胞浆有棕黄色染色者为阳性细胞,阳性细胞比例>30%为高表达,<30%为低表达。
4 统计学方法 数据统计分析软件采用SPSS13.0,组间北京采用χ2检验。
结 果
1 AQP1在结直肠癌及癌旁正常结直肠组织中的表达:结直肠癌组织AQP1的高表达率明显高于癌旁正常结直肠组织(P<0.05),见表1。
2 AQP1与结直肠癌Dukes分期的关系:结直肠癌组织AQP1的高表达率随分期的增加不断升高,差异有统计学意义(P<0.05),见表2。

表1 AQP1在结直肠癌及癌旁正常结直肠组织中的表达

表2 AQP1与结直肠癌Dukes分期的关系
3 AQP1与结直肠癌细胞分化程度的关系:结直肠癌组织AQP1的高表达与细胞分化程度无明显相关性,差异无统计学意义(P>0.05),见表3。

表3 AQP1与结直肠癌细胞分化程度的关系
4 AQP1与结直肠癌淋巴结转移的关系:结直肠癌组织淋巴结转移者AQP1的高表达率明显高于无淋巴结转移者,差异有统计学意义(P<0.05),见表4。
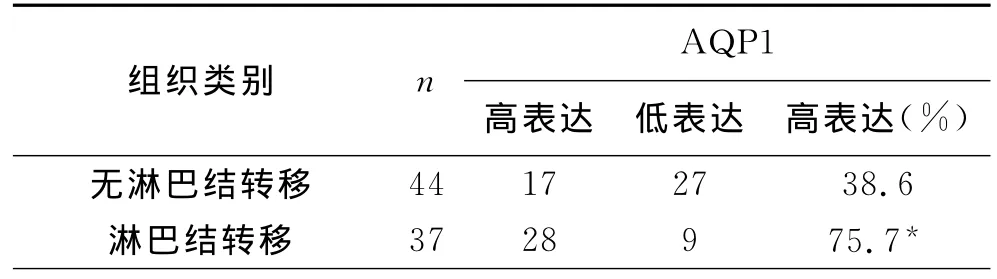
表4 AQP1与结直肠癌淋巴结转移的关系
讨 论
AQPs是一组糖蛋白,一级结构为跨越细胞膜6次的单肤链,含有2个胞内环和3个胞外环,其氨基和梭基末端位于细胞内,B环和E环上的天冬酞胺-哺氨酸-丙氨酸基元的同源性最高,是AQPs家族成员的特征性结构[4]。AQPs广泛分布于机体内,同一脏器可存在多种AQPs,而同一种AQP也可分布于多个脏器,多数选择性分布在与体液有关的上皮细胞和协同跨细胞转运的内皮细胞中,以满足各组织和细胞的需求[5]。AQPs的调节主要分为两种[6]:一种是通过调节AQPs活性,磷酸化为cAMP依赖性,激活腺苷酸环化酶,活化蛋白激酶,从而催化AQPs上的丝氨酸磷酸化,从而增加膜对水的通透性;二是通过糖皮质激素、皮生长因子,肿瘤坏死因子α等改变细胞上AQPs的含量来调节跨膜水流动。
近年来研究发现[7],AQPs表达或功能改变不仅可对水分子的传输产生影响,而且还对细胞的生命活动至关重要。AQP1是第1个被鉴定出来的AQP,几乎遍及全身各组织,对于水分迅速进入血管和淋巴管床,调控血管体积的流体静压和细胞间液体量与胶体膨胀压间的平衡[8]。2010年李琦等[9]收集30例鼻咽部活检标本,分别采用免疫组织化学及实时荧光定量PCR检测组织中AQP1的表达,并与VEGF的表达进行相关性分析,发现肿瘤组织中AQP1、VEGF的表达强于癌旁正常组织,且两者存在一定相关性,推测AQP1在鼻咽癌中可能通过VEGF参与血管的生成,促进肿瘤生长、转移。2012年毛春蓉等[10]采用免疫组织化学方法检测上皮性卵巢良性、交界性、恶性肿瘤中AQP1的表达,发现AQP1表达明显高于良性肿瘤者,卵巢癌患者中有腹水(尤其是腹水量≥1000ml)和淋巴结转移者AQP1的表达明显高于无腹水者,提示腹膜组织上AQP1的高表达与肿瘤盆腔扩散和腹水生成有关。张红旭等[11]研究发现,通过siRNA抑制AQP1的表达,发现AQP1能够明显降低肿瘤血管生成和转移,推测AQP1与肿瘤血管通透性增加具有密切关系,能够促进肿瘤血管生成,增强肿瘤的侵袭能力。Zahn等[12]应用实时逆转录聚合酶链反应、DNA微点阵分析、免疫组化法检测溃疡性结肠炎患者末端回肠和横结肠粘膜AQPs的表达,发现横结肠AQP1表达上升,提示AQPs在溃疡性结肠炎患者结肠粘膜上皮细胞过度表达,引起脱水和肠壁附着粘液层的高粘度,最终破坏粘液屏障和肠腔内共生细菌持续攻击粘膜。2012年赵子伟等[13]检测55例结直肠癌组织及其对照的20例癌旁组织中的AQP1表达,发现AQP1能够诱发的局部组织缺氧会促进HIF-1α的局部表达,促进肿瘤的转移。本研究结果显示,结直肠癌组织AQP1的高表达率明显高于癌旁正常结直肠组织,并且AQP1的表达与临床分期和淋巴结转移呈显著相关性。
[1] 缪 睿,李昌煜.水通道蛋白-依赖性细胞迁移的研究进展[J].中国药理学通报,2011,27(5):601-605.
[2] 刘国斌,邹祖圣.水通道蛋白1与肿瘤的研究现状[J].陕西医学杂志,2010,39(7):878-880.
[3] 张 红,李真珍,陈奎生,等.水通道蛋白1在食管癌中的表达及其与肿瘤转移之间的关系[J].临床荟萃,2008,23(16):1157-1160.
[4] 殷铁军,于世英.乳腺肿瘤组织AQP1表达及其临床意义[J].中华肿瘤防治杂志,2009,16(12):922-924.
[5] 桂治府,邓龙颖,王建平,等.水通道蛋白4对结肠癌细胞迁移能力的影响[J].南京医科大学学报(自然科学版),2012,32(3):315-319.
[6] Jiang Y.Aquaporin-1activity of plasma membrane affects HT20colon cancer cell migration[J].IUBMB Life,2009,61(10):1001-1009.
[7] Nico B,Ribatti D.Aquaporins in tumor growth and angiogenesis[J].Cancer Lett,2010,294(2):135-138.
[8] Takenaga K.Angiogenic signaling aberrantly induced by tumor hypoxia[J].Front Biosci,2011,16:31-48.
[9] 李 琦,张 威,张 宝.鼻咽癌中水通道蛋白1表达与血管生成能力的相关性研究[J].临床耳鼻咽喉头颈外科杂志,2010,24(24):1115-1118.
[10] 毛春蓉,仲建新,练 云,等.水通道蛋白在卵巢上皮癌中的表达及意义[J].江苏医药,2012,38(4):412-415.
[11] 张红旭,张明昌,陈 宏.RNA干扰抑制水通道蛋白l对血管内皮细胞迁移影响的研究[J].中华眼科杂志,2008,44(8):741-744.
[12] Zahn A,Moehle C,Langmann T,et al.Aquaporin-8 expression is reduced in ileum and induced in colon of patients with ulcerative colitis[J].Worid J Gasortenetorl,2007,13(11):1687-1695.
[13] 赵子伟,闫兆鹏,殷红专,等.水通道蛋白1与缺氧诱导因子1在结直肠癌中的表达及与肿瘤转移之间的关系[J].中国医学工程,2012,20(1):14-16.
