拟南芥类锌指基因AT3G02790/AT5G16470纯合双突变的筛选及其表型分析1)
2012-07-02郑唐春施晓文
郑唐春 施晓文
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)(吉林省林业勘察设计研究院)
臧丽娜 朱银凤 王亚军 曲冠证
(林木遗传育种国家重点实验室(东北林业大学))
锌指基因是一类广泛研究的抗逆相关基因,广泛分布在动物、植物和微生物中[1]。锌指蛋白的共同特征是蛋白质通过与Zn2+的结合,使自身折叠成指状的多肽结构。锌指蛋白通过与靶分子DNA、RNA、DNA-RNA的序列特异性结合,以及与自身或其它锌指蛋白的结合,在转录和翻译水平上调控基因的表达水平[2-3]。目前,利用反向遗传学的方法探索基因的表达规律,研究基因功能的报道越来越多。拟南芥AT3G02790和AT5G16470基因被归属为锌指基因家族,CLUSTALW程序分析结果表明,其核酸序列相似性达到81%,这两个同源基因可能参与拟南芥植株的生长过程。本文以拟南芥AT3G02790和AT5G16470纯合单突变株为亲本(均为T-DNA插入突变体),采用人工杂交技术获得杂合子后,根据基因分离定律,结合PCR检测技术,经多轮PCR检测后获得纯合双突变株。并初步分析了纯合双突变株的表型,为下一步反向遗传学探究该类锌指基因功能提供试验材料,同时也表明用杂交技术获得拟南芥多基因突变体是可行的。
1 材料与方法
1.1 试验材料
材料为从拟南芥生物资源中心(Arabidopsis Biological Resource Centre,ABRC)购买的编号为CS-851718和SALK-091992拟南芥种子。通过筛选与扩繁获得AT3G02790和AT5G16470纯合单突变的种子(原种为Columbia-0型)。rTaq酶、DNA marker、SYBR Premix EX TaqⅡ等PCR相关试剂购自TaKaRa公司(中国大连),EasyPure Plant RNA Kit购自全式金公司,其它试验试剂均为国产或进口分析纯。
1.2 拟南芥纯合单突变的验证
种子置于湿润滤纸上4℃春化处理3~4 d。用蘸湿的竹签沾取单粒种子点播于经高温灭菌的培养基质(V(营养土)∶V(蛭石)∶V(珍珠岩)=3∶1∶1)中,每株拟南芥约占3 cm×3 cm空间即可。放入生长室(22~23℃)中,相对湿度60% ~80%,每天16 h光照/8 h黑暗,光强约150 μmol/(m2·s)。3~4 d即可出芽。
半个月后拟南芥莲座叶富集,摘取几株突变株的莲座叶用CTAB法[4]提取拟南芥总 DNA。以两对引物:pBI121-Kan-F/pBI121-Kan-R;pDs-Lox-Hyg-F/pDs-Lox-Hyg-R(表 1)对单突变分别进行验证。PCR反应体系:拟南芥基因组DNA 1 μL;10×PCR Buffer 2.5 μL;dNTP(10 mmol/L)2 μL;Primer-F(10 μmol/L)2 μL;Primer-R(10 μmol/L)2 μL;rTaq DNA 聚合酶(5 U/μL)0.25 μL,加 ddH2O 至终体积25 μL。反应程序94 ℃ 4 min,94 ℃ 30 s,55 ℃30 s,72℃ 1 min,共35个循环;72℃ 7 min延伸。PCR结束后取3 μL反应产物进行1%琼脂糖凝胶电泳分析。
1.3 拟南芥纯合双突变体的筛选
1.3.1 拟南芥的人工杂交
选取检测过纯合单突变的植株,待亲本植株开花后,用镊子将多余的花蕾移除,一般只保留最佳的花蕾5~6个。将花蕾(杂交母本)固定在解剖镜视野的正中央,用解剖纸轻轻压住花蕾,用镊子除去母本的未开花的全部萼片、花瓣和雄蕊。第二天上午10:00左右从杂交父本上用镊子摘取花药,涂抹在柱头上,授以父本的花粉,做好标记。通常柱头授粉10 h后柱头毛开始萎蔫。3 d后种荚即伸长,据此判定杂交成功与否。杂交成功后,将母本植株的其它花蕾除去,杂交的种荚变黄时,收获F1代种子。
1.3.2 拟南芥杂合体植株的验证
种植收获的F1代种子,用CTAB法提取拟南芥总DNA,根据1.2中验证单突变的引物及其反应体系的方法来验证F1代的基因型。对AT3G02790基因验证的PCR称为PCR1,对AT5G16470基因验证的PCR称为PCR2,如果两轮PCR都能获得目的条带,则收获验证后的杂合子植株的F2代种子。
1.3.3 拟南芥纯合双突变植株的筛选
种植收获的F2代种子,随机选择120株杂合子栽种,用CTAB法提取拟南芥总DNA。用两对引物:T-3-F/T-3-R;T-5-F/T-5-R(表 1)对杂合子分别进行验证。对获得的杂合子植株,先验证AT3G02790基因纯合体的PCR称为PCR3;对筛选出来的含AT3G02790基因纯合体的植株再验证AT5G16470基因纯合体的PCR称为PCR4。PCR反应体系:拟南芥基因组 DNA 1 μL;10×PCR Buffer 2.5 μL;dNTP(10 mmol/L)2 μL;Primer-F(10 μmol/L)2 μL;Primer-R(10 μmol/L)2 μL;rTaq DNA 聚合酶(5 U/μL)0.25 μL,加 ddH2O 至终体积 25 μL。反应程序94℃预变性 4 min;94℃变性 30 s,52℃(AT3G02790)或46℃(AT5G16470)退火30 s,72 ℃延伸1 min,重复35个循环;72℃延伸7 min。PCR结束后取3 μL反应产物进行1%琼脂糖凝胶电泳分析。
1.4 拟南芥AT3G02790/AT5G16470基因不同胁迫下的表达水平检测
野生型拟南芥栽种45 d后,分别进行如下处理:去离子水(Distilled Water),300 mmol/L甘露醇,150 mmol/L NaCl,10 mmol/L H2O2,100 μmol/L ABA(abscisic acid)溶液进行浇灌处理及低温(4℃)处理,分别处理 0、1、3、6、12、24 h 后,取适量拟南芥叶片用液氮冷冻处理并于-80℃下存放。用EasyPure Plant RNA Kit试剂盒提取植株的总RNA,检测纯度和浓度后,以0.5 μg总RNA为起始材料,采用PrimeScript TM RT reagent Kit试剂盒进行cDNA合成。将合成的第一链cDNA加去离子水稀释10倍,用于定量RT-PCR反应模板。用两对引物AT3G-F/AT3G-R、AT5G-F/AT5G-R进行实时荧光定量RTPCR检验。反应体系为:10 μL 2×SYBR premix Ex Taq、引物 Primer-F(10 μmol/L)、Primer-R(10 μmol/L)各1 μL和2 μL稀释的各样品的模板,加去离子水补足20 μL。PCR反应在OPTIONⅡ荧光定量PCR仪上完成。反应条件为:94℃预变性30 s;94℃变性12 s;57℃退火30 s;72℃延伸30 s;78.5℃读板1 s,45次循环。用Actin基因(AT3G46520)作为内参,内参引物:Actin-F/Actin-R(表1)。用2-△△Ct方法进行基因的相对定量分析[5]。

表1 PCR反应引物汇总
1.5 拟南芥纯合双突变株的胁迫试验
将筛选出来的双突变株收获种子后,以野生型种子为对照。消毒后点种到不作处理的1/2MS、含有150 mmol/L NaCl或300 mmol/L甘露醇的1/2MS培养基上,观察种子的萌发情况和幼苗长势。5 d后,再将未胁迫处理的幼苗转移到1/2MS、含有150 mmol/L NaCl或300 mmol/L甘露醇的1/2MS培养基上,观察突变株与野生型的表型差异。
2 结果与分析
2.1 拟南芥AT3G02790/AT5G16470基因序列分析
利用 NCBI数据库中的 blastp程序发现AT3G02790基因和AT5G16470基因具有高度的相似性,一致性为81%(图1,A)。在拟南芥中,这两个基因被划为C2H2型锌指基因。但通过对Ex-PASy进行Pfam表明,这两个基因都不具备锌指蛋白氨基酸序列的保守区域,这说明AT3G02790基因和AT5G16470基因并不属于锌指类基因,而是一种功能未知的基因。
通过PCR检测获得纯合双突变株,根据Tair(The Arabidopsis Information Resource)网站推断的TDNA插入位置,结合RT-PCR检测,得知T-DNA插入位置均在启动子区域(图1,B)。纯合突变体植株中AT3G02790/AT5G16470基因的表达水平显著降低(图1,C)。

图1 拟南芥AT3G02790/AT5G16470基因序列分析
2.1.1 拟南芥单突变植株的验证
将购买的编号为CS-851718和SALK-091992的拟南芥种子种植后提取总DNA,验证是否为突变株,为下一步人工杂交选取父本、母本。因为CS-851718突变株的 T-DNA插入质粒是 pDs-Lox,含有潮霉素抗性基因,SALK-091992突变株的 TDNA插入质粒是proKII,含有卡那抗性基因,所以设计引物(表1)能扩增出潮霉素基因(792 bp)(图2,A)和卡那霉素基因(593 bp)(图2,B)。
2.1.2 拟南芥杂合突变体的筛选
因为AT3G02790/AT5G16470单突变体为纯合体,所以杂交后获得的是两个基因的杂合突变株。将获得的F1代杂交种子种植后,提取单株拟南芥总DNA,用方法1.2中的引物进行PCR反应来检验杂合突变株。经扩增检验,PCR1和PCR2分别能扩增出长度为792 bp和593 bp的条带,说明随机选取的3株F1代植株全部为杂合体(图3)。

图2 拟南芥单突变株的PCR鉴定

图3 F1代杂合子的筛选
2.1.3 拟南芥纯合双突变的筛选
根据T-DNA片段的两端序列设计引物,扩增检验纯合突变株。如果基因未被突变掉或者为杂合体的时候,能够扩增出目的条带。如果为纯合突变株,因为该基因序列编码区外源大片段的插入会阻抑目的基因特异扩增产物的形成,最终导致无法扩增出目的条带。本试验采用的PCR是在确定一个基因(AT3G02790)为纯合突变体的基础上再确定另一个基因(AT5G16470)为纯合突变体。AT3G02790基因两端长度为1000 bp,AT5G16470基因两端的长度为500 bp。经过PCR3反应(图4),120株F2代中 16、17、19、20、21、27、30、32、36、39、40、42、43、44、46、47、52、53、55、57、58、60、61、67、69、70、71、72、78、79、80、84、86、87、90、92、93、94、95、97、98、99、100、101、102、103、104、105、106、107、108、110、114号未扩增出条带,或者条带很淡,而野生型能检测出亮带,说明上述各株可能为AT3G02790基因纯合突变株。然后用PCR4反应验证(图5),纯合单突变中的 27、30、43、70、78、93、94、99、101、103、105、106、107、114号仍未检测出目的条带,说明上述的几株可能是纯合双突变株。

图4 F2代纯合单突变株(AT3G02790)的筛选
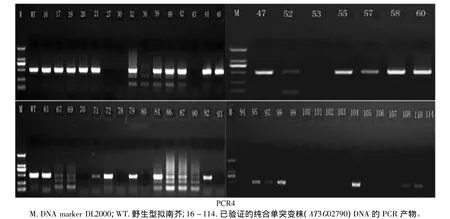
图5 F2代纯合双突变株的筛选
2.2 拟南芥纯合双突变的表型观察
纯合双突变体不同发育时期生长状况的结果显示,与野生型相比,在植物的生长发育过程中没有明显变化(图 6),说明在正常生长条件下,AT3G02790/AT5G16470基因的表达与表型无相关性。
2.3 拟南芥AT3G02790/AT5G16470基因不同胁迫下的表达水平检测
用去离子水、甘露醇、NaCl、H2O2、ABA、低温(4℃)分别处理拟南芥野生型植株,利用荧光定量PCR检测AT3G02790和AT5G16470两个基因的表达水平(表2、表3)。结果显示,去离子水处理也能诱导两个基因的表达。其中,H2O2能显著诱导表达,并于24 h达到最高,说明其受氧化胁迫诱导。ABA同样能显著诱导AT3G02790和AT5G16470表达,于3 h达到最高,并随处理时间的延长而逐渐降低。结果还表明,冷胁迫能显著诱导AT5G16470基因表达,并在6 h达到较高。而甘露醇、NaCl也能在一定程度上促进AT3G02790/AT5G16470的表达,并随处理时间日的延长而逐渐升高。

图6 拟南芥纯合双突变株的表型分析
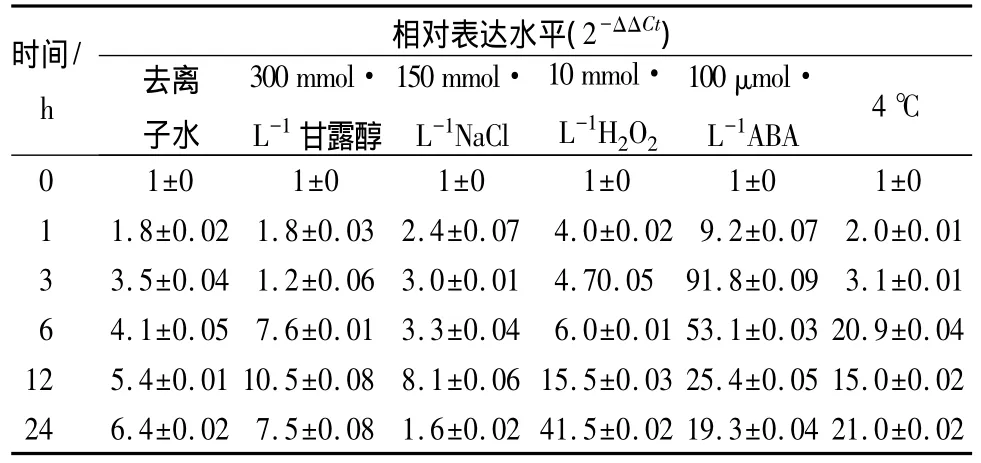
表2 拟南芥AT3G02790基因在不同胁迫下的表达水平

表3 拟南芥AT5G16470基因在不同胁迫下的表达水平
2.4 拟南芥纯合突变株的胁迫试验
纯合突变株在150 mmol/L NaCl、300 mmol/L甘露醇培养基上发芽率比野生型稍低(表4),但在萌发时间和长势情况上未有显著区别(图7)。观察幼苗在含NaCl、甘露醇培养基上侧根的生长状态,只有30#突变株在甘露醇胁迫下根伸长缓慢,但侧根数量增加(图7,I)。
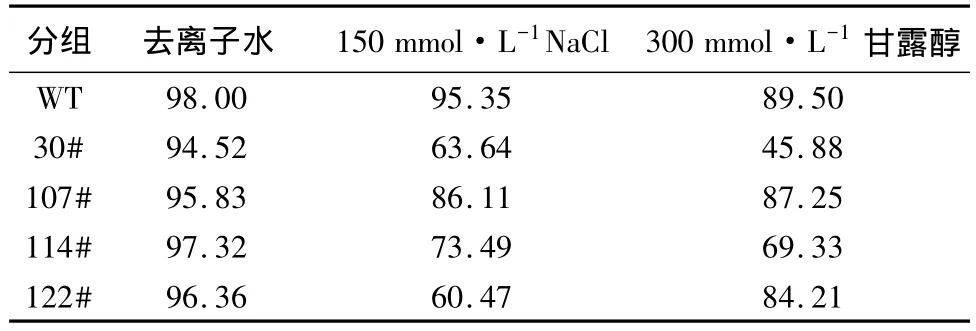
表4 拟南芥纯合双突变株盐、甘露醇胁迫的发芽率 %

图7 拟南芥纯合突变株的胁迫试验结果
3 结论与讨论
拟南芥锌指基因AT3G02790和AT5G16470分别位于(2n=10)第 3条(http://www.arabidopsis.org/servlets/TairObject?id=35782&type=locus)和第 5 条(http://www.arabidopsis.org/servlets/TairObject?id=134268&type=locus)染色体上。AT3G02790和AT5G16470基因在F1自交产生F2的过程中,符合孟德尔的独立分离规律,即在减数分裂形成配子时,位于同源染色体上的每一对等位基因都发生分离,而位于非同源染色体上的非等位基因可以自由组合。F2代群体中共有9种基因型,在F1所产生的16种雌雄配子可能的组合方式中,仅有1种组合的基因型是纯合子,因此,在F2群体中筛选出纯合双突变体的概率为1/16。为获得纯合的双突变体,需要对F2代大量植株提取DNA进行PCR检验,但由于在F2代群体中筛选纯合的双突变体需要做较多的PCR反应体系,因此,在确定一个基因是纯合突变的基础上,需要再验证另一个基因是否为纯合突变,这样不仅能够及时排除非目的植株,而且还可以节省PCR试剂。考虑到PCR方法自身的误差,以及防止出现假阳性结果,每次PCR反应都用野生型做阴性对照[6-8]。虽然经过自由组合后纯合子出现的概率比较小,但拟南芥结种量很大,只要得到一株纯合子,就可通过扩繁得到足够的种子。
通过人工杂交的方法获得了锌指基因AT3G02790/AT5G16470纯合突变株,说明该方法对于获得多基因植株是切实可行。对大量植株进行筛选,经过多轮PCR获得了十几个可能的纯合突变株,结合RT-PCR检测技术,发现两个基因均能微弱地表达。究其原因可能是因为这两个基因的基因序列较短,只有300 bp左右,T-DNA片段未插入到基因的读码框中,而是插入到基因的上游启动子序列内(图1B)。因为上游启动子区域的外源片段插入,在对突变株的DNA进行PCR检测时,延伸合成受阻,故而扩增不出条带;而RT-PCR是对转录水平进行检测,启动子区域受阻后,基因表达受阻碍,检测出突变体表达水平显著降低。
初步研究表明,AT3G02790和AT5G16470基因受甘露醇、NaCl、H2O2、ABA、低温(4 ℃)处理诱导表达,可能这两个基因也参与一些特定的胁迫应答。AT3G02790和AT5G16470基因荧光定量PCR结果和锌指基因的研究结果有些相似。例如:胡椒锌指基因CaAbsi1参与对氧化物、过氧化氢和脱落酸等产生胁迫应答反应[9];菊花锌指蛋白基因DgZFP在种子中可被NaCl、干旱、低温(4℃)处理诱导,Dg-ZFP基因的过量表达还能增强转基因烟草的耐盐性[10];拟南芥锌指基因 AZF1、AZF2、AZF3 在干旱、高盐、低温(4℃)和外源ABA的处理后,表达量显著增高[11]。虽然AT3G02790和AT5G16470纯合突变体的表型结果显示与野生型没有差异,且甘露醇、NaCl胁迫试验结果不显著,但并不能说明AT3G02790、AT5G16470基因与锌指蛋白基因家族间没有相互作用。CLUSTALW程序分析显示,AT3G02790、AT5G16470基因与锌指基因同源性高达81%,AT3G02790和AT5G16470基因在拟南芥中暂时被定义为锌指基因。因为 AT3G02790和AT5G16470基因并没有锌指基因所特有的保守区域,故而推断这两个基因可能是功能未知的基因。AT3G02790/AT5G16470纯合双突变株的获得,为研究这两个基因的未知功能与相互作用提供了良好的试验思路,同时为下一步研究其同源基因过量表达分析奠定了材料基础。
[1]田路明,黄丛林,张秀海,等.逆境相关植物锌指蛋白的研究进展[J].生物技术通报,2005(6):12-16.
[2]Takatsuji H.Zinc-finger transcription factors in plants[J].Cellular and Molecular Life Sciences,1998,54(6):582-596.
[3]Murata T,Hikita K,Kaneda N.Transcriptional activation function of zinc finger protein TIS11 and its negative regulation by phorbol ester[J].Biochemical and Biophysical Research Communications,2000,274(2):526-532.
[4]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19(1):11-15.
[5]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].Methods,2001,25(4):402-408.
[6]吴晓丹,张立军,白雪梅,等.杂交方法获得的拟南芥蔗糖转运蛋白基因SUC3/SUC5双突变体及其PCR鉴定[J].植物生理学通讯,2006,42(6):1073-1076.
[7]吴晓梅,陈明训.人工杂交法获得拟南芥酯酶基因位点AT1G54790/AT2G429双突变体及其PCR鉴定与表型分析[J].湖北农业科学,2010,46(6):1285-1288.
[8]李敏,杨双,阮燕晔,等.拟南芥T-DNA插入突变体atsuc3的PCR 鉴定[J].植物生理学通讯,2006,42(2):91-94.
[9]Seong E S,Wang M H.A novel CaAbsi1 gene induced by earlyabiotic stresses in pepper[J].Biochemistry and Molecular Biology Reports,2008,41(1):86-91.
[10]Liu Qinglin,Xu Kedong,Ma Nan,et al.Isolation and functional characterization of DgZFP:a gene encoding a Cys2/His2-type zinc finger protein in chrysanthemum[J].Molecular Biology Reports,2010,37(2):1137-1142.
[11]Sakamoto H,Maruyama K,Sakuma Y,et al.Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought,cold,and high-salinity stress conditions[J].Plant Physiology,2004,136(1):2734-2746.
