蝇蛆复合发酵蛋白替代鱼粉对彭泽鲫的生长性能和肝脏功能的影响
2012-06-29西南大学动物科技学院水产系郭玉阳陈任孝朱根廷
西南大学动物科技学院水产系 郭玉阳 罗 莉*陈任孝 朱根廷
新希望集团技术研发中心 罗 浩 李洪琴
蝇蛆复合发酵蛋白 (fermented maggot protein,FMP)是将集中孵化的幼蛆搭配其他蛋白原料,在适宜条件下与特定微生物共生培养而得到的一种复合发酵蛋白,该蛋白含有大量游离氨基酸、多肽及其他未知促生长因子。本试验以FMP替代彭泽鲫饲料中鱼粉,研究其对彭泽鲫的生长性能和肝脏功能的影响,以期科学评价FMP的替代效果,为FMP替代鱼粉的应用提供试验依据。
1 材料与方法
1.1 试验设计及日粮 根据鲫鱼的营养参数,以鱼粉、豆粕、小麦、米皮糠等为主要原料配制基础日粮,日粮组成及营养水平见表1(张萍等,2001)。试验日粮以6%、10%和16%的FMP等量替代基础日粮中的鱼粉,相当于替代鱼粉总量的37.5%、62.5%和100%,分别为M-6%组、M-10%组和M-16%组。预处理后的原料粉碎过60目筛,按配方称重后均匀混合,挤压成粒径为1.5 mm,风干成水分含量为11%的颗粒饲料,置于-18℃冰箱保存备用。
1.2 试验鱼与饲养管理 彭泽鲫购自重庆市北碚区歇马渔场,在室内循环水养殖系统中进行养殖试验。挑选体格健壮,体重(9.00±0.50)g的鲫鱼,用基础饲料驯养15 d,待摄食正常后开始正式试验。生长试验分为4个组,每组3个重复,每个重复 50 尾鱼,每天投喂 4 次(8∶00、11∶30、15∶00、18∶30),日投喂量为体重的3% ~5%,根据试验鱼的增重情况,每隔10 d调整一次投饲率。每个试验桶容积330 L(有效体积)。饲养期间水温22~28℃,溶解氧 >8.0 mg/L,氨氮含量 <0.10 mg/L,pH 6.6~7.0,亚硝酸盐<0.1 mg/L。正式试验期56 d。
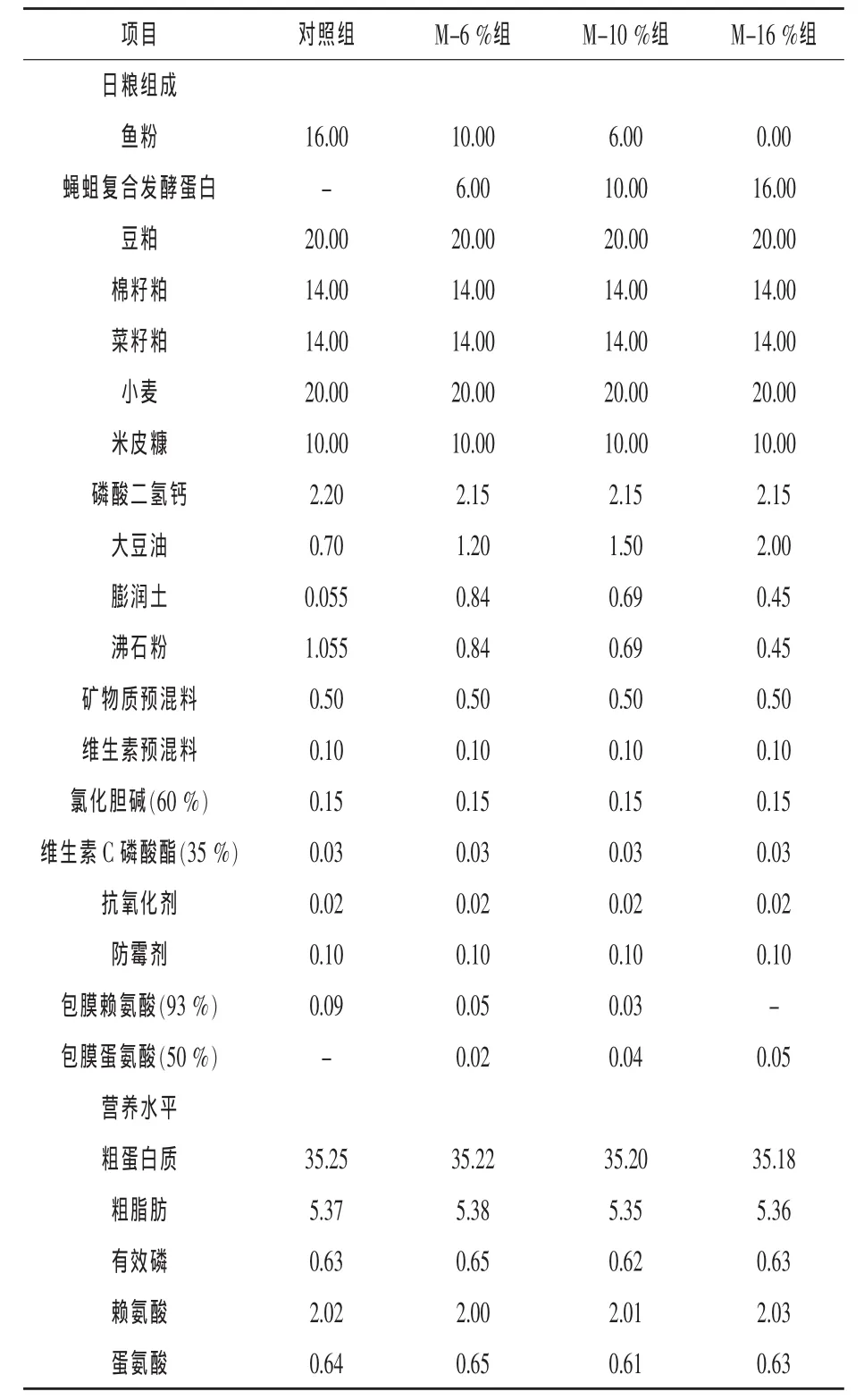
表1 基础日粮组成及营养水平(风干基础)%
1.3 样品采集与制备 试验前取30尾鱼作为初始样本,每组取100 g饲料待测。试验结束,试验鱼禁食24 h,测定每缸鱼的总重,记录饲料投喂量。并从每重复组随机取出15尾鱼,立即于冰盘上解剖,取出肠道和肝脏,分别称重后剪碎,按1∶9(g:mL)加入鱼用生理盐水(4 ℃),迅速转入玻璃匀浆器匀浆(匀浆过程在冰浴环境中进行),将匀浆液离心(4 ℃,3500 r/min)15 min,取上清液即得粗酶液,置-80℃超低温冰箱中冷冻保存,用于肠道和肝脏指标的测定。
1.4 测定指标及测定方法
1.4.1 试验原料和饲料样品的分析 试验原料和饲料样品的水分、粗蛋白质、粗脂肪和粗灰分含量按国际标准方法(AOAC,1995)测定。氨基酸采用酸水解法测定,由于色氨酸在酸水解过程中被破坏,未测定到,所用仪器为日立835-50型氨基酸自动测定分析仪。
1.4.2 生长性能指标
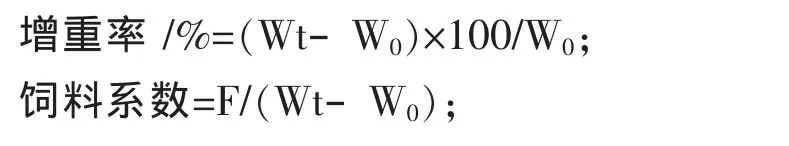
式中,W0为鱼初始尾均重 /g;Wt为鱼终末尾均重 /g;F为平均摄食饲料总量/g。
1.4.3 肠道消化酶活性的测定 蛋白酶活性采用福林-酚法测定(中山大学生物系,1979);淀粉酶活性采用淀粉-碘显色法测定 (上海市医学化验所主编,1979);脂肪酶活性采用聚乙烯醇橄榄油乳化液水解法测定(中山大学生物系,1979)。
1.4.4 肝胰脏常规指标的测定 肝脏常规指标均采用南京建成生物研究所研制的相应试剂盒和752型分光光度计测定。谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性采用赖氏法测定;γ-谷氨酰氨转移酶(γ-GT)和碱性磷酸酶(AKP)活性采用比色法测定;超氧化物歧化酶(SOD)活性采用黄嘌呤氧化酶法测定;丙二醛(MDA)含量采用TBA法测定。
1.5 数据处理 采用SPSS13.0统计软件进行单因子方差分析 (One-way ANOVA),同时进行Duncan’s多重比较,P<0.05为差异显著,结果以“平均值±标准差”表示。
2 结果
2.1 不同比例FMP替代鱼粉对彭泽鲫生长性能的影响 由表2可知,对照组彭泽鲫增重率和饲料利用率均最高,各试验组随替代比例升高呈下降趋势,与对照组相比均差异显著(P<0.05),增重率分别比对照组降低5.88%、10.62%和13.74%,饲料系数分别较对照组提高10%、18.33%和20%。试验鱼成活率均为100%。
2.2 不同比例FMP替代鱼粉对彭泽鲫肠道消化酶活性的影响 由表3可知,FMP的替代提高了彭泽鲫的肠道脂肪酶活性,降低了肠道蛋白酶和淀粉酶活性。其中,M-6%组的肠道脂肪酶活性与对照组差异不显著(P>0.5);其他各组与对照组均差异显著 (P<0.05),M-10%组和M-16%组分别较对照组提高27.77%和39.97%。

表2 FMP替代鱼粉对彭泽鲫生长性能的影响
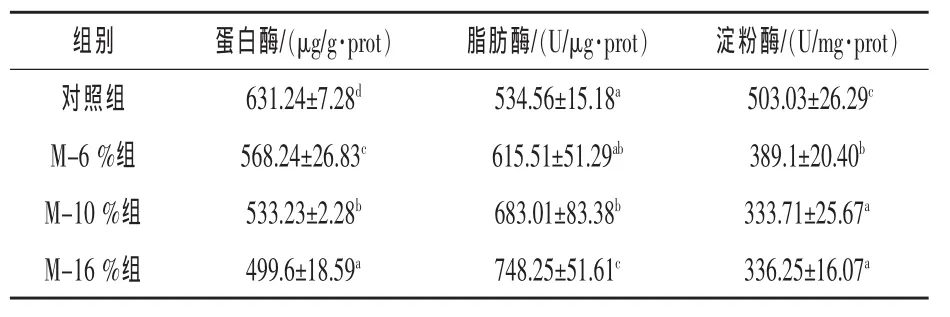
表3 FMP替代鱼粉对彭泽鲫肠道消化酶活性的影响
2.3 不同比例FMP替代鱼粉对彭泽鲫肝脏功能的影响
2.3.1 FMP对彭泽鲫肝脏功能常规指标的影响由表4可知,随FMP替代比例的增加彭泽鲫肝脏中GOT和GPT活性呈下降趋势,各替代组与对照组相比差异显著 (P<0.05),GPT/GOT比值呈下降趋势,但M-6%组与对照组差异不显著(P>0.05)。试验组γ-GT活性均显著低于对照组(P<0.05),且呈下降趋势;AKP活性逐渐降低,各替代组中M-6%组值最高。

表4 FMP替代鱼粉对彭泽鲫肝脏功能指标的影响
2.3.2 FMP对彭泽鲫肝脏抗氧化能力指标的影响 由表5可知,各试验组SOD活性均低于对照组,随着替代比例的增加,替代组肝脏SOD活性逐渐升高,其中M-16%组SOD活性与对照组差异不显著(P>0.05);肝脏MDA含量先升高后降低,各组间差异显著(P<0.05)。
3 讨论

表5 FMP替代鱼粉对彭泽鲫肝脏抗氧化能力的影响
鱼体对蛋白质的利用与氨基酸的种类、含量及平衡有关(刘超等,2002;张满龙和邓理,2002;Tesseraud等,1996)。研究表明,氨基酸平衡能提高动物对蛋白质和氨基酸的利用率,促进动物生长,节约饲料蛋白质资源,减少含氮物质对环境的污染(李桂梅等,2010)。本试验日粮配方的配制,通过补充包膜氨基酸仅平衡了试验日粮的赖氨酸和蛋氨酸含量,而鱼粉是公认的氨基酸平衡性最好的动物蛋白源,作为替代蛋白原的FMP与鱼粉的氨基酸模式相差较大(表6),随着替代鱼粉比例增大,氨基酸不平衡的缺陷越明显,故而彭泽鲫的生长性能逐渐下降。
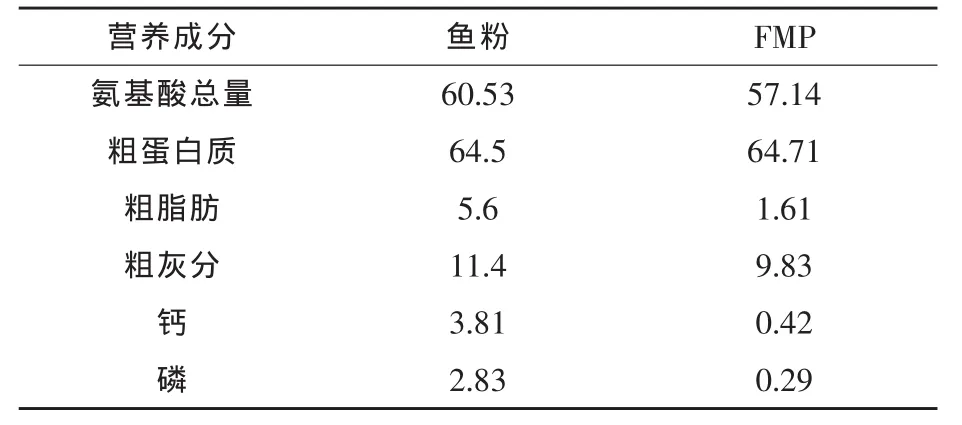
表6 FMP和鱼粉的营养成分比较 %
消化与吸收是鱼类获取营养物质与能量的基本途径,这一过程主要由消化酶对食物进行化学性消化来完成。国内外学者对鳜鱼 (钱国英,1998)、黄鳝(杨代勤等,2004)、胡子鲶(Uys 和Hecht,1987)、鲤(Ragyanszki,1980)研究表明,鱼类摄取的食物对体内消化酶分泌有较大的影响,消化道内存在的食物种类与鱼类消化酶的分泌数量及种类有一定相关性。随着FMP替代鱼粉比例的增加,彭泽鲫的肠道蛋白酶活性和淀粉酶活性下降,可能与FMP在发酵过程中使用了消化率低于鱼粉的其他蛋白原料有关,且其他饼粕类蛋白原料中抗营养因子并没有通过发酵完全去除。脂肪酶活性的升高机制和影响目前尚不清楚,需进一步的研究。
正常情况下机体自由基的产生与清除处于一种动态平衡,当自由基产生过多而清除物质过少时,就会对机体造成氧化损伤(Sies,1997)。 SOD对体内自由基的清除具有重要作用,其含量可以反映机体对自由基的清除能力 (Fattman等,2003);MDA的含量可反映自由基的产生量和生物膜的损伤程度(Traystman等,1991)。本试验中,随着FMP替代鱼粉的比例增加,彭泽鲫肝脏自由基清除能力先下降后升高,这可能与蝇蛆发酵蛋白在发酵中获得的其他有益生长因子,如益生菌、游离氨基酸或功能性小肽等有关 (沈文英等,2011;王炳祥等,2011;王一娟等;2011)。 当 FMP的替代量增加时,日粮中所含的有益生长因子也相应增多,故而表现出肝脏抗氧化能力先下降后升高的现象。
GPT和GOT是机体最重要的两种转氨酶,广泛分布于各组织器官,肝脏是GOT含量最高的组织,肝脏中GPT的含量也很高,仅次于心脏。这两种酶在机体蛋白质和氨基酸代谢中起重要作用,其活性与氨基酸代谢强弱有关(李桂梅等,2010)。γ-GT参与谷胱甘肽循环,生理作用主要是参与蛋白质的合成,并控制组织谷胱甘肽水平,摄取血浆中的谷氨酸以供合成蛋白质之用,其活性的强弱可反应机体蛋白质代谢的强度(王继贵,1996)。本试验中各替代组的肝脏GOT、GPT和γ-GT活性下降表明氨基酸代谢降低,蛋白质分解升高,不利于氮在体内的蓄积,在生产中即表现为体增重下降。
AKP可以催化各种含磷化合物水解,在动物机体的骨化,营养的吸收、转运与利用,解毒体系和免疫反应中发挥作用(孙静秋等,2007;He和Sun,1992)。本试验中彭泽鲫肝脏AKP活性升高后下降,可能是FMP中某些有益生长因子的作用,提高了彭泽鲫代谢及免疫力;也可能是受有毒物质诱导,肝脏内AKP的合成出现生理补偿现象,而随剂量增加,肝脏无法适应,AKP活性随之下降,与一些鱼类的毒性试验结果类似(孔祥会等,2007)。
GPT/GOT比值在临床上可作为评判肝炎病人肝纤维化和肝硬化的一个独立的指标,其比值随肝病病程变长、病程加重而升高(傅淑艳,2002;Sheth等,1998)。本试验中,虽然各检测指标与对照组相比有高有低,但并不能说明彭泽鲫肝脏受一定损伤或有病理变化,其可能是在正常范围内。至于鱼类各项检测指标的参考范围及评价标准尚有待进一步研究。
[1]傅淑艳.肝病患者AST/ALT比值的检测及临床意义[J].浙江临床医学,2002,4(12):942 ~ 943.
[2]孔祥会,刘占才,郭彦玲,等.汞暴露对草鱼器官组织中碱性磷酸酶活性的影响[J].中国水产科学,2007,14(2):270 ~ 275.
[3]刘超,闵育娜,雷海宁,等.饲料中可利用氨基酸研究进展[J].农业大学学报,2002,4:401 ~ 409.
[4]李桂梅,解绶启,雷武,等.异育银鲫幼鱼对饲料中缬氨酸需求量的研究[J].水生生物学报,2010,34(6):1157 ~ 1165.
[5]钱国英.不同驯食方式对鳜鱼胃、肠道消化酶活性的影响[J].浙江农业大学学报,1998,24(2):201 ~ 210.
[6]沈文英,李卫芬,梁权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881 ~ 886.
[7]孙静秋,许燕,张慧绮,等.凡纳对虾体内 ACP、AKP酶的细胞化学定位[J].复旦学报(自然科学版),2007,46(6):947 ~ 951.
[8]上海市医学化验所主编.临床生化检验(上册)[M].上海:科学技术出版社,1979.366~ 368.
[9]王炳祥,顾国生,李鑫雨,等.山羊胎盘小肽的分离及对小鼠抗氧化能力的影响[J].西南农业学报,2011,1:315 ~ 318.
[10]王一娟,何义进,谢俊,等.抗菌肽对河蟹生长、免疫及抗氧化能力的影响[J].江苏农业科学,2011,39(2):340 ~ 343.
[11]王继贵.临床生化检验[M].长沙:湖南科学技术出版社,1996.
[12]杨代勤,严安生,陈芳,等.不同饲料对黄鳝消化酶活性的影响[J].水产学报,2004,27(6):558 ~ 563.
[13]中山大学生物系.生化技术导论[M].北京:人民教育出版社,1979.52~54.
[14]张萍,赵振伦,杨沁芳.鲫营养需求与营养生理的研究进展[J].水利渔业,2001,21(3):9 ~ 11.
[15]张满龙,邓理.氨基酸在鱼类养殖中的作用[J].水利渔业,2002,22(6):25~26.
[16]Fattman C L,Schaefer L M,Oury T D.Extracellular superoxide dismutase in biology and medicine[J].Free Radical Bio Med,2003,35:236 ~ 256.
[17]He H Q,Sun F.Studies on the characteristics of acid and alkaline phosphatase in Chinese shrimp,Penaeus chinensis[J].Oceanoiogia Et Limnoiogia Sinica,1992,23(5):555 ~ 560.
[18]Ragyanszki M.Preliminary investigations on the proteolytic digestive enzymes of carp fry[J].Aquaculture,1980,2:27 ~ 30.
[19]SiesH.Oxidativestress:oxidantsand antioxidants [J].Exp Physiol,1997,82:291 ~ 295.
[20]Sheth S G,Flamm S L,Gordon F D,et al.AST/ALT ratio predicts cirrho-sis in patietns with chronic hepatitis Cvirusinfection[J].Am J Gastroent,1998,93:44 ~ 48.
[21]Tesseraud S,Maaa N,peresson R,et al.Relative responses of protein turnover in three different skeletal muscles to dietary lysine deficiency in chicks[J].Bri poult Sci,1996,37(3):641 ~ 650.
[22]Traystman R J,Kirsch J R,Koehler R C.Oxygen radical mechanisms of brain injury following ischemiaand reperfusion[J].J Appl Physiol,1991,71:1185~1195.
[23]Uys W,Hecht T.Changes in digestive enzyme activities of catfish Claria gariepinus[J].Aquaculture,1987,621:243 ~ 250.
