多菌灵高效降解菌的筛选与降解特性分析1)
2012-06-28李明石李成龙王呈玉王玉军赵兰坡
李明石 曲 迪 李成龙 王呈玉 王玉军 赵兰坡
(吉林农业大学,长春,130118)
多菌灵(Carbendazim)是一种广谱型内吸性、环境激素类化学农药[1],化学名称 N-(2-苯并咪唑基)氨基甲酸甲酯。许多国家用于农业上防治各种作物病害[2],其它内吸性杀菌剂如苯菌灵、苯并咪唑类和托布津类杀菌剂均可在土壤中和作物体中转化为多菌灵而起到药效作用[3]。多菌灵在土壤和水体中化学性质稳定,半衰期较长,长期施用多菌灵对土壤和水体造成污染,同时可以在水果蔬菜等作物中残留,对哺乳动物易导致免疫功能下降和染色体畸变而影响后代繁衍[4-9]。
近年来,随着农业的发展,在设施蔬菜生产过程中,大量的使用有机合成农药——多菌灵,导致多菌灵在设施土壤中有一定的累积,造成了土壤和地下水污染加剧,这不仅影响到设施蔬菜的高产、高效及优质生产,而且影响蔬菜的质量安全,成为设施蔬菜可持续发展的关键制约因素[10]。多菌灵污染场地的生物修复作为多菌灵污染治理的一种易于实现原位修复、经济、环保又有效的重要方法,受到国内外学者的广泛关注。分离筛选高效降解菌是多菌灵污染土壤微生物修复技术中需要解决的关键问题,成为国内外的研究热点。
本实验针对设施蔬菜土壤多菌灵污染比较严重的特点,通过低温条件下富集筛选,从长期施用多菌灵的设施蔬菜土壤中分离到一株高效降解菌Enterobacter sp.D5,并对其降解特性进行分析,以期为多菌灵污染设施蔬菜土壤及水体的生物修复提供实验材料和科学依据。
1 材料与方法
1.1 材料
供试土壤和药剂:供试土壤采自吉林省抚松市某长期施用多菌灵的土壤(0~30 cm);多菌灵标准品(有效成分含量≥98%)由吉林农业大学资源与环境学院农药教研室提供;甲醇(色谱纯)、三氯甲烷(色谱纯)、丙酮(色谱纯)、盐酸(分析纯)、氢氧化钠(分析纯)、无水硫酸钠(分析纯)。
仪器:Eppendorf 5810R低温高速离心机(德国艾本德公司)、GA92-II2DB细胞超声破碎仪(无锡上佳生物科技有限公司)、UV1200型紫外可见分光光度、1100液相色谱仪(美国Agilent公司)、BS224S电子天平、HZ-9211K恒温振荡器。
无机盐培养液:Na2HPO4· 2H2O 8.5 g,KH2PO43.0 g,NaCl 0.5 g,NH4Cl 1.0 g,MgSO4·7H2O 0.5 g,CaCl214.7 mg,CuSO40.4 mg,KI 1.0 mg,MnSO4· H2O 4.0 mg,ZnSO4· 7H2O 4.0 mg,H3BO35.0 mg,H2MoO4·2H2O 1.6 mg,FeCl3·6H2O 2.0 mg,蒸馏水1 000 mL。pH 值7.0 ~7.2、121.3 ℃灭菌25 min。
富集培养基:无菌的无机盐培养液中加入需要量的多菌灵。
分离培养基:无机盐培养液,多菌灵15 g,琼脂18 g。pH 值7.0 ~7.2、121.3 ℃灭菌25 min。
LB培养基:胰化蛋白胨10 g,NaCl 10 g,酵母提取物5 g,琼脂18 g。
1.2 试验方法
1.2.1 多菌灵高效降解菌的富集筛选
将10 g土样加入到100 mL以多菌灵为唯一碳源的富集培养基中,15℃,200 r·min-1摇床培养5 d,取富集的菌悬液10 mL,加入到新鲜的富集培养基中,在相同条件下富集培养5 d,连续富集传代5次,使多菌灵质量浓度依次为 20、40、60、80、100 mg·L-1。经鉴定能降解多菌灵达90%以上的富集液为有活性的富集液。将活性富集液进行梯度稀释涂布LB平板。挑取单菌接种液体富集培养基,通过HPLC分析验证其降解能力。
1.2.2 多菌灵降解菌的鉴定
对分离纯化得到的菌株进行菌体形态观察、生理生化试验。同时将获得的菌株接入LB液体培养基中扩大培养,离心收获菌体,提取菌株RNA。以细菌16 S rRNA通用引物27 f和1 492 r对该菌株基因组进行PCR扩增。PCR扩增条件:95℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,30 个循环;72℃10 min。扩增产物经纯化后送上海生物工程技术服务有限公司测序,用Clustal W对测序结果与GenBank中相关的16 S rRNA序列进行比对,通过MEGA4.0软件对菌株进行系统发育分析,采用邻接法(neighbor-joining)构建系统进化树,用Bootstrap法(1 000次重复)检验。
1.2.3 菌株对多菌灵降解的最佳条件
降解试验基本条件为:在100 mL基础培养基的三角瓶中,以100 mg·L-1多菌灵为唯一碳源,接种量 OD600nm=0.2、20 ℃、pH 值 7.0、200 r·min-1;最佳条件降解试验:通过分别改变降解基本条件中的初始 pH 值(5.0、6.0、7.0、8.0、9.0 和 10.0)、温度(5、10、15、20、25、30 和 35 ℃)、多菌灵添加量(50、100、150、200 和 250 mg·L-1),在其他条件保持不变的情况下,培养12 d,进行单因素条件试验。各单因素设计以不接种和灭活菌为对照,每个处理设3次重复,测定菌株对多菌灵农药的降解量。
1.2.4 最优条件下菌株生长量和多菌灵降解曲线的测定
将菌株置于100 mL含100 mg·L-1多菌灵的无机盐培养基中,于 20 ℃、pH 值 7.0、200 r·min-1摇床培养,分别在 2、4、6、8、10、12 d 测定菌株对多菌灵农药的降解量,同时测定菌株OD600nm生长量,分析菌株生长量与降解量之间的关系。
1.2.5 多菌灵的HPLC检测方法
三波长校正法[11]:配置5 g·L-1(有效成分)的多菌灵标准溶液,按需稀释成相应质量浓度。称取100 μL样品,用稀盐酸(1+11)定容至 10 mL,分别测定其在278、280和290 nm波长处的吸光度,由ΔA=A280-(A278+A290)/2计算出校正吸光度ΔA,并根据标准曲线对样品中的多菌灵含量进行定量分析。
100 mL培养液中加入250 mL三氯甲烷震荡萃取30 min倒入分液漏斗中,再用250 mL三氯甲烷清洗培养瓶后全部倒入分液漏斗中震荡萃取,在10 mL的比色管中加入2 mL萃取液,于60℃恒温水浴中至三氯甲烷完全挥发,用10 mL甲醇定容,待测。色谱柱:C18 柱,25 cm×4.16 mm;柱温为30 ℃;流动相为V(甲醇)∶V(水)=70∶30;流速为0.8 mL·min-1;检测波长为280 nm;进样体积为20 μL。
2 结果与分析
2.1 多菌灵降解菌的筛选和鉴定
以多菌灵为唯一碳源,经过50 d的富集筛选,得到1株多菌灵高效降解菌D5。该菌短杆状,革兰氏染色阴性、无芽胞;纯培养菌落为乳黄色且略透明;其能利用葡萄糖产气,V.P.反应、甲基红反应、吲哚实验、氧化酶、产H2S实验、苯丙氨酸脱氢酶、精氨酸双水解酶及明胶液化反应阴性。应用细菌16 S rDNA通用引物27 f和1492 r有效扩增出1265 bp的片段,将测序结果在GenBank中利用Blast软件进行同源性序列比对,以大肠杆菌为外源构建系统发育树,如图1所示。

图1 根据16 S rRNA部分基因序列构建的菌株D5与相关种属的系统发育树
菌株D5与已报道的Enterobacter属细菌亲缘关系最近,与Blast结果一致。因此,菌株D5在分类学地位上初步确定是归属于肠杆菌属Enterobacter。
目前,国内外关于多菌灵降解菌的报道很少,分离到的多菌灵降解菌有红平红球菌Rhodococcus erythropolis[12-13]和 Rhodococcus qingshengii sp.nov.[14]、罗尔斯通氏菌属 Ralstonia sp.[15]、短小芽孢杆菌 Bacillus pumilus[16]、假单胞菌属 Pseudomonas sp.[17]、木霉 Trichonderma sp.[18]、诺卡氏菌 Nocardioides sp.SG-4G[19]、巴西固氮螺菌 Azospirillum brasilense[20],尚未见关于 Enterobacter菌属降解多菌灵菌株的报道。
<1),且各件产品是否为不合格品相互独立.
2.2 纯培养条件下菌株的降解特性
2.2.1 初始pH值变化对降解能力的影响
为考察培养基的初始pH值对菌株D5降解作用的影响,将菌株D5接种于含100 mg·L-1多菌灵的不同pH缓冲液中,在20℃、200 r·min-1条件下培养12 d。菌株D5在不同pH值条件下的多菌灵的降解率如图2所示。由图2可知,无机盐培养基初始pH值对菌株D5降解多菌灵有较大影响,强酸(pH值5.0)和强碱(pH值10.0)均不利于菌株D5的生长和对多菌灵的降解;菌株D5在pH值6.0~9.0均能生长,而最适生长 pH 值为 6.0~7.0,8 d后的降解率分别为100%和82.34%。

图2 不同初始pH值对多菌灵降解的影响
2.2.2 温度变化对降解能力的影响
温度是影响微生物降解农药等有机污染物的主要环境因素之一。本研究对菌株D5在不同温度下(5、10、15、20、25、30、35 ℃)多菌灵的降解特性进行研究,结果如图3所示。图3结果表明,在5~30℃,菌株D5对多菌灵均具有降解能力;在温度为15和20℃时,菌株D5对多菌灵降解效果好,分别在培养12和8 d时降解率达到100%。菌株D5在温度为5和30℃时,仍具有一定降解效果,培养12 d后降解率分别为24.26%和47.42%;温度为 25℃时,菌株D5对多菌灵的降解效果明显不如20℃,降解率仅为74.38%;当温度超过20℃时,随着温度的升高,降解率逐渐降低。由此可见,菌株D5在10~25℃的低温条件下具有较强的降解活性。
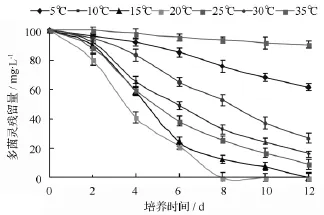
图3 不同温度对多菌灵降解的影响
目前,已经分离的多菌灵降解菌多属于中温菌,最佳降解温度均在25~35℃[12-20],菌株D5在10~20℃的条件下对多菌灵的降解效果明显优于25℃以上的温度,按照Morita的定义属于耐冷菌。因此,菌株D5对北方多菌灵污染土壤的低温生物修复与其它菌株相比具有很大的优势。
2.2.3 菌株D5对不同质量浓度多菌灵降解效果
由图4可见,在pH值7.0、20℃条件下培养时,菌株D5对多菌灵的耐受质量浓度高于250 mg·L-1,完全降解初始质量浓度为 50、100、150、200 mg·L-1的多菌灵所需的时间分别为4、8、10、12 d。由此可见,多菌灵的初始质量浓度对菌株D5的降解率有较大的影响,在12 d内多菌灵的初始质量浓度越高,降解率越低。
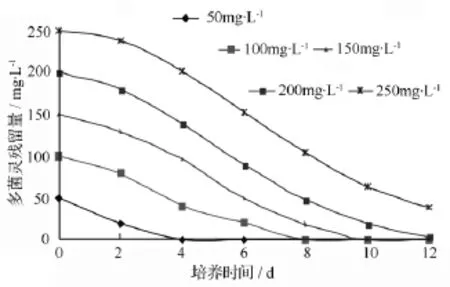
图4 菌株D5对不同质量浓度多菌灵的降解效果
2.2.4 营养基质对菌株降解多菌灵的影响
在处理液中加入外源氮素营养基质可以显著提高菌株对多菌灵的降解效果,见图5。随着外源氮素基质的加入,菌株D5对多菌灵的降解量明显增加,以加入蛋白胨时菌株D5对多菌灵的降解量最大,在6 d后达到100%,菌体生长量的增加可能是在外源氮素基质存在条件下多菌灵的降解速率加快的原因,并且外源氮素基质的加入没有抑制多菌灵的降解。从图5结果对比来看,有机氮源的加入促降解作用明显优于有机碳源,且菌株D5在利用外源碳源营养基质的同时不能利用多菌灵作为碳源,菌体的量的增加较以多菌灵为唯一碳源的多,随着外源碳源基质的消耗,多菌灵的降解量逐渐增多。
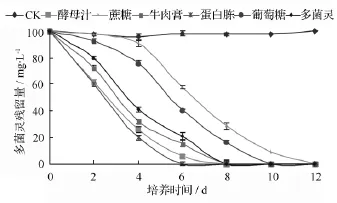
图5 不同营养基质对菌株D5降解率的影响
这表明,在使用菌株D5进行多菌灵污染土壤修复时,外加有机氮源可以促进多菌灵的生物降解,这与朱凤晓等[21]添加少量氮源可以促进复合菌对多菌灵的降解的研究结果是一致的,但与张丽珍等[16]关于尿素会抑制短小芽胞杆菌NY97-1降解多菌灵能力的研究结果相反。
2.2.5 菌株生长与降解多菌灵的关系
如图6所示,菌株D5在20℃,pH值7.0的最适生长条件下,能以多菌灵为唯一碳源生长,菌株D5的生长曲线和多菌灵的降解曲线相吻合。该图也表明,菌株生长没有明显的滞后期,培养2 d后进入对数生长期,随着细菌细胞数量的增多,多菌灵的降解量也逐渐增大,当培养8 d时多菌灵的降解率达到100%,说明该菌株在20℃、pH值7.0的生长条件下,能较快适应环境并利用多菌灵作为生长基质。
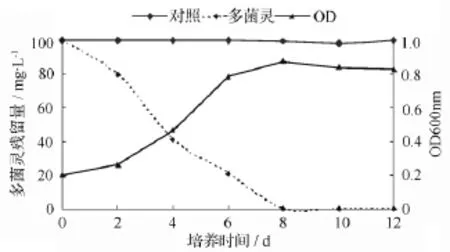
图6 最优条件下菌株D5生长和多菌灵降解情况
3 结论
综上所述,从长期施用多菌灵土壤中分离得到1株耐低温的多菌灵高效降解菌Enterobacter sp.D5具有较好的多菌灵降解能力,菌株D5能以多菌灵为唯一碳源生长,在15℃、pH值7.0的最适生长条件下12 d可完全降解100 mg·L-1多菌灵,外加氮源可以有效促进多菌灵的生物降解,这为该菌株用于多菌灵污染土壤的低温生物修复提供了良好的材料和理论依据。
致谢:多菌灵标样由吉林农业大学逯忠斌教授提供;马秀兰副教授和抚松市环境监测站对样品采集给予的帮助,在此表示感谢。
[1]马承铸,顾真荣.环境激素类化学农药污染及其控制[J].上海农业学报,2003,19(4):98-103.
[2]Chen Yu,Zhou Mingguo.Characterization of fusarium graminearum isolates resistant to both carbendazim and a new fungicide JS399-19[J].Phytopathology,2009,99(4):441-446.
[3]Cuppen J G M,P J Van Den Brink,E Camps,et al.Impact of the fungicide carbendazim in freshwater microcosms water quality,breakdown of particulate organic matter and responses of macroinvertebrates[J].Aquat Toxicol,2000,48(2/3):233-250.
[4]Arora S,Mukherjee I,T P Trivedi.Determination of pesticid residue in soil,water and grain from IPM and non-IPM field trials of rice[J].Bull Environ Contam Tocicol,2003,81(4):373-376.
[5]Berglöf T,T Van Dung,H Kylin,et al.Carbendazim sorption-desorption in vietnames soils[J].Chemosphere,2002,48(3):267-273.
[6]Carbo L,Martins E L,Dores E F,et al.Acetamiprid,carbendazim,diuron and thiamethoxam sorption in two Brazilian tropical soils[J].J Environ Sci Health B,2007,42(5):499-507.
[7]Holmes M,Kennedy M C,Riccio R,et al.Assessing the risk to U.K.children from carbendazim residues in apple products[J].J Occup Environ Health,2008,14:86-93.
[8]Moffit J S,Bryant B H,Hall S J,et al.Dosedependent effects of sertoli cell toxicants 2,5-hexanedione,carbendazim,and mono-(2-ethylhexyl)phthalate in adult rat testis[J].Toxicol Pathol,2007,35(5):719-727.
[9]Yu Gongchang,Guo Qiming,Xie Lin,et al.Effects of subchronic exposure to carbendazim on spermatogenesis and fertility in male rats[J].Toxicol Ind Health,2009,25(1):41-47.
[10]李明石,王玉军,徐徐,等.多菌灵在黑土中的吸附及解吸行为[J].东北林业大学学报,2011,39(5):131-132.
[11]于彦彬,苗在京,万述伟,等.三波长校正光度法测定水果蔬菜中多菌灵残留量[J].理化检验:化学分册,2005,41(5):353-357.
[12]Holtman M A,Kobayashi D Y.Identification of rhodococcus erythropolis isolates capable of degrading the fungicide carbendazim[J].Applied Microbiology and Biotechnology,1997,47(5):578-582.
[13]黄玉杰,张新建,任艳,等.多菌灵降解菌的分离、鉴定及其降解特性研究[J].山东科学,2011,24(2):28-34.
[14]Xu Jingliang,He Jian,Wang Zhichun,et al.Rhodococcus qingshengii sp.nov.,a carbendazim-degrading bacterium[J].International Journal of Systematic Evolutionary Microbiology,2007,57(12):2754-2757.
[15]Zhang Guishan,Jia Xiaoming,Cheng Tianfan,et al.Isolation and characterization of a new carbendazim-degrading Ralstonia sp.strain[J].World Journal of Microbiology and Biotechnology,2005,21(3):265-269.
[16]张丽珍,乔雄梧,马利平,等.多菌灵降解菌NY97-1的鉴定及降解条件[J].环境科学学报,2006,26(9):1440-1444.
[17]Fang Hua,Wang Yiqi,Gao Chunming,et al.Isolation and characterization of pseudomonas sp.CBW capable of degrading carbendazim[J].Biodegradation,2010,21:939-946.
[18]田连生,陈菲.木霉对多菌灵的生物降解特性研究[J].土壤学报,2009,46(6):1127-1131.
[19]Gunjan Pandey,Susan J Dorrian,Robyn J Russell,et al.Cloning and biochemical characterization of a novel carbendazim(Methyl-1 H-Benzimidazol-2-ylcarbamate)-hydrolyzing esterase from the newly isolated nocardioides sp.strain SG-4G and its potential for use in enzymatic bioremediation[J].Applied Environmental Microbiology,2010,76(9):2940-2945.
[20]Xu Gangming,Zheng Wei,Li Yingying,et al.Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by a newly isolated paracoccus sp.strain TRP[J].International Biodetetioration and Biodegradation,2008,62:51-56.
[21]朱凤晓,孔洁,由焦化,等.高效复合菌对多菌灵的生物降解[J].环境科学学报,2011,31(5):1045-1050.
