大黄素对重症急性胰腺炎大鼠肠黏膜屏障的分子保护机制
2012-06-28余亮科曹克勇
王 林 余亮科 王 原 曹克勇 李 靓
(河北联合大学附属医院,河北 唐山 063000)
目前认为重症急性胰腺炎(SAP)胰腺微循环障碍会导致胰腺腺泡的急性损害和胰腺的急性炎症〔1〕。临床上,除有局部病变所特有的表现外,常伴有明显的全身性炎症反应综合征(SIRS),甚至导致多器官功能衰竭(MOF),病死率达30% ~50%。如何阻止SAP病情迅速发展,是临床与基础研究一直探索而尚未有效解决的一个难题。本实验观察大黄素抑制胰蛋白酶、降低血浆致炎因子水平等作用,从而阐明大黄素对肠黏膜机械屏障的保护作用机制。
1 材料与方法
1.1 材料 雄性SD大鼠90只,体重300~350 g,由河北联合大学实验动物部提供;牛磺胆酸钠购自Sigma公司,用生理盐水配制成5%的溶液;微泵注射器(德国BM公司);白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-8 、IL-10 同位素检测试剂盒,购自中国人民解放军总医院放射免疫研究所,批号200910;台式高速离心机5415C型(德国Eppendorf公司)。
1.2 方法
1.2.1 大鼠SAP模型的建立 参照文献〔2,3〕介绍的方法。动物麻醉后按无菌操作对大鼠剖腹,于十二指肠内侧找到片状分布的胰腺,并在肝门处用无损伤显微血管夹夹闭胆胰管,在手术显微镜下用微泵注射器对胰管进行穿刺并注射5%牛磺胆酸钠0.4 ml/kg,压力高于胰管压,约10~15 min胰腺出现肉眼可见的水肿出血,表明SAP模型制作成功,松开血管夹,缝合关闭腹腔并开始计时。所有大鼠术后均自由饮水饮食。
1.2.2 实验分组与处理 将70只SD大鼠随机分为三组:对照组(假手术组)10只;SAP未治疗组(观察组)30只;SAP大黄素治疗组(治疗组)30只;观察组及治疗组再分为3个时刻点(12、24、48 h)亚组,各组10只。制模和麻醉成功后,观察组和治疗组用6-0线结扎总胆胰管近肝门末端,以0.75 mm静脉留置针在十二指肠端向胆胰管内进针5 mm,6-0线结扎,拔除针芯。接输液泵向胆胰管内以0.2 ml/min速度恒压逆行注射5%牛磺胆酸钠溶液(1 ml/kg),8 min后拆除胆胰管两端的缝线,拔除穿刺针,8-0线缝扎穿刺孔。假手术组仅开腹翻动十二指肠后缝合腹壁。造模后各组经胃造瘘置管至空肠上段,8-0缝线固定于胃壁并将造瘘管另一端置于体外,逐层关腹并固定。大腿根部皮下注射0.9%氯化钠溶液20 ml/kg体质量以补充术中失液。在大鼠苏醒并恢复活动后,治疗组通过造瘘管向空肠内注入大黄素溶液(5 mg/ml,5 ml/kg)。模型组和对照组注入等量生理盐水。三组大鼠门静脉取血备测血清淀粉酶活性、血浆致炎因子含量。
1.2.3 检测项目与方法
1.2.3.1 血清淀粉酶 采用AR-CHITECTC8000型全自动生化分析仪检测,严格按试剂盒说明书操作(上海申索佑福医学诊断用品有限公司),用酶法测定血清淀粉酶活性。
1.2.3.2 血清致炎因子IL-1β、TNF-α、IL-8、IL-10 均采用双抗体夹心ELISA法检测。
1.3 统计学方法 应用SPSS13.0统计软件进行分析,实验数据以x±s表示,组内两两比较采用配对t检验,组间比较采用单因素方差分析。
2 结果
2.1 各组各时间点血淀粉酶水平比较 见表1。

表1 各组各时间点血浆淀粉酶水平(U/L,x ± s,n=10)
2.2 大黄素对SAP大鼠IL-1β、TNF-α、IL-8和IL-10含量的影响 观察组IL-1β、TNF-α、IL-8较对照组高,且随时间而加重,说明胰腺被膜下注射5%牛磺胆酸钠造成大鼠SAP时可以影响血浆内细胞因子水平;在各时间点,治疗组 IL-1β、TNF-α、IL-8较观察组明显下降(P <0.05);在12、24、48 h,治疗组IL-10较SAP模型组明显下降(P<0.05),说明大黄素通过调节血浆内细胞因子水平达到治疗SAP的作用。见表2~表5。

表2 各组大鼠不同时段血浆IL-1β水平比较(x ± s,n=10)

表3 各组大鼠不同时段血浆TNF-α水平比较(x ± s,n=10)
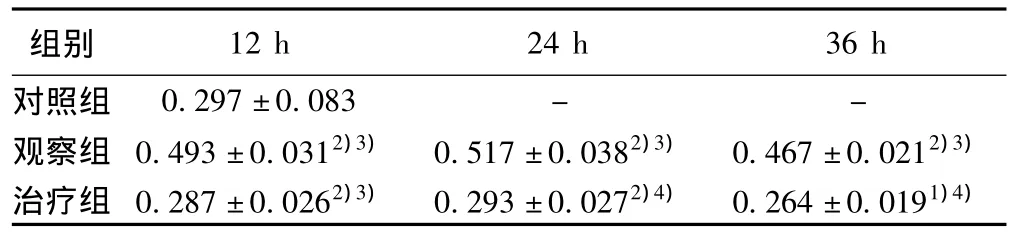
表4 各组大鼠不同时段血浆IL-8水平比较(x ± s,n=10)

表5 各组大鼠不同时段血浆IL-10水平比较(x ± s,n=10)
3 讨论
目前研究认为SAP高致死率的主要原因为肠黏膜屏障高通透性使肠道细菌和内毒素易位,导致SAP继发胰周及全身感染〔4〕。研究表明炎症介质在SAP发生、发展过程中起主要作用〔5〕。胰腺炎时胰腺局部微血管痉挛,全身缺血和血压下降导致灌注不足,胰腺局部微血管痉挛导致微循环障碍,出现胰腺缺血和再灌注损伤,白细胞粘附和嵌顿于血管壁,此过程又导致白细胞过度激活,大量炎症介质被释放入血,形成促炎因子激活的级联放大的复杂网络互相影响互相促进,进一步导致和加重微循环障碍,加重胰腺损伤,并引发SIRS和MODS,因此,炎症介质在SAP中起着主要作用。动物实验研究发现,大鼠SAP时,肠组织微循环血流量明显减少,血清IL-1β活性较对照组明显升高。TNF-α是SAP时升高最早的炎症介质,能直接损伤肠上皮细胞间的紧密连接,还可加速谷氨酰胺消耗,阻止其向α-酮戊二酸转化,降低肠黏膜细胞三磷酸腺苷水平,加重肠黏膜机械屏障损伤,造成细菌移位;又可诱导IL-1β、IL-6、IL-8以及自身基因表达,从而产生炎症介质的级联放大作用,导致血管通透性增加、微循环障碍、细胞功能受损、毛细血管微血栓形成、氧自由基的产生、炎症反应加剧等不良作用出现。同样,IL-8可刺激炎症,激化炎症细胞对炎症介质的作用,并能协同TNF-α作用于微血管系统,加重微血栓形成和组织损伤。研究发现,大黄素能有效抑制干扰素-γ+内毒素(LPS)诱导的人结肠癌细胞株HT-29分泌IL-8及核转录因子(NF-κB)的活化,具有抗炎作用〔6〕。本实验证实,SAP时大量活性物质和炎症介质被释放入血,导致一系列血液炎性因子的变化,且变化的程度与胰腺损伤的严重程度以及与疾病的预后均有密切关系。既往研究认为,大黄可增加胃肠黏膜灌注量,降低肠黏膜及肠毛细血管通透性,清除氧自由基,促进胃肠黏膜新陈代谢,促进肠黏膜内杯状细胞增生,抑制肠道内细菌过度繁殖和肠道LPS吸收,改善线粒体的呼吸功能,活血化瘀、改善微循环〔7〕。实验和临床研究均证实,传统中药大黄对肠屏障损伤的保护作用明确,其作用机制是多方面的。本研究发现大黄的主要成分大黄素明显降低了治疗组大鼠TNF-α和IL-8水平,有效地减轻了胰腺的损害,降低了大鼠的病死率,延长了生存时间,用药期间没有发现大鼠更多不良反应的出现,这也说明该药物具有安全性,也为临床使用奠定了一定理论基础。
1 张肇达.急性胰腺炎〔M〕.北京:人民卫生出版社,2004:46-70.
2 张群华,蔡 端,吴树强,等.急性坏死性胰腺炎大鼠的炎性介质变化和生长抑素的作用〔J〕.中华医学杂志,1997;77(5):355-8.
3 Banerjee AK,Galloway SW,Kingsnorth AN.Experimental models of acute pancreatitis〔J〕.Br J Surg,1994;81(8):1096-103.
4 汪 洁,马保金,吴 钢,等.急性坏死性胰腺炎大鼠肠道黏膜屏障功能的损害及肠道细菌移位〔J〕.中华实验外科杂志,2007;24(5):570-2.
5 Uhl W,Buchler MW,Malfertheiner P,et al.A randomised,double blind,multicentre trial of octreotide in moderate to severe acute pancreatitis〔J〕.Gut,1999;45(1):97-104.
6 刘瑞林,张 嘉,吴 薇,等.大黄素对肠缺血/再灌注损害保护作用的实验研究〔J〕.中国中西医结合急救杂志,2008;15(1):45-7.
7 陈德昌,姜兴禄,李红江,等.大黄对危重症患者胃肠黏膜血流灌注的影响〔J〕.中国急教医学,1999;19(10):581-4.
