海藻酸钠的提纯及海藻酸钙多孔支架的制备*
2012-06-25刘杨任力季培红王迎军
刘杨 任力 季培红 王迎军
(华南理工大学材料科学与工程学院∥国家人体组织功能重建工程技术研究中心∥广东省生物医学工程重点实验室,广东广州510640)
随着生物材料和组织工程技术的飞速发展,根据组织工程学的要求,最理想的生物医用支架材料应该是无毒、生物相容性好、可生物降解且降解产物无毒副作用的天然材料[1-3].海藻酸盐由于容易凝胶化、生物相容性好等优点而被广泛应用于化学、生物、医药、食品,环保等领域[4-8].由于离子交联的海藻酸盐水凝胶可以在冰水、热水以及室温条件下形成,而且反应条件温和,简单易行,且可注射、可原位凝胶化,而被广泛应用于组织工程领域[9-10].
在生物医学系统和组织工程应用中,过量异体蛋白质的引入会引起强烈的宿主免疫反应,因此海藻酸钠(AlgNa)在应用于组织工程研究时必须除去其中过量的蛋白质杂质[11].文中通过丙酮沉淀法[12-13]对海藻酸钠进行了提纯,得到了较纯的组织工程用海藻酸钠样品,该方法所得到的产物纯度较高,产物性能稳定,并且制备过程简单.
组织工程支架材料的孔隙率以及其中孔洞的尺寸与分布,对细胞在材料中的粘附、增殖和分化来说至关重要.海藻酸钠与钙离子交联能够形成三维的生物相容性多孔支架材料,可以用来作为细胞生长的外环境[14],不同工艺条件下制备出的支架材料的内部孔洞结构存在很大的区别.文中通过CaCl2-AlgNa,CaSO4/GDL-AlgNa,Ca-EDTA/GDL-AlgNa 三种交联体系制备了多种海藻酸钙三维多孔支架材料,其中后两种体系采用钙离子原位释放法交联制得.
1 实验方法
1.1 主要实验原料
海藻酸钠原料(实验试剂)、二水硫酸钙(AR)、乙二胺四乙酸二钠(AR)和无水硫酸钠(AR)由天津福晨化学试剂厂提供,牛血清蛋白(生化试剂)由上海博奥生物科技有限公司提供,丙酮(AR)由广东光华化学厂有限公司提供,CoomassieG-250(超级纯)由广州威佳科技有限公司提供,无水氯化钙(AR)由天津市化学试剂一厂提供,碳酸钙由广州化学试剂厂提供,GDL(AR)由ALFA AESAR公司提供.
1.2 海藻酸钠原料的提纯
根据Vidal-Serp等的方法[12-13],通过高速离心(GL-10MD,湖南湘仪仪器厂生产)、G14漏斗抽滤、丙酮溶解、洗涤、真空干燥、冷冻干燥等过程对海藻酸钠原料进行提纯,重复此操作3次,最后得到纯化后的海藻酸钠样品.用精密电子天平(BP211D,美国双杰兄弟公司)称量出提纯后所得的海藻酸钠质量m2,根据Q=m2/m1×100%,测定样品提纯的产率Q,其中m1为提纯前的原料质量.
1.3 纯化后海藻酸钠的表征
为表征材料提纯前后结构的变化,对提纯前后的样品进行了红外测试(iS10,美国NICOLET仪器公司生产),扫描范围为4000~400 cm-1.相对分子质量是决定海藻酸盐水凝胶等弹性体材料力学性能的关键因素之一[15],通过调整海藻酸钠的相对分子质量可以控制离子交联的海藻酸盐支架材料的力学性能[16].对海藻酸钠溶液进行GPC测试(HT-GPC,美国VISCOTEK公司生产),进样体积为100 μL.精确称取提纯前和提纯后的海藻酸钠样品各5 mg,分别溶于100 mL水中,根据文献[13]中所报道的方法,利用紫外分光光度计(UV-3802,优尼特设备有限公司生产)测定了纯化前和纯化后的样品中蛋白质杂质的含量.
1.4 海藻酸钙多孔支架的制备
配制质量分数分别为1%、1.5%、2%、2.5%、3%的AlgNa溶液和0.2mol/L的CaCl2溶液,分别取以上5种浓度的AlgNa溶液各20mL于编号为A1-A5的烧杯中,确定一个固定值 P=[Ca2+]/[COO-]=0.18[13],加入对应量的 CaCl2溶液,搅拌5min.
配制质量分数分别为1%、1.5%、2%、2.5%、3%的AlgNa溶液,分别取以上5种浓度的海藻酸钠溶液各20 mL置于编号为B1-B5的烧杯中,确定P=[Ca2+]/[COO-]=0.18[13]、确定 Q=[GDL]/[Ca2+]=2,加入对应量的CaSO4·2H2O和GDL粉末,磁力搅拌5min.
称取7.45g EDTANa2和2g CaCO3粉末放入100 mL去离子水中充分发生螯合反应,形成0.2 mol/L的Ca-EDTA溶液,并配制质量分数分别为1%、1.5%、2%、2.5%、3%的AlgNa溶液.分别取这5种浓度的海藻酸钠溶液各20 mL置于编号为C1-C5的烧杯中,确定 P=[Ca2+]/[COO-]=0.18[13]、确定 Q=[GDL]/[Ca2+]=2,加入对应量的 Ca-EDTA溶液和GDL粉末,磁力搅拌5min.
将以上3种交联体系在室温下静置60 min,待溶液交联形成水凝胶后,将水凝胶放入-20℃冰箱中放置4h,再转入-70℃冰箱中放置2h,然后将冷冻后的水凝胶冷冻干燥48 h,得到具有三维多孔结构的支架材料.
1.5 海藻酸钙多孔支架的表征
制备大小为6mm×6mm×5mm的3种体系制得的海藻酸钙支架样品,真空下对样品表层喷金,加速电压10kV,进行扫描电镜(JSW-6360LV,日本岛津公司生产)观察.将由1%、1.5%、2%、2.5%、3%的海藻酸钠制备出的海藻酸钙支架材料制备成大小为1.0cm×1.0cm×1.5cm的柱状,利用万能电子拉力试验机(AG-1型,日本岛津公司生产)进行载荷测试,加压速度为2 mm/min.对Ca-EDTA/GDL-AlgNa交联体系中由2.5%的海藻酸钠溶液制备出的海藻酸钙三维多孔支架进行Micro-CT评价测试(eXplore Locus,通用电气公司生产),测定支架材料的比表面积、孔径以及一些其他结构信息.
2 实验结果与讨论
2.1 海藻酸钠的提纯产率
提纯后的海藻酸钠质量m2=1.637g,提纯前的原料质量m1=3 g,样品产率Q=54.6%.这表明通过高速离心、G4漏斗抽滤、丙酮沉淀、洗涤、真空干燥、冷冻干燥等过程,去掉了海藻酸钠原料中的大量杂质,得到了较纯的海藻酸钠样品.
2.2 红外光谱分析
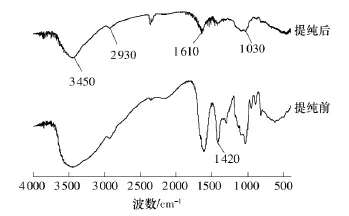
图1 海藻酸钠的红外光谱图Fig.1 FT-IR spectra of sodium alginate
图1是将提纯前和提纯后的海藻酸钠样品在4000~400cm-1区间内进行红外光谱扫描得到的谱图.其中显示了海藻酸钠的一些特征吸收峰:O—H的吸收峰为3450cm-1,C—H的伸缩振动吸收峰为2930cm-1,1200~1300cm-1的宽强吸收峰是海藻酸钠中—O—基团的吸收峰,1610 cm-1处是吡喃环化合物C—O—C的伸缩振动峰,1030 cm-1附近的吸收峰是海藻酸钠中环醇结构上的—OH的振动峰.另外,相比提纯前的海藻酸钠,提纯后的海藻酸钠样品在1420cm-1左右出现的吸收峰明显减弱,而这正是蛋白质氨基酸中羧酸根离子的对称伸缩振动峰,这表明提纯后材料中的蛋白质杂质含量大为减少.
2.3 GPC测定的海藻酸钠相对分子质量
通过调节海藻酸钠的相对分子质量可以控制离子交联的海藻酸盐支架材料的力学性能.凝胶渗透色谱法测定提纯后的海藻酸钠的数均相对分子质量(Mn)为1.48×105,重均相对分子质量(Mw)为2.65×105,峰值相对分子质量(Mp)为2.24 ×105,Z均相对分子质量(Mz)为4.15×105.海藻酸钠样品的多分散性系数(Mw/Mn)为1.79~1.80,属于一般多分散性样品.相较于初始原料,提纯后样品的相对分子质量有一定的下降,这可能与提纯过程中机械应力和有机溶剂的作用使聚合物的分子链断裂有关.
2.4 剩余蛋白质的含量
图2是利用紫外分光光度计测定的蛋白质溶液在589nm处的吸光度-浓度标准曲线.提纯前的海藻酸钠中蛋白质的含量高达(40±5)%.而纯化后得到的样品溶液中蛋白质的浓度仅为1.7072mg/L,剩余蛋白质杂质的质量仅占纯化后样品总质量的3.4%,低于文献中所报道的其他方法,如酸沉淀法(约为6.7%)和活性炭法(约为8.5%)结果[13].研究表明,纯化后,海藻酸钠原料中超过90%的蛋白质杂质被除掉,得到了较纯的海藻酸钠样品.
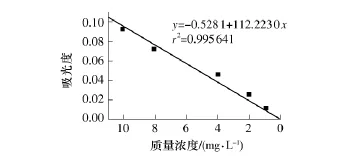
图2 蛋白质含量的标准曲线Fig.2 Standard curve of protein content
2.5 海藻酸钙支架的SEM图像
组织工程支架材料的孔隙率以及其中孔洞的尺寸与分布,对细胞在材料中的粘附、增殖和分化来说至关重要,不同工艺条件下制备出的海藻酸钙支架材料的内部结构存在很大的区别.图3是未交联的海藻酸钠冻干样品的SEM照片,未交联的海藻酸钠呈片层状且结构稀疏而不规则.

图3 未交联的AlgNa的SEM图Fig.3 SEM images of sodium alginate(uncrosslinked)
图4(a)-(e)是由CaCl2-AlgNa交联体系制备的海藻酸钙三维多孔支架的SEM图像.通过扫描电镜对材料中孔径大小及孔隙分布的观察发现,在CaCl2-AlgNa这一交联体系中,交联明显但不均匀.这是由于CaCl2溶液在加入到该体系中时,直接以Ca2+溶液的形式参加交联反应,不存在Ca2+缓慢释放的过程,Ca2+在加入到海藻酸钠溶液中时立刻发生交联反应,溶液的凝胶化又限制了Ca2+在整个体系的流动,造成了材料局部交联明显但交联不够的现象,过快的凝胶化速率导致了材料内部交联程度的不同以及材料结构的不均匀等缺陷.

图4 CaCl2-AlgNa交联体系制备的海藻酸钙支架SEM图Fig.4 SEM images of calcium alginate porous scaffolds from(CaCl2-AlgNa)crosslinked system
图5(a)-(e)是在CaSO4/GDL-AlgNa交联体系中通过不同浓度的海藻酸钠制备的海藻酸钙三维多孔支架的SEM图.CaSO4/GDL-AlgNa交联体系的交联程度较好,在该体系中虽然存在Ca2+缓慢释放的过程,但由于Ca2+通过CaSO4固体溶解释放出来的速率以及Ca2+在不同位置的浓度变化难以调节,其凝胶动力学不易控制,同时未反应的CaSO4固体也很难从支架材料中脱除,故在所得的支架材料中存在明显的白色沉淀,这种不均匀的凝胶化导致材料不同部位的成分和结构存在很大的差异,沉淀物的存在降低了材料结构的均一性.

图5 CaSO4/GDL-AlgNa交联体系制备的海藻酸钙支架的SEM图Fig.5 SEM images of porous calcium alginate scaffolds fabricated from CaSO4/GDL-AlgNa crosslinking system

图6 Ca-EDTA/GDL-AlgNa交联体系制备的海藻酸钙支架的SEM图Fig.6 SEM images of porous calcium alginate scaffolds fabricated from Ca-EDTA/GDL-AlgNa crosslinking system
图6(a)-(e)是由Ca-EDTA/GDL-AlgNa交联体系制备的海藻酸钙三维多孔支架的SEM照片.通过扫描电镜对材料中孔径大小及孔隙分布的观察发现,在Ca-EDTA/GDL-AlgNa交联体系中,海藻酸钙支架的交联程度较好且十分均一,材料中的微孔分布均匀,比表面积较大.这是由于 Ca2+在从 Ca-EDTA这一螯合体系中释放出来之前已经均匀地分布在整个海藻酸钠溶液当中,随后其释放速率和浓度均能够通过GDL来调节,整个交联反应同时同步在整个体系的所有部位发生,而且Ca2+在整个Ca-EDTA/GDL-AlgNa交联体系的各个部位,从头到尾都保持着均一的浓度,使得材料整体的交联反应同时发生并且均一.其中由质量分数为2.5% ~3.0%的海藻酸钠所制得的海藻酸钙三维多孔支架材料中的孔径分布在50~200μm之间,这种孔径有利于细胞的生长.
在以上3种交联体系中,Ca2+从各体系中释放的方式以及海藻酸钠溶液质量分数的不同导致了各种海藻酸钙支架材料在结构上存在着巨大的差别.随着海藻酸钠浓度的增加,前两个体系制备的材料的结构不均一现象更为明显,而在第三个体系中所有材料的结构都很均一.这是由于海藻酸钠溶液发生交联反应形成海藻酸钙时,体系各个部位凝胶化的速度与Ca2+和海藻酸钠的浓度直接相关,而溶液一旦凝胶化又会对交联剂中Ca2+的释放以及Ca2+在交联体系中的移动造成很大影响.
通过研究,我们发现 CaCl2-AlgNa体系和CaSO4/GDL-AlgNa体系相对 Ca-EDTA/GDL-AlgNa交联体系而言,最大的局限在于Ca2+的释放和Ca2+的移动很难做到在体系中均一同步,因此交联反应发生的程度和分布也做不到均一,故而很难得到理想的海藻酸钙支架材料.
2.6 海藻酸钙支架材料的抗压强度
由于CaCl2-AlgNa、CaSO4/GDL-AlgNa交联体系制备出的海藻酸钙支架材料在成分和结构上明显不均一,故只对Ca-EDTA/GDL-AlgNa体系制备出的结构均一的海藻酸钙多孔支架材料进行力学性能测试.利用万能电子拉力试验机测定 Ca-EDTA/GDL-AlgNa体系制备的海藻酸钙三维多孔支架材料的抗压性能.在这一交联体系中,由质量分数为2.5%和3.0%的海藻酸钠所制备出的海藻酸钙支架材料具有较好的力学强度,其最大承重可达(75.0±5.0)N(图7(a)),高于相同体系制备的其他支架材料;浓度为3.0%的海藻酸钠制备出的三维支架材料的抗压强度更是高达0.8MPa(图7(b)).研究结果表明,在合适的交联体系中,由一定质量分数的海藻酸钠溶液制备出来的海藻酸钙支架材料具有较好的抗压能力,该材料能够通过裁剪得到各种形态的三维支架.
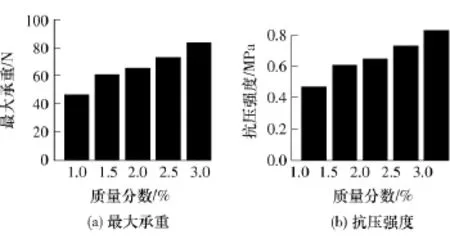
图7 Ca-EDTA/GDL-AlgNa体系制备的海藻酸钙支架的最大承重和抗压强度Fig.7 Maimum load and compression strength of porous calcium alginate scaffold fabricated from Ca-EDTA/GDL-AlgNa crosslinking system
2.7 海藻酸钙支架材料的Micro-CT评价
对质量分数为2.5%的海藻酸钠溶液制备出的海藻酸钙支架材料进行 Micro-CT评价测试.图8(a)是对海藻酸钙支架材料进行Micro-CT评价测试扫描的一个断面图,图8(b)是海藻酸钙材料表面结构的重建图.可以看出所得材料的内部具有较高的孔隙率,孔隙分布均匀,且孔隙之间相互贯通.此外,通过Micro-CT的测试结果还可得知该海藻酸钙多孔支架材料的比表面积为123.27,壁厚为4.08×10-3cm,结构模型指数为1.99,各向异性程度为3.15,分形维数为2.41,微孔的体积大约为5.10×10-7cm3,材料的孔径大致分布在75~85 μm之间.通过Micro-CT扫描可以对材料的内部结构有一个更加清晰的了解,为后续的相关研究提供一定的参考,这种支架材料有可能为细胞的粘附、生长、增殖和分泌细胞外基质提供一个合适的三维空间.

图8 支架断面图和表面结构重建图Fig.8 Cross-section and reconstruction images of scaffold surface
3 结论
文中采用丙酮沉淀法对海藻酸钠进行了提纯,得到了较纯的组织工程用海藻酸钠样品.此外,通过 CaCl2-AlgNa,CaSO4/GDL-AlgNa,Ca-EDTA/GDLAlgNa三种交联体系制备了多种海藻酸钙三维多孔支架材料.研究表明:通过Ca-EDTA/GDL-AlgNa这一交联体系制备出的支架材料中,由质量分数为2.5%~3.0%的海藻酸钠所制得的海藻酸钙三维多孔支架材料的微孔分布均匀,比表面积较大,孔径在50~200μm之间,且具有较好的机械强度,这样的支架材料有可能用作组织工程和细胞工程培养细胞的培养基和一些其他用途的医用敷料.
[1]Langer R,Vacanti J P.Tissue engineering [J].Science,1993,260(5110):920-926.
[2]Bouhadir K H,Lee K Y,Alsberg E,et al.Degradation of partially oxidized alginate and its potential application for tissue engineering [J].Biotechnol Prog,2001,17(5):945-950.
[3]Boontheekul T,Kong H J,Mooney D J.Controlling alginate gel degradation utilizing partial oxidation and bimodal molecular weight distribution [J].Biomaterials,2005,26(15):2455-65.
[4]詹现璞,吴广辉.海藻酸钠的特性及其在食品中的应用[J].食品工程,2011(1):7-10.Zhan Xian-pu,Wu Guang-hui.Characteristics of sodium alginate and its application in food [J].Food Engineering,2011(1):7-10.
[5]Zhao L,Weir M D,Xu H H K.An injectable calcium phosphate-alginate hydrogel-umbilical cord mesenchymal stem cell paste for bone tissue engineering [J].Biomaterials,2010,31(25):6502-6510.
[6]魏东洋,王飞,刘广立,等.海藻酸钠强化超滤含铜废水[J].环境科学与技术,2011,34(4):77-80.Wei Dong-yang,Wang Fei,Liu Guang-li,et al.Sodium alginate improved ultrafiltration contain copper wastewater[J].Environmental Science and Technology,2011,34(4):77-80.
[7]王宏丽,张利,左奕,等.海藻酸钠的疏水必性及其对药物的缓释[J].功能材料,2010,41(9):1568-1571.Wang Hong-li,Zhang Li,Zuo Yi,et al.The hydrophobic modification of sodium alginate and its drug release [J].Journal of Functional Materials,2010,41(9):1568-1571.
[8]Bidarra S J,Barrias C C,Barbosa M A,et al.Immobilization of human mesenchymal stem cells within RGD-grafted alginate microspheres and assessment of their angiogenic potential[J].Biomacromolecules,2010,11(8):1956-1964.
[9]Jiang F X,Yurke B,Firestein B L,et al.Neurite out growth on a DNA crosslinked hydrogel with tunable stiffnesses[J].Ann Biomed Eng,2008,36(9):1565-1579.
[10]Wu L B,Jing D Y,Ding J D.A room-temperature injection molding/Particulate Leaching approach for fabrication of biodegradable three-dimensional Porous scaffolds[J].Biomaterials,2006,27(2):185-191.
[11]Godek M L,Duehsherer M L,MeElwee Q.Morphology and growth of murine cell lines on model biomaterials[J].Biomed Sci Instrum,2004,40:7-12
[12]Vidal-Serp D S,Wandery C.Purification of natural anionic polymers[J].Minerva Biotecnologica,2005,17:215-229.
[13]齐欲莎.组织工程用海藻酸钠及其水凝胶的制备与性能研究[D].广州:暨南大学材料学院,2008.
[14]Shapiro L.用于细胞培养和移植的新型海藻酸盐海绵体[J].国外医学生物医学工程册,1998,21(2):124-125.Shapiro L.A new type of alginate salt sponge body used for cell culture and transplantation [J].Foreign medical biomedical engineering books,1998,21(2):124-125.
[15]Sohneider S,Feilen P J,Kraus O.Biocompatibility of alginates for grafting:Impact of alginate molecular weight[J].Biotechnol,2002,31:383-394.
[16]King K.Changes in the functional properties and molecular weight of sodium alginate followingy γ irradiation[J].Food Hydrocolloid,1994,8(2):83-96.
