傅氏生化汤提取剂对后肢缺血模型鼠CD34蛋白表达的影响
2012-06-22张均克
张均克
(江汉大学医学院,湖北 武汉 430056)
傅氏生化汤的祛瘀生新功用已被临床医生习用,我们将该方作为一种血管新生诱导剂,在大鼠缺血后肢模型中观察到其促血管新生效应[1]。血管新生是从内皮细胞(endothelial cell,EC)受到刺激而增殖游走开始的,其EC来源于既存的微血管内皮细胞[2]。在正常成人,EC和血管平滑肌细胞(vascular smooth muscle cell,VSMC)不进行有丝分裂,但在生长发育、缺血缺氧、炎症及其他应激情况下,可以发生游走和分裂,从而启动血管新生的一系列过程[3]。而在血管内皮细胞的标志中,CD34的特异性最高,优于内皮细胞的其他标记物[4]。因此本研究采用免疫组化SABC法检测大鼠骨骼肌组织中血管内皮细胞CD34的表达水平,用以显示和计数微血管密度,更好地观察评价傅氏生化汤促血管新生效应。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 Ⅰ级雄性Wistar大鼠50只,体重约200 g~250 g,购自华中科技大学同济医学院实验动物学部。
1.1.2 试剂与仪器 羊抗兔SABC试剂盒(即用型)、DAB显色试剂盒、兔抗大鼠CD34单克隆抗体均购自武汉博士德生物工程有限公司。主要实验仪器有恒冷箱切片机(LEICA CM1900-Cryostat),CS101-2AB电热干燥箱,隔水式电热恒温培养箱及冰箱等。
1.1.3 实验药物 实验用中药材全部购自武汉市药材公司,经专业人员鉴定。为使该方的研究结果更能切合于现代临床,故将当归、川芎、桃仁、黑姜、炙甘草,按 6∶2∶1.5∶0.5∶0.5的比例,加水浸泡,按常规煎煮2次,每次1 h,合并滤液浓缩至适量,加95%酒精,使含醇量达65%,静置24 h后,过滤,滤液回收乙醇至尽。加蒸馏水定容使成100%浓度,滤过,灌装,压盖,灭菌备用,此即生化汤口服液(以下简称SHT)。依60 kg成人每日1剂原方原量换算出大鼠1 d用量,以此作为中剂量,倍之为大剂量,半之为小剂量。
1.2 实验方法
1.2.1 动物模型复制与分组给药 大鼠经适应性喂养2 w后开始实验。动物模型制作按照文献[3-5]方法进行。将大鼠经戊巴比妥钠腹腔(50 mg/kg)麻醉后,仰卧位固定,脱毛,消毒,于右腹股沟行纵行切口,暴露和分离股动脉,分别结扎股动脉起止端及其分支,切除股动脉。将大鼠随机分成空白对照组、模型组、生化汤小剂量组(SHTS)、生化汤中剂量组(SHTM)、生化汤大剂量(SHTL)组 5组,每组 10只大鼠。各治疗组术后即开始用生化汤每日定时灌胃,共灌胃用药30 d。
1.2.2 标本取材及组织切片 实验第31天取材,将大鼠用7%水合氯醛腹腔注射麻醉(0.3 mL/体重100 g),剪开胸腔暴露心脏,用灌注针头刺入大鼠心脏左心室,通过心脏灌注0.85%NaCl溶液150 mL,然后以4%多聚甲醛磷酸缓冲液(PB pH 7.3)300 mL灌注固定。然后取手术后肢的内收肌组织一小块,置上述固定4 h(4℃)后转入25% 蔗糖PB液(4℃)24 h。然后恒冷箱切片:-18℃ 20 μm厚,每隔5片取1张,黏至涂有多聚赖氨酸玻片上,置37℃温箱烤1 h(防脱片)后置室温保存。
1.2.3 免疫组织化学检测方法 采用抗生物素-生物素-过氧化酶复合物技术(avidin biotin peroxidase complex technique,ABC法)。按ABC法常规步骤操作。在作特异性显色的同时,设阴性替代片和空白对照显色。结果判定依据CD34阳性表达为棕黄色。具体步骤如下:①纯甲醇新鲜配制0.5%H2O2,滴加3%H2O2,室温浸泡30 min,以灭活内源性过氧化物酶。蒸馏水洗3次。②滴加复合消化液,室温,30 s~60 s。蒸馏水洗,2 min×3次。③滴加正常山羊血清封闭液,室温20 min。甩去多余液体,不洗。④滴加一抗(兔抗大鼠CD34抗体和Actin抗体,工作浓度均为1∶200;抗体均为即用型)置20℃,2 h。0.02 M PBS洗2 min×3次。⑤滴加生物素化山羊抗兔IgG,置20℃~37℃,20 min。0.02 M PBS洗3 min×3次。⑥滴加SABC,置20℃~37℃,20 min。0.02 M PBS洗2 min×4次。⑦DAB显色,使用DAB显色试剂盒。⑧苏木素轻度复染,脱水,透明,封片。⑨观察,照相。以正常一抗动物血清和缓冲液代替一抗作阴性对照。
1.2.4 MVD计数 微血管密度(microvasscular density,MVD)计数参照 Weidner N[6]和孙惠川等[7]方法进行。即先用 40倍光镜扫视整个切片,寻找高血管密度区,作为热点。再在200倍光镜视野下计数热点区被抗CD34抗体染成棕黄色的血管数目。任何染成棕黄染的细胞或细胞簇,即使未显示管状结构,只要它们和邻近的微血管、细胞或其他结缔组织分开,就把它们作为一个微血管。计数3个200倍视野下的血管数目,由两位不知临床资料的高年病理医师采用背对背法分别进行,取两者计数的平均值。
1.2.5 图像分析 对未复染片采用HPIAS-1000彩色图象分析系统进行计算机图像分析。
1.3 统计学方法
2 结果
2.1 各组大鼠骨骼肌组织CD34免疫组化染色计算机图像分析 结果见表1。
表1 各组大鼠骨骼肌组织CD34免疫组化染色光度比较 ()

表1 各组大鼠骨骼肌组织CD34免疫组化染色光度比较 ()
注:与模型组比较,1)P<0.01;与空白对照组比较,2)P<0.01
?
由表1可见,各组的平均光度和积分光度都较空白对照组有所增加,特别是SHT大剂量组明显增强。表明大鼠在造模以后CD34抗原的表达增强。
2.2 各组大鼠骨骼肌组织MVD计数比较 结果见表2。
表2 各组大鼠骨骼肌组织MVD计数比较 ()

表2 各组大鼠骨骼肌组织MVD计数比较 ()
注:与模型组比较,1)P<0.05;与空白对照组比较,2)P<0.05
?
由表2可见,与模型组比较,SHTM组和SHTL组大鼠骨骼肌组织MVD计数升高,差异有统计学意义(P<0.05)。
2.3 SHTL组大鼠骨骼肌组织免疫组化染色CD34抗原表达情况
结果见图1。由图1可见,CD34阳性表达主要定位于毛细血管壁、肌膜和肌纤维间质。
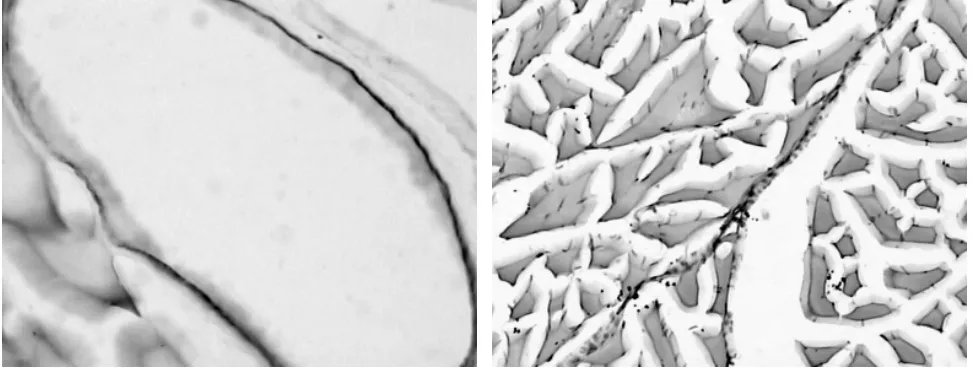
图1 SHTL组大鼠骨骼肌组织免疫组化染色CD34抗原表达情况
3 讨论
采用免疫组化方法标记微血管来反映血管新生并提供有价值的信息已被大多数学者所认可。血管新生的免疫组化研究是用针对血管内皮细胞(EC)标志物的抗体(抗FⅧ-RA、CD31、CD34等)完成的。1991年,Weidner N 进行一项探索性研究,用免疫组化法抗Ⅷ因子相关抗原(抗FVⅢ-RA)单克隆抗体染色血管内皮细胞膜进行标记血管记数。Horak E R[8]等用另一种血管细胞标记物CD31,并与FⅧ-RA比较,认为抗 CD31比抗 FVⅢ-RA 敏感。Toi M 等[9]也发现 CD31能染色更多的血管。后来认为CD34是较特异和敏感的生长中的血管内皮细胞表面标志,并且有较强的可重复性[10-11],故本研究采用抗CD34单抗来检测大鼠骨骼肌组织切片中血管内皮细胞CD34表达状况,用以反映血管新生状况。
CD(cluster of differentiation,CD)是位于细胞膜上一类分化抗原的总称,又称为白细胞分化抗原,它们是不同谱系(lineage)白细胞(还包括血小板,血管内皮细胞等)在正常分化成熟的不同阶段及活化的过程中出现或消失的细胞表面标记。其化学本质是细胞膜上的一类蛋白质或糖蛋白。CD具有重要的生物学意义,不仅可作为表面标志用于细胞的鉴定和分离,还广泛参与细胞的生长、成熟、分化、发育、迁移、激活。CD34是一种分子量为105 Kda~120 Kda的糖基化跨膜糖蛋白,表达于骨髓细胞和内皮细胞,目前无论是基础研究还是实际应用中都把CD34作为干细胞的识别标记。此外,CD34还是黏附分子(adhesion molecule)中白细胞选择素的配体,调控早期造血;又是外周淋巴结地址素(peripheral node addression,PNAd),介导淋巴细胞归巢(homing)[12]。
CD34在毛细血管及小血管内皮细胞中阳性表达很稳定,被认为是目前血管内皮细胞的最可靠标记[13],其突出优点是不需向血管内灌注填充剂、示踪剂等物;不受灌注充盈的影响,对毛细血管无刺激作用;保持了微血管的自然状态和管径大小;微血管显影效果良好,背景染色浅,血管与周围组织对比明显,这对进行骨骼肌组织微血管的形态计量学研究十分重要。冰冻切片操作简便,属常规方法,可长期保存;血管不易褪色,便于回顾性研究;方法适用范围广,人和动物组织均适用,可进行连续切片。本研究采用上述方法,实验结果显示,大鼠后肢缺血模型建立以后,CD34表达均有所增强,其微血管密度亦显著增加,表明后肢缺血以后,启动了血管新生的生理过程,EC的增生加速,作为血管内皮细胞特异性标记的CD34抗原的表达亦相应增强。因此模型组及SHT各组均比空白对照组显著增强,MVD增加。但SHT中剂量和大剂量组更为显著,显示出一定量效关系,表明傅氏生化汤有促血管新生的作用,初步显示出该方作为一种血管新生诱导剂的潜在意义。
[1]邱幸凡,张六通,张均克,等.祛瘀生新法对大鼠治疗性血管新生影响的实验研究[J].湖北中医杂志,2004,26(2):6-8.
[2]Plate K H,Breior G,Weich H A,et al.Angiogenesis:molecule and mode[J].Nature,1992,359(2):845-848.
[3]张均克,邓耀祖.血管新生研究进展[J].江汉大学学报:自然科学版,2005,33(2):90-96.
[4]Kimura H,Nakajima T,Kagawa K,et al.Angiogenesis in hepatocellular cacinoma as evaluated by CD34immunohistochemistry[J].Liver,1998,18(1):14-19.
[5]吴人亮,刘绍春.免疫组织化学技术及应用[M].5版.北京:人民卫生出版社,2000:31-33.
[6]Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast cacinoma[J].N Engl J Med,1991,324(1):1-8.
[7]孙惠川,汤钊猷,李晓明,等.肝癌肿瘤血管密度的研究[J].上海医学,1999,22(1):15.
[8]Horak E R,Leek K R,lenk N,et al.Angiogenesis,assessed by platelet/endothelial cell adhesion molecule antibodies as indicaton of node metastases and survival in breast cancer[J].Lancet,1992,340(8 828):1 120-1 124.
[9]Toi M,Kashitani J,Tominage T.Tumor angiogenesis is an independent prognostic indicator in primary breast carcinoma[J].IntJ Cancer,1993,55(3):371.
[10]Traweek S T,Kandalaft P L,Mehta P,et al.The human hematopoietic progenitor cell antigen(CD34)in vascular neoplasia[J].Am J Clin Pathol,1991,96(1):25-31.
[11]Tanigawa N,Lu C,Mitsui T,et al.Quantitation of sinusoidlike vessels in hepatocellular carcinoma:its clinical and prognostic significance[J].Hepatol,1997,26(5):1 216-1 223.
[12]龚非力.医学免疫学[M].武汉:武汉科学出版社,1999:76-98.
[13]Hollingsworth HC,Kohn E C,Steinberg S M,et al.Tumor angiogenesis in advanced stagy ovarian carcinoma[J].Am J Pathol,1995,147(1):33-41.
