转染 hif-1 αshRNA对辐射诱导 B16细胞细胞周期和凋亡变化的影响
2012-06-22王跃生王雪峰
王跃生,王雪峰
(佳木斯大学附属第一医院普外一科,黑龙江 佳木斯 154003)
在人的实体肿瘤中,缺氧已经成为一种普遍存在的现象,而缺氧所诱导的新生血管形成已经成为肿瘤恶性程度和是否转移的重要标志。在正常的组织中,hif-1 α基因虽表达,但是其又很快在组织中被代谢掉,只有在肿瘤细胞中才能够监测到 hif-1 α的存在[1]。那么实体肿瘤中心的乏氧区所诱导的 hif-1α高表达对肿瘤的发生和发展是否会具有重要的生物学意义已经成为了众多的专家和学者所研究的重点。它的存在是否导致了肿瘤细胞对缺氧的耐受,是否促进了肿瘤细胞向更坏的方向发展已经被越来越多的人所重视。本研究旨在探讨一下 hif是否对肿瘤细胞的细胞周期和凋亡是否有影响以及这些影响是否对于肿瘤靶向治疗具有重要的意义。
1 材料和方法
1.1 材料
稳定转染空载体和 hif1a shRNA载体的小鼠黑色素瘤细胞 B16,由吉林大学公共卫生学院卫生部放射生物学重点实验室保存,标记为 B16-Control和 B16-sihif1-a。
1.2 方法
1.2.1 细胞培养:B16细胞用含10%小牛血清的RPMI1640培养液(含100U˙mL-1青霉素和链霉素)于37℃,5%CO2的培养箱中传代培养。
1.2.2 细胞的照射及固定:取对数生长期细胞培养于6孔板中,每孔细胞5×105于24h后照射,照射剂量分别为0,1,2,4Gy,剂量率0.287Gy/min,照射后24h用胰蛋白酶消化收取细胞,75%的冷乙醇固定,-20℃保存待用。
1.2.3 流式细胞仪检测细胞周期和细胞凋亡变化:采用 PI标记 ,流式细胞术(FCM)检测细胞周期的变化。细胞用 PBS洗2次,RN Ase消化30min后加入5% PI 200μL,4℃避光孵育30min流式细胞仪检测,CELLQ uest软件收取细胞(每份样品收取1×104个细胞),ModF it软件分析细胞周期,结果以细胞周期各时相细胞的百分率表示。
1.3 统计学分析
采用 t检验。
2 结果
2.1 稳定转染 hif1-a shRNA载体对 B16细胞周期的影响
不同剂量照射后 ,对照组和 sihif-a组 G2+M细胞随着剂量的增加均出现了明显增加 (P<0.01),相同剂量下,sihif-a组 G2+ M细胞明显低于对照组 (P <0.05,P<0.01),而 G0/G1细胞出现降低,与此同时 S细胞也有一定程度的降低(见表1)。
2.2 稳定转染 hif-1 αshRN A载体对 B16细胞凋亡的影响
照射后,对照组和 sihif1-a组细胞的凋亡率随着辐射剂量的增加而增大,相同剂量下,sihif1-a组与对照组比,细胞凋亡率有增高趋势,见表2。
表1 不同的辐射剂量对 B16细胞周期的影响 ±s)
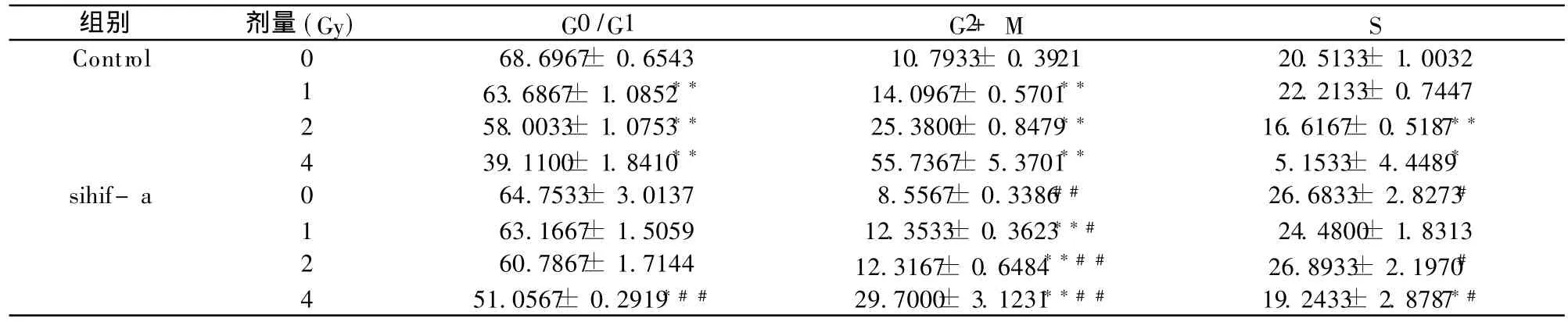
表1 不同的辐射剂量对 B16细胞周期的影响 ±s)
*P<0.05,**P<0.01与同组的最小剂量比较;#P<0.05,##P<0.01两组间相同辐射剂量的比较。
表2 不同的辐射剂量对 B16细胞凋亡的影响 ±s)

表2 不同的辐射剂量对 B16细胞凋亡的影响 ±s)
*P<0.05,**P<0.01与同组的最小剂量比较。#P<0.05,##P<0.01两组间相同辐射剂量的比较。
3 讨论
在肿瘤的恶性化进程中,肿瘤恶性程度发展的关键是细胞对氧浓度的适应和肿瘤细胞血管生成起决定性作用。氧环境是肿瘤细胞生长、凋亡、转移等的主要动力,而 hif-1α起关键作用,在促进肿瘤周边血管及自身血管的生成和肿瘤的侵袭性方面起中心作用[2]。经辐射诱导的细胞 DN A损伤,当损伤程度过大超过细胞自身系统的修复能力,那么细胞就启动了凋亡程序,导致细胞的程序性死亡[3],而损伤的程度在可以修复的范围内,那么细胞自身就会通过一系列的通路引起细胞的周期阻滞,使细胞停留在细胞周期的各个阶段,抑制 DNA复制,阻止细胞分裂,为 DN A修复系统修复损伤提供充足的时间以减少损伤所致的细胞死亡以及避免突变损伤进入子代细胞[4]。所以在肿瘤的辐射治疗过程中应当最大限度地降低细胞阻滞而使肿瘤细胞尽可能多地进入调往过程中去,这样才能够提高放射治疗肿瘤的疗效。实验研究证明[5]在实体肿瘤中存在着广泛的乏氧区,而这些乏氧区的存在对肿瘤治疗效果的研究一直被研究者所关注,这些部位在肿瘤的治疗过程中是否起到一定的作用也一直是研究者所研究的重点。本实验采用 RN Ai方法以观察 hif-1α表达的对辐射诱导的肿瘤细胞的周期阻滞和凋亡的影响,实验中通过两组实验的对比我们发现转染 hif-1αshRNA组细胞的凋亡率有了一定程度的提高,而且在细胞周期阻滞方面也可以看到 G2+M期阻滞的降低。分析其可能的机制是辐射直接或间接地损伤肿瘤细胞 DN A,由于 hif-1α表达下降 ,受损伤的细胞不能堆积于 G2期进行修复而直接发生凋亡。对多数细胞来说,M期和 G2期的细胞相对其他细胞而言对辐射的敏感性极强,而 G1期次之,S期的细胞对辐射极弱甚至无敏感度。关于处于不同时期的细胞周期对细胞辐射抗性差异的机理作用,还不清楚。真核细胞受照射后,可以诱导并阻滞 G2期的出现,这对保证细胞的完整性、损伤后细胞的存活和保持细胞的遗传稳定性方面具有重要生物学和遗传学意义。细胞处于 G2期阻滞状态,使许多损伤细胞的 DNA及时得到修复,这样极有利于细胞的存活[6]。另外,细胞 G2期阻滞与细胞辐射敏感强度有关。预先用咖啡因对哺乳动物细胞照射后,可以使细胞存活率明显下降。就本实验而言,转染hif1-a shRN A对辐射诱导的 B16细胞的影响是降低了了细胞周期 G2期的百分率,从肿瘤的治疗的角度来讲这是一个非常好的现象。但是阻滞的发生是否会引起肿瘤细胞的休眠,而给肿瘤的治疗带来不良的后果我们还不得而知,还是需要进一步的研究。
[1] Johnstone RW,Cretney E,Smyth M J.P-glycoprotein protects leukemia cells against caspase- dependent,but not casepaseindependent,cell death[J].Blood,1999,93(3):1075-1085
[2] KaurB,Khwaja FW,Severson EA,et al. Hypoxia and the hypox 2ia- inducible- factor pathway in glioma growth and angiogenesis[J].Neuro-Oncol,2005,7(2):134-153
[3] 于廷曦,朱应葆,童坦君.DN A损伤与细胞周期调控 [J].生物化学与生物物理进展,1999,26(4):350-354
[4] Maity A,Mckenna W G,Muschel R J.The molecular basis for cell cycle delays following ionizing radiation:a review[J].Radiother Oncol,1994,31(1):1-13
[5] Zhong H,De Marzo AM,Laughner E,et al.Overexpression of hypoxia-inducible facor1alpha in common human cancers and their metastases[J].Cancer Res,1999,59(22):5830-5835
[6] Terssier F,Bay JO,Dionet C,et al.Cell cycle regulation agents exposure to ionizing radiation[J].Bull cancer,1999,86(4):345-357
