透骨草提取物诱导人宫颈癌Hela细胞凋亡及其相关机制研究①
2012-06-21于秀艳曾常茜王文龙高海燕刘晓峰吉林省肿瘤医院长春130012
于秀艳 曾常茜 高 松 王文龙 高海燕 刘晓峰 (吉林省肿瘤医院,长春 130012)
宫颈癌是女性常见的恶性肿瘤之一,是全球妇女中发病率仅次于乳腺癌而占第2位的恶性肿瘤,寻找和研制高效低毒的治疗宫颈癌的药物仍然是当前宫颈癌研究工作的热点[1-5]。我们前期研究发现,透骨草(Phryma leptostachya L.var.asiatica Hara)提取物对人宫颈癌Hela细胞增殖具有显著的抑制作用[6]。本实验观察透骨草提取物对人宫颈癌Hela细胞凋亡的诱导作用以及对Bcl-2和Caspase-3蛋白表达水平的影响,旨在为透骨草提取物的研究与开发提供实验依据。
1 材料与方法
1.1 药品试剂及仪器 人宫颈癌Hela细胞由吉林省肿瘤研究所提供;RPMI1640、小牛血清和胰蛋白酶为美国Gibco公司产品;MTT和DMSO为Sigma公司产品;药物采自辽宁金州大黑山,经王心毓老先生鉴定为透骨草科植物(Phryma leptostachya L.var.asiaticaHara);RS232型酶联检测仪为美国Bio-Rad公司生产;BB16UV型CO2培养箱为德国Heraeus公司生产。
1.2 方法
1.2.1 透骨草提取物制备方法 加热回流提取法:取干燥透骨草50克,加8倍量75%乙醇,提取2小时,过滤,滤液水浴浓缩成干膏。
1.2.2 荧光显微镜观察Hela细胞形态 对数生长期的Hela细胞,调节为5×107cells/L,接种于6孔培养板,5%CO2,37℃孵育24小时,弃去培养液,PBS缓冲液洗涤。实验组加入100μg/ml透骨草提取物的培养液2.0 ml,对照组加入RPMI1640细胞培养液2.0 ml,继续培养48小时后,消化并收集细胞,PBS缓冲液洗涤2次后,1 000 r/min离心5分钟,以PBS缓冲液重悬细胞,细胞悬液密度为1×1010cells/L。取上述细胞悬液95μl,加入5μl吖啶橙(0.1 g/L)使吖啶橙终浓度为5μg/m l,置37℃孵箱中避光染色10分钟,取上述混合液10μl滴于载玻片上,盖玻片封片后于荧光显微镜观察并摄片。
1.2.3 透射电镜观察Hela细胞超微结构 取对数生长期Hela细胞,置5%CO2,37℃培养12小时,弃培养液,PBS洗涤。实验组加入100μg/ml透骨草提取物4 ml,对照组加入4 ml的RPMI1640细胞培养液,继续培养48小时,0.25%胰蛋白酶消化,离心5分钟,弃上清,PBS洗涤。用1 ml PBS缓冲液混悬细胞,移入 EP管,2 000 r/min离心10分钟,弃上清,以2.5%戊二醛4℃固定2小时,PBS缓冲液洗涤2次后,1%锇酸4℃固定2小时,PBS缓冲液洗涤2次,乙醇梯度脱水,渗透包埋,以常规方法制备超薄切片,枸橼酸铅染色,透射电镜下观察Hela细胞的超微结构并摄片。
1.2.4 流式细胞术检测Hela细胞凋亡 取对数生长期的 Hela细胞,调整为 4 ×105cells/ml,37℃,5%CO2培养12小时,弃培养液。实验组加入4 m l透骨草提取物,对照组加入4 ml RPMI1640细胞培养液,继续培养48小时。用0.25%胰蛋白酶消化,离心弃上清,PBS洗涤离心弃上清。用4℃预冷的PBS制成约1×106cells/ml的单细胞悬液。加入70%乙醇,摇匀,4℃固定24小时,1 000 r/min离心5分钟,PBS洗涤,用PBS制成1 ml细胞悬液,加入RNase,37℃水浴1小时,再加入PI染液,避光4℃染色30分钟后上机检测计算凋亡率和细胞周期所占比例。
1.2.5 Western blot检测 Bcl-2 蛋白和 Caspase-3 蛋白表达 对数生长期的细胞接种于培养瓶,贴壁后用100μg/ml透骨草提取物处理48小时,4℃收集细胞,PBS洗涤,加入细胞裂解液,4℃离心5分钟,收集上清,紫外分光光度法测定蛋白浓度。SDSPAGE分离蛋白样品,转印至PVDF膜,封闭,加入一抗(兔抗人Bcl-2单克隆抗体及Caspase-3单克隆抗体)室温孵育,TBST洗涤,加入二抗室温孵育,TBST洗涤,加入ECL试剂,暗室曝光,显影,定影,X光底片拍照,进行光密度分析。
1.3 统计学分析 实验数据采用SPSS11.0统计软件,计量资料以±s表示。P<0.05为差异有显著性。
2 结果
2.1 透骨草提取物对Hela细胞形态的影响 荧光显微镜下观察可见,对照组细胞形态规则,核大呈均匀一致的绿色荧光(图1A);而100μg/ml透骨草提取物作用Hela细胞48小时后,细胞皱缩,细胞核浓缩呈新月状边集(图1B)。
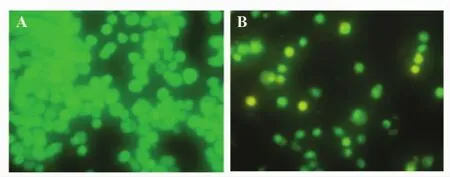
图1 荧光显微镜下观察Hela细胞形态(×400)Fig.1 Hela cells image of fluorencencem icroscope(×400)
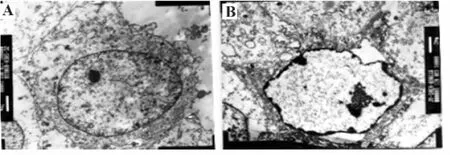
图2 透射电镜下观察Hela细胞超微结构(×5 000)Fig.2 Hela cells image of transm ission electron m icroscope(×5 000)
2.2 透骨草提取物对Hela细胞超微结构的影响透射电镜观察可见,对照组Hela细胞形态规则,胞膜完整,细胞核染色质均匀(图2A);而100μg/ml透骨草提取物作用Hela细胞48小时后,Hela细胞表面突起和微绒毛减少,核断裂、染色质凝聚且边缘化,有“出芽”现象(图2B)。
2.3 透骨草提取物对Hela细胞凋亡的影响 对照组 Hela细胞凋亡率为(7.39±1.12)%(图3A);而100μg/ml透骨草提取物作用Hela细胞48小时后,Hela细胞凋亡率为(25.90 ±1.13)%(图 3B),显著高于对照组(P<0.01)。
2.4 透骨草提取物对Hela细胞Bcl-2和Caspase-3蛋白表达水平的影响 100μg/ml透骨草提取物作用Hela细胞48小时后, Western blot结果显示,实验组细胞Bcl-2和Caspase-3蛋白表达水平与对照组相比较显著下降(P<0.05,图4)。
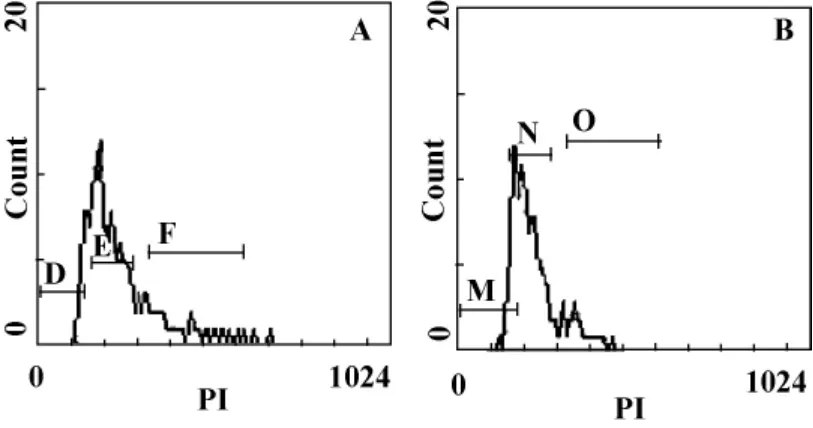
图3 透骨草提取物对Hela细胞凋亡的影响Fig.3 Effect of phryma leptostachya L.var asiatica Hara extract on Hela cells apoptosis
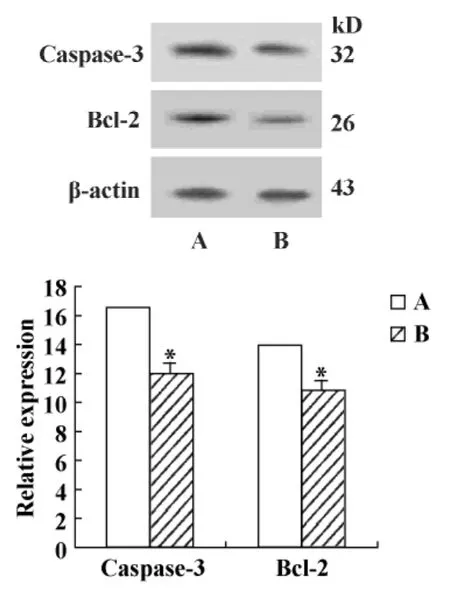
图4 透骨草提取物对Hela细胞Bcl-2和Caspase-3蛋白表达水平的影响Fig.4 The expression levels of Bcl-2 and Caspase-3 in Hela cells treated with phryma Leptostachya L.var.asiatica Hara extract
3 讨论
透骨草为透骨草科植物透骨草Phryma leptostachya L.var.asiatica Hara 的干燥全草,其根及叶鲜汁对家蝇及三带喙库蚊的幼虫有强烈的毒性,倍半木酚素有杀螨作用。其功能为清热解表,活血消肿。主治黄水苍、湿疹、跌打损伤、骨折。本实验用荧光显微镜和透射电镜从形态学观察,首次发现100μg/ml透骨草提取物处理的Hela细胞表现为凋亡的形态学改变,如细胞皱缩,细胞核浓缩呈新月状边集。表面突起和微绒毛减少,核断裂、染色质凝聚且边缘化,有“出芽”现象。进一步用流式细胞术研究发现,100μg/ml透骨草提取物处理的Hela细胞凋亡率显著高于对照组,表明透骨草提取物可以诱导Hela细胞凋亡。
Caspase-3是白介素1β转换酶类半胱氨酸蛋白酶家族成员之一,是哺乳动物细胞凋亡中的关键蛋白酶。正常情况下,Caspase-3以无催化活性的酶原或前体形式存在于胞质中。Caspase-3的活化通常继发于Bcl-2介导的线粒体凋亡通路的发生,Bcl-2可阻止线粒体通透性转换孔复合孔(MPTP)开放从而使细胞色素C不能从线粒体释放出来,从而阻止Caspase-3的激活,抑制细胞凋亡[7]。本实验通过 Western blot发现,100μg/ml透骨草提取物可显著下调Hela细胞Caspase-3和Bcl-2蛋白表达水平。提示透骨草提取物可能通过抑制Bcl-2/Caspase-3通路诱导Hela细胞凋亡。
1 Abu J,Batuwangala M,Herbert K et al.Retinoic acid and retinoid receptors:potential chemopreventive and therapeutic role in cervical cancer[J].Lancet Oncol,2005;6(9):712-720.
2 Haiemeder C,Crevoisier R,Bruna A et al.Concomitant chemoradiation in patients with cervix cancer[J].Bull Cancer,2005;92(12):1032-1038.
3 Lin JT,Shih SC,Chang TH etal.Docetaxel,carboplatin and 5-fluorouracil(TCF)chemotherapy in patients with unresectablemetastatic carcinoma of cervix[J].Gynecol Oncol,2010;117(1):65-69.
4 Chakrabarty S,Das A,Bhattacharya A et al.Theaflavins depolymerizemicrotubule network through tubulin binding and cause apoptosis of cervical carcinoma Hela cells[J].JAgric Food Chem,2011;59(5):2040-2048.
5 Errihani H,M'rabtiH,IsmailiN et al.PhaseⅡ trial of capecitabine and cisplatin in advanced,persistent,or recurrent carcinoma of the cervix[J].Int JGynecol Cancer,2011;21(2):337-348.
6 曾常茜,高 松,沈 阳etal.透骨草提取物对肿瘤细胞体外增殖的影响[J].辽宁中医杂志,2009;36(11):1952-1954.
7 Thomadaki H,Scorilas A.BCL-2 family of apoptosis-related genes:functions and clinical implications in cancer[J].Crit Rev Clin Lab Sci,2006;43(1):61-67.
