卡马西平对成年癫痫间大鼠海马齿状回Brd U/Neu N表达水平及其对空间记忆的影响
2012-06-14权青云杨嫣华李宏图赵晓娟林芝惠
权青云 杨嫣华 李宏图 李 峰 赵晓娟 林芝惠
癫痫间是一组由大脑神经元异常放电所引起的一组临床症状,对患者及社会造成较大危害,尤其是对患者认知功能的损害。目前国内外研究已证实在成年哺乳动物,包括人类的整个生命过程中海马齿状回均有新生的神经元产生[1]。近年不少报道关于痫间性发作诱导的损伤刺激海马齿状回(dentate gyrus,DG)的内源性神经前体细胞的神经发生[2]。抗癫痫间药是目前控制癫痫间症状的最主要的治疗方法。虽抗癫痫间药对癫痫间后海马DG新生成熟神经元的产生已有报道[3],但这些新生神经元与认知之间的关系报道较少。本实验运用氯化锂和匹罗卡品联合诱导成年大鼠癫痫间持续状态(status epilepticus,SE)模型,通过5-溴脱氧尿核苷(5-bromodeoxyuridine,Brd U)标记新生的神经细胞,利用Brd U与神经元核性蛋白(Neu N)双标记观察卡马西平(Carbamazepine,CBZ)对海马齿状回内源性神经前体细胞分化为成熟神经元的情况,同时利用行为学分析评价大鼠的空间记忆,为进一步探讨卡马西平对癫痫间患者认知影响提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及药品 氯化锂、匹罗卡品、Brd U(5 g/支)均购自sigma公司;大鼠来源抗Brd U单克隆抗体(100 ug/支)购于Santa公司;小鼠来源的Neu N抗体(500 ug/支)购于Chemicon公司;生物素化山羊抗大鼠Ig G抗体、生物素化马抗山羊IgG抗体、辣根过氧化物酶标记的链酶亲和素购于sigma公司;Alexa Fluor 594山羊抗大鼠IgG(H+L)(0.5 ml/支)购于 molecule probe;Alexa Fluor 488猴抗小鼠IgG(H+L)抗体(0.5 ml/支)购于 molecule probe。
CBZ,商品名:得理多,200 mg/片,北京诺华制药有限公司,国药准字H11022279。
行为学分析环境:安静的测试室,灯光、光线均匀,不透明的塑料测试箱(60 cm×42 cm×37 cm),SONY数码摄像机,3个尺寸相同,形状、颜色不同的物体,其中2个完全相同,体积为大鼠体积的1/2~1倍,重量大于大鼠体重。
1.1.2 动物来源及饲养条件 32只Sprague-Dawley(SD)成年雄性大鼠,体重200 g(购自第四军医大学实验动物中心),动物饲养室12 h光-暗循环(6:00-18:00),温度20~25℃,湿度30~60%,食物和水自由摄取。喂养5 d后开始进行实验。
1.2 方法
1.2.1 SE模型制作及分组 腹腔注射氯化锂(180 mg/kg),20 h后腹腔注射匹罗卡品(30 mg/kg),当大鼠痫间性发作达Ⅳ级或Ⅳ级以上并持续达90 min或抽搐致濒危时给予腹腔注射苯巴比妥钠50 mg/kg终止发作[4]。发作级别按 Racine分级[5],痫间性发作达到Ⅳ级或以上,解除痫间性发作后状态良好者视为合格SE模型。正常大鼠以相同容积的0.9%氯化钠取代氯化锂、匹罗卡品和苯巴比妥钠。随机分为4小组(正常对照组,SE组,CBZ组,SE+CBZ组),每小组各8只大鼠。
1.2.2 药物用法 于SE后5 h给各大鼠分别灌胃,正常对照组(蒸馏水,1 ml/200 g),CBZ组(CBZ 120 mg·kg-1·d-1,4 mg/ml,1 ml/200 g)[6],2次/d,8:00-20:00。于SE后第6 d为各大鼠腹腔注射Brd U(50 mg/kg),共2次,间隔2 h。
1.2.3 行为学检测方法[7]
在处死前3 d各组大鼠每天熟悉适应测试箱45 min,同时熟悉适应空测试盒5 min,连续3 d后进行测试。(1)将每只大鼠置于铺有垫料的测试盒适应1 min;(2)在测试盒规定的位置放入2个完全相同的物体,观察大鼠探索物体15 min后(熟悉阶段),将大鼠放至动物房;(3)3 h后将大鼠及两个不同的物体(其中1个是熟悉的物体)同时再次放入测试盒,观察大鼠探索物体15 min(测试阶段)。在测试过程中整个过程被摄像机记录。观察每只大鼠探索两个物体的累计时间及测试阶段探索物体前30 s中探索新物体所占比例,并进行分析。大鼠探索物体的主要标准:(1)大鼠的鼻子指向物体的距离必须小于它头的长度;(2)大鼠探索物体的过程胡须必须运动。排除标准:(1)站在物体上头向别处张望;(2)身体不经意接触物体;(3)趴在物体上、靠着物体不动。在下一个大鼠测试前每个物体和测试盒均用75%酒精彻底擦洗。
1.2.4 取材 分别给以各组大鼠戊巴比妥钠(50 mg/kg)过量麻醉后,打开胸腔,由心尖经二尖瓣至主动脉,0.9%氯化钠100 ml快速灌注,然后4%多聚甲醛400 ml先快后慢灌注30 min,取脑,4%多聚甲醛后固定2 h,20%蔗糖溶液沉底。冰冻切片机切片,留取海马部位连续冠状位切片,片厚30μm,每隔5张取一张脑片为一组收集于0.01M磷酸钾盐缓冲 生 理 盐 水 (potassium phosphate-buffered saline,KPBS)中备用。
1.2.5 免疫荧光染色 取各组大鼠的其中1组脑片,(1)行Brd U变性;(2)加大鼠抗Brd U单克隆抗体(1∶500)及小鼠抗 Neu N 单克隆抗体(1∶200)4℃孵育36 h;(3)避光环境下加山羊抗大鼠(1∶500)及驴抗小鼠(1∶500)荧光二抗室温下孵育4 h;(4)避光环境下贴片,50%甘油封片,使用日本OLYMPUS X2100共聚焦显微镜观察照相。
2 结 果
2.1 行为学分析 各组大鼠探索两个物体行为的总时间无明显差异(P>0.05)(图1A)。但是3 h后测试,对照组及CBZ+SE组大鼠在探索物体的前30 s时间内探索新物体的所占比例明显高于SE组(P<0.05)(图1B)。
2.2 各组大鼠海马DG区新生神经细胞分化为成熟神经元的情况 日本OlympusBX2100共聚焦显微镜下(×400倍)观察发现,各组大鼠海马DG区Brd U/NeuN双阳性细胞主要分布在颗粒细胞层,少数分布在门区,呈单个或两个,没有丛集性,细胞核形态比较规则(图2A)。SE组海马齿状回颗粒细胞层Brd U/NeuN双阳性细胞数较正常对照组明显减少(P<0.05),但是SE+CBZ组Brd U/NeuN双阳性细胞数量与SE组相比明显增多(P<0.05)(图2B)。

图1 A 各组大鼠探索物体总时间(s)
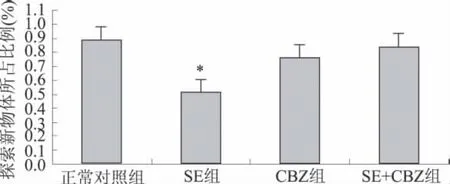
图1 B 各组大鼠探索物体前30 s内探索新物体所占比例

图2 A 各组大鼠齿状回新生成熟神经元情况(×400倍)

图2 B 各组大鼠平均每只大鼠海马齿状回Brd U/Neu N+细胞的数量
3 讨 论
本实验采用氯化锂-匹罗卡品腹腔注射造模,整个发作过程同人类SE相似。在SE后5 h给大鼠灌胃CBZ,发现CBZ明显促进新生神经细胞存活,并增加新生成熟神经元产生,与以往研究结果大致一致[8]。同时,从行为学分析发现,CBZ抗癫痫间治疗后的SE大鼠空间记忆、学习能力明显改善。而癫痫间大鼠探索新物体与旧物体的时间各占一半,提示癫痫间大鼠空间记忆能力明显下降,与以往实验结果一致[7]。因此,可以推测CBZ较长时间抗癫痫间治疗明显提高新生成熟神经元产生,是CBZ改善癫痫间大鼠的空间记忆、学习能力的实验室依据之一。
目前AEDs癫痫间药物是临床治疗癫痫的最主要、最有效手段之一,CBZ为三环类抗惊厥剂,是目前传统的AEDs之一,临床应用广泛,对癫痫间精神运动性发作、大发作、限局性发作及混合性发作均有效。由于癫痫间具有不可预测性、发作性、长期服药性等特点,不少患者误认为癫痫间发作只要在发作期控制即可,对生命造成的威胁不大,长期服用较繁琐,依从性不高。因此,临床观察癫痫间患者不正规抗癫痫间治疗癫痫间患者均存在不同程度的智能损害,并且越严重的癫痫间发作智能损害越严重,这在以往的研究中也已证实[9]。本实验结果显示,在癫痫间后CBZ干预28 d后发现新生成熟神经元明显增多,同时行为学研究发现虽然此组大鼠探索物体的累计时间与其他组别无明显差别,但在探索物体30 s时间内探索新物体所占的时间比例明显高于SE组,几乎与正常对照组相同。对于这一现象,本研究推测CBZ可以改善SE大鼠的空间记忆能力。另外,本实验发现SE组大鼠自发性癫痫间发作频繁,CBZ干预SE组大鼠在实验14 d后几乎无自发性癫痫间发作。这也为临床上我们发现癫痫间患者长时间服用CBZ,可控制癫痫间发作,并且有助于改善患者智能提供理论依据。
尽管我们发现长时间CBZ抗癫痫间干预治疗可以有效控制癫痫间症状,增加新生成熟神经元的产生,同时有效改善癫痫间大鼠的空间记忆、学习能力。但这些新生成熟神经元在改善智能方面的作用机制还需进一步研究。正确引导新生神经元发挥正面的、积极的作用将会为癫痫间患者带来新的希望。
1 Chen J,Cai F,Cao J,et al.Long-term antiepileptic drug administration during early ife inhibits hippocampal neurogenesis in the developing brain.J Neurosci Res,2009,87(13):2898-2907.
2 Jessberger S,Zhao C,Toni N,et al.Seizure-associated,aberrant neurogenesis in adult rats characterized with retrovirus-mediated cell labeling.Neurosci,2007,27(35):9400-9407.
3 Jing Chen,Qing Yunguan,Fang Yang,et al.Effects of lamotrigine and topiramate on hippocampal neurogenesis in experimental temporal-lobe epilepsy.Brain research,2010,13(13),270-282.
4 Fang Yang,Jin Cunwang,Jun-Liang Han,et al.Different Effects of Mild and Severe Seizures on Hippocampal Neurogenesis in A-dult Rats.Hippocampus,2008,18(5):460-468.
5 Kreicbergs A,Tribukait B,Willems J,et al.DNA flow analysis of soft tissue tumors.Cancer,1987,59(1):128-133.
6 Jari Nissinena,Asla Pitkanen.Effect of antiepileptic drugs on spontaneous seizures in epileptic rats.Epilepsy Research,2007,73(2):181-191.
7 Jessberger S,Nakashima K,Clemenson Jr GD,et al.Epigenetic Modulation of Seizure-Induced Neurogenesis and Cognitive Decline.J Neurosci,2007,27(22):5967-5975.
8 权青云,林芝惠,徐晓霞,等.卡马西平对匹罗卡品诱导成年癫痫间大鼠海马齿状回神经发生的影响.卒中与神经疾病,2011,18(2):78-81,92.
9 李茂林,权青云,林芝惠.不同程度的痫间性发作对成年大鼠空间学习记忆影响的研究.脑与神经疾病杂志,2010,18(2):148-151.
