淫羊藿苷对大鼠肝药物代谢Ⅱ相酶和药物转运体的影响①
2012-06-11李利生王安斌陆远富石京山
李利生,刘 娟,王安斌,陈 澜,陆远富,刘 杰,石京山
(1.贵州省基础药理重点实验室暨遵义医学院药理教研室,贵州 遵义 563000;2.遵义医学院附属医院临床医学研究所,贵州 遵义 563000)
淫羊藿苷(icariin,ICA)为小檗科淫羊藿属植物淫羊藿的主要活性成分,具有调节免疫和内分泌、治疗男性勃起功能障碍和抗老年痴呆等药理作用[1]。含淫羊藿的中药复方或中成药已经广泛应用于临床,而且老年人群中常需服用多种药物,发生药物相互作用的可能性相应增加。本研究探讨了ICA对大鼠药物代谢Ⅱ相酶谷胱甘肽-S转移酶(glutathione S -transferase,GSTs)和尿苷 -5'-二磷酸葡醛酰转移酶(uridine 5'-diphosphate glucuronosyl transferase,UGTs)以及药物转运蛋白有机阴离子转运多肽(organic anion transporting polypeptide,Oatp)和有机阴离子转运体(organic anion transporter,OAT)基因表达、活性或含量的影响,并比较了月龄的差异,为临床特别是老年人群安全合理用药提供指导,为ICA新药开发提供药动学基础资料。
1 材料与方法
1.1 药品、试剂和仪器 ICA(南京替斯艾么中药研究所,纯度>98%);OAT2、Oatp2酶联免疫分析试剂盒(美国R&D systems);2-氨基酚、UDP-葡萄糖醛酸、谷胱甘肽(美国sigma);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);Trizol、RNA纯化试剂盒、RT-PCR试剂盒、β-actin、UGT1A6、UGT2B7、GST - π、OAT2、Oatp2mRNA 引物(大连宝生物工程有限公司)。Multiskan Spectrum全波长酶标仪(芬兰Thermo);L-100XP冷冻超速离心机(美国Beckman Coulter);RNA逆转录仪(德国Eppendorf);UV-3010紫外可见分光光度计(日本日立公司);实时定量RT-PCR扩增仪(美国BIO-RAD)。
1.2 分组及给药方案 6月龄(体重200~240 g)和18月龄(体重420~460 g)SD大鼠,♂,购自第三军医大学大坪医院动物中心,许可证号:SCXK(渝)2007-0005。适应性喂养1周,随机分为6月龄大鼠生理盐水组(6NS)和ICA组(6ICA),18月龄大鼠生理盐水组(18 NS)和ICA组(18 ICA),每组8只;ICA按60 mg·kg-1灌胃给药,每天1次,连续28 d,生理盐水组给予等体积生理盐水。
1.3 钙沉淀法提取肝微粒体并测定蛋白含量[2]
肝脏匀浆后离心,分离上清液加入钙,冰浴后再离心(27 kg×15 min,4℃),留取沉淀物加入400 μL Tris- KCl重悬后离心(27 kg×15 min,4℃),即得微粒体,弃上清液加入500 μL的PBS重悬。BCA法测微粒体蛋白含量。
1.4 肝微粒体酶学分析[2、3]GSTs可催化二硝基氯苯和谷胱甘肽为生成2,4-二硝基苯-谷胱甘肽复合物,产物的生成量反映酶活性,测定后者OD340 nm,根据公式计算酶活性:GST活性(μmol·L-1·min-1·mg-1)=OD340nm/9.6 × 蛋白浓度(9.6为2,4-二硝基苯-谷胱甘肽复合物的消光系数)。肝微粒体UGTs活性测定以2-氨基酚为底物,紫外分光光度法测定,根据苯胺标准曲线计算酶活性,以“nmol苯胺·min-1·mg-1蛋白”表示。
1.5 OAT2和Oatp2含量测定 取肝组织匀浆,BCA法测定匀浆液中蛋白含量,将蛋白浓度稀释为5 mg·mL-1,采用ELISA法测定OAT2和Oatp2含量,根据试剂盒说明书操作。
1.6 Real time RT - PCR 检测 UGT1A6、UGT2B7、GST-π、OAT2、Oatp2 mRNA的表达 Trizol法提取RNA并纯化,将RNA母液稀释为50 ng·L-1用于逆转录,反应条件:37℃15 min,85℃5sec。逆转录所得cDNA经Real-Time RT-PCR进行扩增,反应条件:95℃,10 min(预变性);95℃ 10 sec(变性),60℃1 min(复性),40个循环。以内参基因为100%,目的基因相对表达量以“目的基因/内参基因”表示。各基因及其引物信息(见表1)。1.7 统计学方法 采用SPSS 13.0软件进行数据分析,结果以均数±标准差(s)表示,同月龄大鼠组间比较采用t检验,ICA对药物代谢Ⅱ相酶及药物转运体影响的月龄差异采用双因素方差分析,P<0.05为差异有统计学意义。

表1 β -actin、UGT1A6、UGT2B7、GST-π、OAT2和 Oatp2基因引物信息
2 结果
2.1 ICA对大鼠肝OAT2和Oatp2含量的影响图1可见,与NS组比较,ICA组大鼠肝组织OAT2和Oatp2含量显著增高(均P<0.05)。6月龄和18月龄大鼠肝组织OAT2和Oatp2含量的增加幅度相当,ICA对OAT2和Oatp2含量的促进作用月龄间未见显著差异。
2.2 ICA 对大鼠肝 UGT1A6、UGT2B7、GST - π、OAT2和Oatp2 mRNA表达的影响 与相应NS组比较,ICA组大鼠肝OAT2、Oatp2mRNA的表达显著增高,但不同月龄间未见明显差异。ICA对UGT1A6、UGT2B7、GST-π mRNA 的表达无明显影响。ICA对上述基因表达的影响与相应的酶含量或活性的变化一致(见表2)。

图1 ICA对大鼠肝OAT2和Oatp2含量的影响(s,n=8)
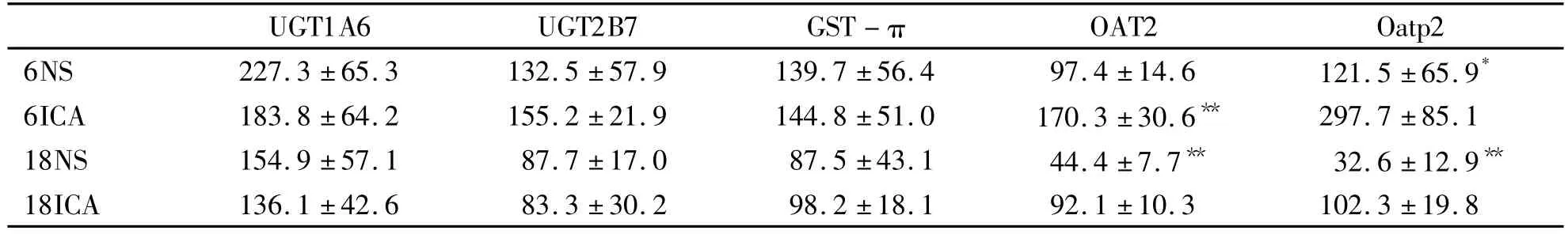
表2 ICA对大鼠肝UGT1A6、UGT2B7、GST-π、OAT2和Oatp2 mRNA表达的影响(x ± s,n=8)
2.3 ICA对大鼠肝微粒体UGTs、GSTs活性的影响 表3可见ICA对大鼠肝微粒体UGTs、GSTs活性无明显影响(均P<0.05)。

表3 ICA对大鼠肝药酶部分亚型活性的影响(x ± s,n=8)
3 讨论
从传统意义上讲,通过Ⅰ相和Ⅱ相药物代谢酶介导的药物代谢的改变是药物相互作用的原因。但越来越多的研究表明,药物转运蛋白的改变也是导致药物代谢消除改变的原因之一[4]。肝脏是富含药物代谢酶和药物转运体的器官,是药物代谢的主要场所,并有学者将转运蛋白对药物的作用称为Ⅲ相代谢。参与Ⅰ相反应的CYP氧化酶、Ⅱ相反应的结合酶和药物转运蛋白可因某些药物的影响而被诱导或抑制,是临床药物相互作用关注的重点。UGTs是Ⅱ相反应中最主要的酶系,分为参与酚和胆红素代谢的UGT1家族和参与类固醇代谢的UGT2家族,哺乳动物UGTs负责数以百计的疏水性内源和外源化合物的葡醛酸化,其中UGT1A6和UGT2B7是已知代谢外源性底物较多且在肝脏均有表达的亚型[5]。本研究发现ICA对UGTs活性和UGT1A6、UGT2B7 mRNA的表达无明显影响,提示在临床上与其他药物如吗啡、对乙酰氨基酚合用时,不会对后者的代谢产生影响。
许多药物经过Ⅰ相代谢的产物需与谷胱甘肽结合生成强极性物质经肾脏或胆汁排泄。催化谷胱甘肽结合反应的酶为GSTs,位于肝、肾等组织的细胞液中。根据其基因序列的保守性和免疫交叉活性分为α、μ、π和θ等亚型。肝脏是富含GST-π 的器官[6、7]。ICA 对大鼠肝组织中 GST- π mRNA的表达和GSTs活性未见显著影响,与其他药物合用时不需考虑其对GSTs的影响所导致的药物间相互作用。
药物的体内过程受生物膜的影响,药物能否通过生物膜不仅取决于药物的理化性质,而且受转运蛋白的影响。Oatp是转运内源性和外源性化合物的膜蛋白[8],可将多种药物从血液向胆汁转运,在Oatp家族成员中,Oatp2在肝组织大量表达,介导胆汁酸、强心苷、他汀类药物的转运[9],ICA上调肝组织Oatp2 mRNA的表达,增加Oatp2的含量,进而促进Oatp2的底物向胆汁运输,但ICA对脉络丛和视网膜色素上皮细胞的Oatp2的表达是否具有类似作用有待进一步研究。OAT蛋白在肝脏、肾脏和脑部表达,有三个主要成员,其中OAT2只在肝脏表达,已知的底物包括甲氨蝶呤、水杨酸盐等[10]。给予大鼠ICA后OAT2的含量明显增加,OAT2 mRNA的表达也呈一致改变,表明ICA对OAT2具有诱导作用,可能影响经OAT2转运的药物的体内过程。ICA对OAT其他亚型的影响待深入研究。
[1]龚其海,杨丹莉,石京山,等.淫羊藿苷的神经药理作用及分子机制研究进展[J].中国新药与临床杂志,2011,30(7):481-486.
[2]徐叔云.药理学实验方法[M].第3版.北京:人民卫生出版社,2001.510-520.
[3]袁靖,赵军宁,李祖伦.虎杖苷对小鼠肝细胞色素P450和II相酶的影响[J].中药药理与临床,2007,23(2):12-14.
[4]曾苏.药物代谢学[M].杭州:浙江大学出版社,2004.134-144.
[5]Loureiro A I,Fernandes-Lopes C,Bonifácio M J.Hepatic UDP-glucuronosyl transferase is responsible for eslicarbazepine glucuronidation.Drug Metab Dispos,2011,39(9):1486-1494.
[6]Vasieva O.The many faces of glutathione transferase pi.Curr Mol Med,2011,11(2):129-39.
[7]杨秀芬,钟正贤,廖梅春,等.蛇葡萄素与苯并芘合用对大鼠肺组织内CYP和GST基因表达的影响[J].中国药理学通报,2010,26(1):135-136.
[8]Yoshitaka HASEGAWA,Shuichi KISHIMOTO,Naoki SHIBATANI,et al.The Disposition of Pravastatin in a Rat Model of Streptozotocin-Induced Diabetes and Organic Anion Transporting Polypeptide 2 and Multidrug Resistance-Associated Protein-2 Expression in the Liver[J].Biol.Pharm.Bull,2010,33(1)153-156.
[9]Michiaki ABE,Takafumi TOYOHARA,Akiko ISHII,et al.The HMG-CoA Reductase Inhibitor Pravastatin Stimulates Insulin Secretion through Organic Anion Transporter Polypeptides[J].Drug Metab.Pharmacokinet,2010,25(3):274-282.
[10]Burckhardt G,Burckhardt B C.In vitro and in vivo evidence of the importance of organic anion transporters(OATs)in drug therapy[J].Handb Exp Pharmacol,2011,(201):29-104.
